N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)酰胺的合成
陈维杰,刘 颖,余 云,吴金红,杨绪红
(湖北科技学院核技术与化学生物学院,湖北 咸宁437100)
酰胺类似物(如氟啶酰胺、苯噻菌胺、异苯噻菌胺及噻唑酰胺等[1-3])是一类经典的杀菌剂,兼具杀菌、杀虫活性,部分化合物还具有除草活性。其中,酰胺稠杂环类似物具有良好的抑菌活性,且高活性化合物主要是五元、六元杂环及苯并五元杂环,如图1所示。

图1 部分酰胺稠杂环类似物的结构Fig.1 Structures of amide fused-heterocycle analogues
化合物Ⅰ是由曹达公司开发的杀菌剂,浓度为100mg·L-1时对苹果黑星病菌、番茄晚疫病菌的抑制率高于75%[4];日本三井化学株式会社开发的苯并唑酰胺类似物Ⅱ,在浓度为250mg·L-1时对马铃薯晚疫病菌、腐霉病菌、霜霉病菌的抑制率高于95%[5];住友化学株式会社开发的化合物Ⅲ,在浓度为200mg·L-1时对油菜菌核病菌的抑制率达100%[6];李兴海等[7]报道,化合物Ⅳ在浓度为25mg·L-1时对黄瓜炭疽病菌及番茄晚疫病菌的抑制率高于90%;张琨等[8]报道咪唑酰胺类似物Ⅴ在浓度为100mg·L-1时对苹果炭疽病菌、番茄灰霉病菌及小麦赤霉病菌的抑制率高于90%;闫涛等[9]报道化合物Ⅵ在浓度为50 mg·L-1时对苹果轮纹病菌的抑制率达42%;李帅等[10]报道由没食子酸衍生的二芳基烷基酰胺类似物Ⅶ在浓度为62.5mg·L-1时对辣椒疫霉病菌活体的抑制率达100%。
喹唑啉酮是一类具有良好生物活性和药理活性的氮杂环化合物,在抗菌、消炎、止痛、抗痉挛、抗高血压、抗癌等方面显示出优良活性[11-16]。Yang等[17]采用氮杂-Wittig反应合成了3-氨烷基-2-芳氨基喹唑啉酮。Wang等[18]以Schiff碱为先导,将氨烷基喹唑啉酮引入Schiff碱中,合成了一系列含喹唑啉酮Schiff碱,多数化合物在浓度为200mg·L-1时对烟草青枯病菌、蕃茄青枯病菌和水稻白叶枯病菌的抑制率达100%。
作者以酰胺类似物为先导,根据活性亚结构拼接原理,将活性基团喹唑啉酮乙基导入酰胺基中,设计合成一系列含喹唑啉酮乙基的新型酰胺类似物,以期发现作用机制新颖、具有良好抑菌活性的化合物。
1 实验
1.1 试剂与仪器
无水乙醇用金属钠和邻苯二甲酸二乙酯处理后蒸馏,二氯甲烷用无水氯化钙干燥,二氯亚砜重新蒸馏,乙二胺重新蒸馏用分子筛干燥保存,其它试剂均为市售分析纯或化学纯。
FTIR-650型傅立叶变换红外光谱仪,KBr压片;Bruker AV400(400MHz)型核磁共振仪;YRT-3型熔点仪(温度计未经校正);HP 5988A型质谱仪;Vario ERⅢ型元素分析仪。
1.2 中间体7-氯-3-氨乙基-2-苯氨基喹唑啉酮(化合物6)的合成
参照文献[18]方法,将4-氯-2-氨基苯甲酸经重氮化、叠氮化、酯化反应制得4-氯-2-叠氮基苯甲酸乙酯,再与三苯基膦反应制得相应的膦亚胺(化合物4),化合物4再与苯基异氰酸酯反应制得碳二亚胺(化合物5),在乙二胺略过量条件下,将化合物5慢慢滴入到乙二胺中反应制得关键中间体6。合成路线见图2。
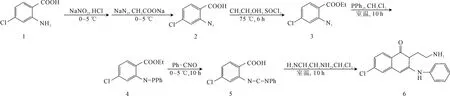
图2 中间体6的合成路线Fig.2 Synthetic route of intermediate 6
1.3 目标化合物的合成(图3)

图3 目标化合物的合成路线Fig.3 Synthetic route of target compounds
将含取代基的羧酸(1.2mmol)置于50mL圆底烧瓶中,以干燥的二氯甲烷作溶剂,冰浴下滴加0.5 mL二氯亚砜,滴加完后再滴加2滴DMF作催化剂,撤去冰浴,常温下搅拌3h。TLC监测(取少量加入无水甲醇,以乙酸乙酯∶石油醚=1∶2作展开剂)反应完成后,旋蒸,粗产品用无水乙醚洗涤后再旋蒸,用干燥二氯甲烷溶解得溶液A。
称取0.315g(0.1mmol)中间体6于50mL圆底烧瓶中,用干燥二氯甲烷作溶剂,常温下搅拌溶解,加新蒸馏处理好的三乙胺使溶液碱性化,将处理好的A液沿恒压漏斗滴入圆底烧瓶,滴完后加热回流搅拌6h。TLC监测反应完成后,旋蒸,用无水乙醇洗涤,抽滤,得目标化合物7a~7m,用无水乙醇重结晶纯化。
2 结果与讨论
中间体6和目标化合物7a~7m的结构表征如下:
中间体6,7-氯-3-氨乙基-2-苯氨基喹唑啉酮:白色固体,m.p.181~182℃;1HNMR(600MHz,DMSOd6),δ:7.95(d,J=8.5Hz,1H),7.64(d,J=7.8Hz,2H),7.34(dd,J=13.1Hz,4.7Hz,3H),7.22~7.16(m,1H),7.06(t,J=7.4Hz,1H),5.86(s,3H),4.19~4.11(m,2H),3.04~2.97(m,2H);IR(KBr),ν,cm-1:3 344,3 283,3 185,3 079,2 840,2 353,1 678,1 575,1 320,1 245,768,695;MS(ESI),m/z:315.1([M+H]+),337.1([M+Na]+)。
目标化合物7a,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)苯甲酰胺:白色固体,m.p.>259℃,产率85%;1HNMR(400MHz,DMSO-d6),δ:9.27(s,1H),9.05(s,1H),7.97(d,J=8.5 Hz,1H),7.82(t,J=8.0Hz,4H),7.54(d,J=7.4 Hz,1H),7.41(ddd,J=14.1Hz,10.4Hz,4.6Hz,5H),7.24(d,J=8.5Hz,1H),7.13(t,J=7.4Hz,1H),4.37(t,J=6.6Hz,2H),3.61(d,J=6.1Hz,2H);IR(KBr),ν,cm-1:3 364,3 285,3 202,3 055,1 672,1 658,1 595,1 584,1 491,1 468,1 354,1 312,1 238,862,762;MS(ESI),m/z:419.3([M+H]+),441.2([M+Na]+);Anal.calcd for C23H19ClN4O2:C 65.95,H 4.57,N 13.38;found C 66.04,H 4.88,N 13.16。
目标化合物7b,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2-氟苯甲酰胺:白色固体,m.p.241~242℃,产率53%;1HNMR(400MHz,DMSOd6),δ:9.09(s,1H),8.75(s,1H),7.97(d,J=8.5 Hz,1H),7.74(d,J=7.9Hz,2H),7.56(dt,J=12.7 Hz,6.6Hz,2H),7.43~7.19(m,6H),7.12(t,J=7.3Hz,1H),4.39(d,J=6.2Hz,2H),3.62(d,J=5.9Hz,2H);IR(KBr),ν,cm-1:3 385,3 239,3 046,1 652,1 567,1 469,1 309,1 251,761,682;MS(ESI),m/z:437.2([M+H]+),459.2([M+Na]+);Anal.calcd for C23H18ClFN4O2:C 63.23,H 4.15,N 12.82;found C 62.19,H 4.28,N 12.78。
目标化合物7c,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-3-氟苯甲酰胺:白色固体,m.p.>270℃,产率56%;1HNMR(400MHz,DMSO-d6),δ:9.12(s,1H),9.05(s,1H),7.95(d,J=8.5Hz,1H),7.74(t,J=7.2Hz,2H),7.63(d,J=7.7Hz,1H),7.57~7.45(m,2H),7.37(dd,J=18.9Hz,10.8Hz,4H),7.23(d,J=8.5Hz,1H),7.11(t,J=7.3Hz,1H),4.39(t,J=6.3Hz,2H),3.61(d,J=5.7Hz,2H);IR(KBr),ν,cm-1:3 358,3 272,3 069,2 919,1 671,1 648,1 590,1 557,1 469,1 312,1 235,905,759,680;MS(ESI),m/z:437.2([M+H]+),459.2([M+Na]+);Anal.calcd for C23H18ClFN4O2:C 63.23,H 4.15,N 12.82;found C 62.15,H 4.30,N 12.76。
目标化合物7d,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2,6-二氟苯甲酰胺:黄色固体,m.p.>270℃,产率46%;1HNMR(400MHz,DMSO-d6),δ:9.15(s,1H),8.96(s,1H),7.97(d,J=8.5 Hz,1H),7.72(d,J=8.0Hz,2H),7.56~7.45(m,1H),7.36(dd,J=18.7Hz,11.0Hz,3H),7.26~7.06(m,4H),4.39(t,J=6.4Hz,2H),3.63(d,J=6.1Hz,2H);IR(KBr),ν,cm-1:3 312,3 206,3 142,3 058,2 917,2 848,1 675,1 655,1 623,1 582,1 460,1 358,1 231,754,688;MS(ESI),m/z:455.2([M+H]+),477.2([M+Na]+);Anal.calcd for C23H17ClF2N4O2:C 60.73,H 3.77,N 12.32;found C 60.58,H 3.90,N 12.18。
目标化合物7e,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2-氯苯甲酰胺:白色固体,m.p.247~248℃,产率89%;1HNMR(400MHz,DMSOd6),δ:9.75(s,1H),8.05~7.78(m,4H),7.55~7.19(m,9H),4.51(s,2H),3.83(s,2H);IR(KBr),ν,cm-1:3 363,3 285,3 056,1 672,1 595,1 584,1 491,1 468,1 356,1 242,862,762;MS(ESI),m/z:453.2([M]+);Anal.calcd for C23H18Cl2N4O2:C 60.94,H 4.00,N 12.36;found C 60.85,H 4.12,N 12.27。
目标化合物7f,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-4-氯苯甲酰胺:白色固体,m.p.261~262℃,产率68%;1HNMR(400MHz,DMSOd6),δ:9.16(s,1H),9.07(s,1H),7.96(d,J=8.4 Hz,1H),7.78(dd,J=23.4Hz,8.1Hz,4H),7.53(d,J=8.3Hz,2H),7.42~7.26(m,3H),7.23(d,J=8.4Hz,1H),7.12(t,J=7.3Hz,1H),4.37(d,J=6.3Hz,2H),3.60(d,J=5.8Hz,2H);IR(KBr),ν,cm-1:3 293,3 202,3 077,2 923,1 665,1 582,1 549,1 447,1 332,1 244,774,666;MS(ESI),m/z:453.2([M]+);Anal.calcd for C23H18Cl2N4O2:C 60.94,H 4.00,N 12.36;found C 60.88,H 4.15,N 12.29。
目标化合物7g,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2,4-二氯苯甲酰胺:白色固体,m.p.235~236℃,产率61%;1HNMR(400MHz,DMSO-d6),δ:9.02(s,1H),8.90(s,1H),7.99(d,J=8.5Hz,1H),7.78~7.61(m,3H),7.45(d,J=7.9 Hz,1H),7.42~7.34(m,3H),7.32(s,1H),7.24(d,J=8.3Hz,1H),7.13(t,J=7.3Hz,1H),4.43(d,J=5.9Hz,2H),3.61(d,J=5.8Hz,2H);IR(KBr),ν,cm-1:3 382,3 300 3 135,2 921,1 673,1 652,1 589,1 550,1 459,1 352,1 240,868,761,680;MS(ESI),m/z:487.2([M]+);Anal.calcd for C23H17Cl3N4O2:C 56.64,H 3.51,N 11.49;found C 56.69,H 3.60,N 11.46。
目标化合物7h,2-氯-N-(2-(7-氯-4-氧 代-2-苯 氨基喹唑啉-3(4 H)-基)乙基)-2-氯烟酰胺:白色固体,m.p.263~264℃,产 率82%;1HNMR(400MHz,DMSO-d6),δ:9.00(s,1H),8.46(s,1H),7.99(d,J=8.5Hz,1H),7.75(dd,J=25.7Hz,7.4Hz,3H),7.49~7.02(m,7H),4.45(d,J=5.9Hz,2H),3.63(d,J=5.8Hz,2H);IR(KBr),ν,cm-1:3 352,3 202,3 035,2 918,1 668,1 647,1 602,1 595,1 558,1 463,1 396,1 257,770,668;MS(ESI),m/z:454.2([M]+);Anal.calcd for C22H17Cl2N5O2:C 58.16,H 3.77,N 15.42;found C 58.12,H 3.88,N 15.38。
目标化合物7i,4-氯-N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-3-硝基苯甲酰胺:白色固体,m.p.>259℃,产率56%;1HNMR(400MHz,DMSO-d6),δ:9.20(s,1H),8.98(s,1H),8.33(s,1H),7.97(dd,J=21.9Hz,8.5Hz,2H),7.86(d,J=8.5 Hz,1H),7.63(d,J=7.8Hz,2H),7.37~7.18(m,4H),7.08(d,J=7.4Hz,1H),4.44(d,J=5.8Hz,2H),3.63(d,J=5.3Hz,2H);IR(KBr),ν,cm-1:3 349,3 289,3 059,2 918,1 652,1 592,1 551,1 465,1 352,1 235,757,676;MS(ESI),m/z:498.2([M]+);Anal.calcd for C23H17Cl2N5O4:C 55.44,H 3.44,N 14.05;found C 55.46,H 3.55,N 14.01。
目标化合物7j,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2-溴苯甲酰胺:白色固体,m.p.257~258℃,产率81%;1HNMR(400MHz,DMSOd6),δ:9.11(s,1H),8.90(s,1H),8.00(d,J=8.6 Hz,1H),7.77(d,J=8.1Hz,2H),7.65(d,J=7.1 Hz,1H),7.38(dd,J=12.4Hz,6.1Hz,6H),7.24(d,J=8.5Hz,1H),7.13(t,J=7.6Hz,1H),4.41(d,J=5.4Hz,2H),3.60(d,J=5.4Hz,2H);IR(KBr),ν,cm-1:3 331,3 211,3 030,1 672,1 645,1 605,1 584,1 442,1 358,1 236,862,752;MS(ESI),m/z:498.2([M+H]+),520.2([M+Na]+);Anal.calcd for C23H18BrClN4O2:C 55.50,H 3.64,N 11.26;found C 55.56,H 3.72,N 12.21。
目标化合物7k,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2-甲氧基苯甲酰胺:黄色固 体,m.p.139~140℃,产 率83%;1HNMR(400MHz,DMSO-d6),δ:9.41(s,1H),8.84(s,1H),7.99(d,J=8.6Hz,1H),7.84(d,J=7.5Hz,3H),7.56~7.31(m,4H),7.12(ddd,J=43.1Hz,27.0Hz,7.9Hz,4H),4.33(d,J=6.6Hz,2H),3.86(s,3H),3.65(d,J=6.0Hz,2H);IR(KBr),ν,cm-1:3 368,3 279,3 078,2 961,1 672,1 612,1 514,1 464,1 356,1 240,862,758;MS(ESI),m/z:449.3([M+H]+),471.2([M+Na]+);Anal.calcd for C24H21ClN4O3:C 64.21,H 4.72,N 12.48;found C 64.15,H 4.85,N 12.46。
目标化合物7l,N-(2-(7-氯-4-氧代-2-苯氨基喹唑啉-3(4 H)-基)乙基)-2-硝基苯甲酰胺:黄色固体,m.p.243~244℃,产率50%;1HNMR(400MHz,DMSO-d6),δ:9.75(s,1H),9.02(d,J=5.9Hz,1H),8.96(s,1H),8.25(d,J=11.3Hz,2H),8.04(d,J=8.5Hz,1H),7.78(d,J=8.6Hz,1H),7.68(d,J=8.0Hz,2H),7.31(m,4H),7.13(t,J=7.3Hz,1H),4.52(m,2H),3.65(d,J=5.6Hz,2H);IR(KBr),ν,cm-1:3 283,3 212,3 056,2 923,1 675,1 656,1 612,1 595,1 551,1 457,1 345,1 231,753,676;MS(ESI),m/z:464.2([M+H]+),486.2([M+Na]+);Anal.calcd for C23H18ClN5O4:C 59.55,H 3.91,N 15.10;found C 59.56,H 3.40,N 15.18。
目标化合物7m,N-(2-(7-氯-4-氧代-2-苯 氨 基喹唑啉-3(4 H)-基)乙基)-4-硝基苯甲酰胺:黄色固体,m.p.>259℃,产率88%;1HNMR(400MHz,DMSO-d6),δ:9.18(s,1H),9.00(s,1H),8.23(d,J=8.8 Hz,2H),7.92(t,J=9.0Hz,3H),7.65(d,J=7.9 Hz,2H),7.34~7.24(m,3H),7.18(d,J=8.4Hz,1H),7.06(t,J=7.1Hz,1H),4.39(d,J=6.0Hz,2H),3.60(d,J=6.0Hz,2H);IR(KBr),ν,cm-1:3 352,3 292,3 096,1 673,1 595,1 550,1 491,1 458,1 348,1 240,764 694;MS(ESI),m/z:464.2([M+H]+),486.2([M+Na]+);Anal.calcd for C23H18ClN5O4:C 59.55,H 3.91,N 15.10;found C 59.46,H 4.00,N 15.08。
目标化合物7a~7m属于仲酰胺,从上述波谱数据可知:
(1)IR谱图中,在1 672cm-1附近出现了一个属于酰胺νC=O的强吸收峰,即酰胺I带;在1 595~1 483 cm-1范围内出现了酰胺Ⅱ带;在1 356~1 242cm-1范围内出现了酰胺Ⅲ带;它们都是由δNH和νC-N之间偶合造成的。喹唑啉酮上的νC=O属于共轭叔酰胺,出现在1 652cm-1附近。目标化合物7a~7m含有3个不同取代的苯环,在4个区域有其特征吸收:3 055cm-1附近的νC-H;苯环的骨架振动约在1 600cm-1和1 500 cm-1处,与酰胺Ⅱ带有重叠,难以分辨。苯环质子的面外弯曲振动δ=CH约在862cm-1和762cm-1处,正确反映了苯环的取代情况。属于仲胺的νNH吸收与仲酰胺的νNH有重叠,不易分辨。
(2)1HNMR谱图中,在化学位移9.00ppm附近有2个单峰,位移大的一个为目标化合物在酰胺基上氢的吸收峰,位移小的一个为与喹唑啉母环2位相连的苯氨基N-H的吸收峰,从峰形上看,苯氨基N-H的吸收峰要低些;在化学位移为7.10~8.35ppm之间有表现较为复杂的多重峰,将其归属为苯环上氢的吸收峰;化学位移在4.40ppm左右的吸收峰属于靠近氮杂环的亚甲基上的2个氢的吸收峰;化学位移3.50ppm左右的吸收峰属于靠近酰胺的亚甲基上的2个氢的吸收峰。
(3)目标化合物7a~7m的MS及元素分析数据均与化合物结构相符。
3 结论
以4-氯-2-氨基苯甲酸为起始原料,经重氮化、叠氮化、酯化反应合成4-氯-2-叠氮基苯甲酸乙酯,再与三苯基膦反应得到膦亚胺,再通过氮杂-Wittig反应得到关键中间体7-氯-3-氨乙基-2-苯氨基喹唑啉酮,再以酰胺类似物为先导,将喹唑啉酮乙基引入酰胺基中合成新型含喹唑啉酮乙基的酰胺类似物,所有目标化合物结构经IR、1HNMR、MS及元素分析确证。
[1]张一宾.芳酰胺类杀菌剂的沿变——从萎锈灵、灭锈胺、氟酰胺到吡噻菌胺、啶酰菌胺[J].世界农药,2007,29(1):1-7.
[2]朱书生,卢晓红,陈磊,等.羧酸酰胺类(CAAs)杀菌剂研究进展[J].农药学学报,2010,12(1):1-12.
[3]周爱新,曲有乐,周天明,等.2-[(4S,5R)-4-酰 胺基-5-甲基-3-氧代-2-异恶唑烷基]-5-氧代-2-四氢呋喃甲酸钠的抑酶和抗菌活性研究[J].中国抗生素杂志,1996,21(6):414-418.
[4]HARAY Y,SANO H,HARAMOTO M.Condensed hetercyclic derivative and agricultural and horticultural fungicide:JP,2005145840A[P].2003-11-12.
[5]MITSUI C I,KOBAYASHI Y,KAKIMOTO T,et al.Diamine derivative,its manufacturing method and bactericide having the same as active ingredient:JP,2006298785A[P].2005-04-18.
[6]SUMITOMO C C,KANDO Y,SKAGUCHI Y,et al.Amide compound and thereof for controlling vegetable diaease:JP,2009173590[P].2008-01-25.
[7]李兴海,祁之秋,钟昌继,等.苯甲酰基甲磺酰胺的合成与杀菌活性[J].农药学学报,2008,10(2):136-140.
[8]张琨,宋荣成,廖国辉,等.1-甲基-3-二氟甲基吡唑酰胺类化合物的合成及抑菌活性[J].农药学学报,2011,13(6):576-580.
[9]闫涛,于观平,熊丽霞,等.新型邻甲酰胺基间苯二甲酰胺类化合物的设计合成及生物活性[J].高等学校化学学报,2011,32(8):1750-1754.
[10]李帅,王满意,王红学,等.N-(3,5-二甲氧基-4-烷氧基苯乙基)扁桃酰胺类杀菌剂的设计合成及杀菌活性[J].农药学学报,2012,14(1):17-23.
[11]PEREIRA M F,CHEVROT R,ROSENFELD E,et al.Synthesis and evaluation of the antimicrobial activity of novel quinazolinones[J].Enzym Inhib Med Chem,2007,22(5):577-583.
[12]HALOVA-LAJOIE B,BRUMAS V,FIALLO M M L,et al.Copper(Ⅱ)interactions with non-steroidal anti-inflammatory agents[J].Inorg Biochem,2005,100(3):362-373.
[13]PANDEYA S N,SRIRAM D,NATH G,et al.Synthesis antibacterial,antifungul and anti-HIV evaluation of Schiff and Mannich bases of isatin derivatives with 3-anlino-2-methylmercapto-quinazolin-4(3 H)-one[J].Pharm Acta Hel,1999,74(11):11-17.
[14]SRIVASTAVA A V K,KUMAR A.Synthesis of newer thiadiazolyl and thiazolidinonyl quinazolin-4(3 H)-ones as potential anticonvulsant agents[J].Eur J Med Chem,2002,37(11):873-882.
[15]RAM V J,FARHANU U,TFIPATHI B K,et al.Synthesis and antihyperglycemic activity of suitably functionalized 3 H-quinazolin-4-ones[J].Bioorg Med Chem,2003,11(11):2439-2444.
[16]BERMAN E M,WERBEL L M.The renewed potential for folate antagonists in contemporary cancer chemotherapy[J].J Med Chem,1991,34(2):479-485.
[17]YANG X H,WU M H,SUN S F,et al.Synthesis of 3-aminoalkyl-2-arylaminoquinazolin-4(3 H)-ones and 3,3′-disubstituted bis-2-arylaminoquinazolin-4(3 H)-ones via reactions of 1-aryl-3-(2-ethoxycarbonylphenyl)carbodiimides with diamines[J].J Heterocycl Chem,2008,35(5):1365-1369.
[18]WANG X,LI Z N,YIN J,et al.Synthesis and bioactivity evaluation of novel arylimines containing 3-aminoethyl-2-[(p-trifluoromethoxy)anilino]-4(3 H)-quinazolinone moiety[J].Journal of Agricultural and Food Chemistry,2013,61(40):9575-9958.

