瓜蒌皮注射液干预急性心肌梗死的机制研究
赵启韬, 黄臻辉, 琚 姝, 张永清*
(1. 山东中医药大学中药学博士后流动站,山东 济南250355;2. 上海第一生化药业有限公司药物研究所,上海200336)
急性心肌缺血是导致心脏病患者心肌梗死、心绞痛的直接原因,也是患者主要的死亡原因[1-2]。瓜蒌皮注射液是最早上市的中成药之一,多年临床实践证明,该药治疗冠心病痰浊壅塞证疗效显著[3-4],但该药系统、规范地药效评估及作用机制研究一直欠缺。在前期研究中,利用结扎冠状动脉制造急性心肌缺血大鼠模型,采用目前权威的心肌缺血诊断指标,如心电图ST 段变化值、心肌梗死面积、心肌梗死率、血浆5 项心肌酶活性等,系统评估了瓜蒌皮注射液对急性心肌缺血的干预效果。结果显示该药对急性实验性心肌缺血保护作用显著(研究数据另行整理投稿)。本研究通过检测瓜蒌皮注射液对急性心肌缺血大鼠体内ET/NO、TXB2/6-kete-PGF1a、SOD/MDA 平衡的影响,探究该注射液对心肌缺血动物的血管扩张程度、血液凝集状态,以及心肌组织氧化应激状态的调节作用,旨在明确瓜蒌皮注射液发挥药效的途径,为最终探明瓜蒌干预冠心病的机制奠定基础。
1 材料与方法
1.1 动物 Wistar 大鼠,体质量220 ~300 g,雄性,由山东鲁抗医药股份有限公司提供。
1.2 试剂 瓜蒌皮注射液 (上海第一生化制药厂,4 g/mL);丹参注射液(广州白云山和记黄埔中药有限公司,批号A1A031,3 g/mL);内皮素(ET)、一氧化氮(NO)、内皮型一氧化氮合酶 (eNOS)、6-酮-前列环素(6-Keto-PGF1a)、血栓素B2(TXB2)、脂质过氧化物 (丙二醛,MDA)、超氧化物歧化酶(SOD)7 种试剂盒(中生北控生物科技股份有限公司,批号20000271,以及南京建成生物科技公司)。
1.3 动物分组及处理 50 只大鼠随机分为对照、模型、丹参注射液、瓜蒌注射液大、小剂量5 个组,每组10 只。大鼠自由饮食饮水。腹腔注射给药,连续给药7 d。其中瓜蒌大剂量组给予瓜蒌注射液4 mL/(kg·d),瓜蒌小剂量组给予瓜蒌注射液2 mL/(kg·d)。丹参组给予丹参注射液为3 mL/(kg·d),模型组及正常对照组给予等容积生理盐水。于末次给药后30 min 实施左冠状动脉结扎手术,对照组实行假手术。手术具体操作参考文献[5]。手术6 h 后,测心电图,腹腔静脉取血,取心脏。以备检测各种指标。
1.4 NO 及eNOS 酶活性等的检测 4 ℃,3 000 r/min 离心15 min 分离血浆。按试剂盒说明书要求分别测定各组大鼠血浆及心肌组织中的ET、NO、6-Keto-PGF1a、TXB2、MDA水平,以及eNOS、SOD 的酶活性。
1.5 数据处理统计学处理采用SPSS 11.0 统计软件包进行统计分析,数据以“均数±标准差”表示,多组均数用F检验,组间两两比较用Q 检验。
2 结果
2.1 内皮素、一氧化氮及一氧化氮合酶活性 如表1 所示,与对照组相比,急性心肌缺血模型大鼠血浆中ET 水平显著升高(P <0.01),NO 水平显著下降(P <0.01);瓜蒌注射液大、小剂量组大鼠血浆中ET、NO 水平异常变化程度较轻,与丹参注射液组相比无明显差异(P <0.05或P <0.01,表1)。进一步检测了各组大鼠血浆eNOS 的活性,发现模型组大鼠血浆eNOS 活性相比对照组显著低下;而瓜蒌注射液大、小剂量组大鼠血液eNOS 活性均明显高于模型组,与丹参注射液组差别不明显(P <0.05,表1)。
表1 各组大鼠血浆ET、NO 及eNOS 水平(±s,n=10)
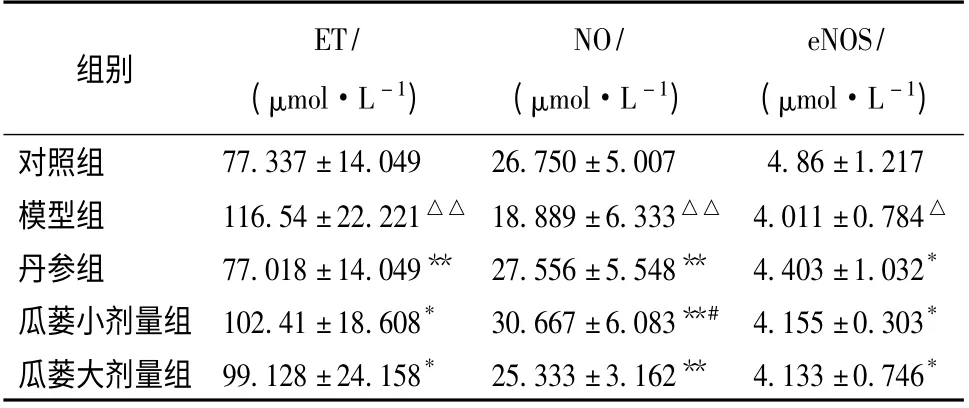
表1 各组大鼠血浆ET、NO 及eNOS 水平(±s,n=10)
注:与对照组比较,△P <0.05,△△P <0.01;与模型组比较,* P <0.05,**P <0. 01;与丹参组比较,#P <0.05
组别ET/(μmol·L -1)NO/(μmol·L -1)eNOS/(μmol·L -1)77.337±14.049 26.750±5.007 4.86±1.217模型组 116.54±22.221△△ 18.889±6.333△△ 4.011±0.784△丹参组 77.018±14.049** 27.556±5.548** 4.403±1.032*瓜蒌小剂量组 102.41±18.608* 30.667±6.083**# 4.155±0.303*瓜蒌大剂量组 99.128±24.158* 25.333±3.162** 4.133±0.746对照组*
2.2 血栓素及6 酮前列环素的水平 检测结果见表2,和对照组相比,模型组大鼠血浆TXB2水平显著升高,而6-Keto-PGF1a 明显下降(P <0.01)。丹参注射液组、瓜蒌注射液大、小剂量组大鼠血浆TXB2、6-Keto-PGF1a 水平均接近正常组,而与模型组差异显著(P <0.01)。其中瓜蒌注射液大剂量对心肌缺血大鼠血液中2 种指标的变化有更显著的影响,对6-Keto-PGF1a 水平的影响效果明显优于丹参注射液(P <0.05,表2)。
表2 各组大鼠血浆TXB2 及6-Keto-PGF1a 水平(±s,n=10)

表2 各组大鼠血浆TXB2 及6-Keto-PGF1a 水平(±s,n=10)
注:与对照组比较,△P <0.05;△△P <0.01;与模型组比较,* P <0.05,**P <0.01;与丹参组比较,# P <0.05
组别 TXB2/ (pg·mL -1)6-Keto-PGF1a/ (pg·mL -1)208.62 ±38.52 374.87 ±83.06模型组 320.83 ±79.5△△ 241.27 ±98.26△△丹参组 224.66 ±30.72** 371.71 ±62.41**瓜蒌小剂量组 228.74 ±42.37** 255.41 ±53.0**瓜蒌大剂量组 249.29 ±47.54** 435.98 ±66.89对照组**
2.3 丙二醛水平及超氧化物歧化酶活性 试剂盒检测结果见表3。与假手术组相比,模型组大鼠心肌组织MDA 水平明显上升,而SOD 活性极大减弱(P <0.01)。丹参注射液组、瓜蒌注射液均可显著逆转MDA、SOD 的这种变化,使之接近正常组(P <0.01)。其中瓜蒌皮注射液的效果优于丹参注射液。该注射液对MDA、SOD 的调节作用与剂量有关,大剂量的作用效果更为显著(P <0.01,表3)。
表3 各组大鼠血浆中MDA 及SOD (±s,n=10)
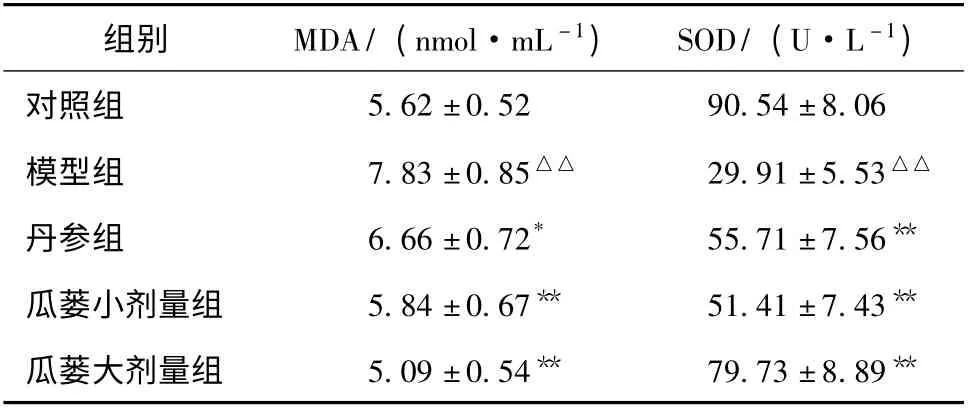
表3 各组大鼠血浆中MDA 及SOD (±s,n=10)
注:与对照组比较,△P <0.05,△△P <0.01;与模型组比较,* P <0.05,**P <0. 01;与丹参组比较,# P <0.05
组别 MDA/ (nmol·mL -1) SOD/ (U·L -1)5.62 ±0.52 90.54 ±8.06模型组 7.83 ±0.85△△ 29.91 ±5.53△△丹参组 6.66 ±0.72* 55.71 ±7.56**瓜蒌小剂量组 5.84 ±0.67** 51.41 ±7.43**瓜蒌大剂量组 5.09 ±0.54** 79.73 ±8.89对照组**
3 讨论
瓜蒌皮及其成药瓜蒌皮注射液是中医最常用的祛痰散结药,和大量其他中药相同,该药也存在使用历史悠久、临床疗效显著,但作用机制不明的问题。本研究结果显示,对急性心肌缺血大鼠,瓜蒌皮注射液可显著提高其血浆eNOS 酶活性、NO 水平、6-Keto-PGF1a 水平,以及心肌组织SOD 活性;显著降低其血浆ET 水平、TXB2水平,及心肌组织MDA 水平。
急性心肌缺血最早期的主要病理环节之一是心肌细胞、血管内皮细胞中eNOS 表达量及酶活性显著降低,NO 的合成减少,而ET 分泌量反而增加[6-8]。体内NO/ET 比值失衡,加剧了血管紧张的程度,降低冠脉流量,进一步促发了炎症反应及心肌坏死[8]。同时缺血缺氧使体内血小板迅速被激活并聚集,释放出大量的腺苷二磷酸、血栓素A(TXA,TXB2的前体)。动物血浆中TXB2显著增加,而6-Keto-PGF1a 水平降低,TXB2/6-Keto-PGF1a 的比值升高,血栓形成的危险性急速增大[9-10]。心肌缺血及其随后的再灌注,导致心肌组织内产生大量的自由基(ROS),氧化应激急剧增加。ROS 可激活核因子NFκB,促进炎症相关蛋白的表达,并可直接破坏细胞膜双分子层及DNA 等大分子的结构,随后造成心肌细胞凋亡、心脏功能丧失[11-14]。本研究通过系列检测证实,瓜蒌皮注射液对急性心肌缺血引起的上述3 种主要病理途径均有干预作用。该药至少通过以下3 种途径发挥对急性心肌缺血的保护作用:①抑制ET的合成、激活eNOS 活性,提高NO 分泌量,增强冠状动脉的扩张,增加冠脉流量;②降低血栓素/前列环素的比值,调节血液凝集状态,抑制血栓形成;③提高心肌组织SOD活性,阻止脂质过氧化,逆转过度氧化应激状态。因此,对缺血心肌的保护作用是多途径、多靶点的。该注射液可能含有多种保护心肌缺血的活性成分,不同成分作用机制不同。
本研究还发现,瓜蒌皮注射液的上述作用效果并不平均,对心肌缺血大鼠体内6-Keto-PGF1a 水平、SOD 活性的影响更为显著。由此推测,瓜蒌皮注射液可能对急性心肌缺血动物体内6-Keto-PGF1a、SOD 水平具有更强的调控作用。拟在今后研究中,对该药的上述作用进行更深层次的探究,为最终探明瓜蒌皮干预冠心病的作用机制奠定基础。
[1] Kloner R A. Natural and unnatural triggers of myocardial infarction[J]. Prog Cardiovasc Dis,2006,48(4):285-300.
[2] Misra M K,Sarwat M,Bhakuni P,et al. Oxidative stress and ischemic myocardial syndromes[J]. Med Sci Monit,2009,15(10):209-219.
[3] 郑文祥. 瓜蒌皮注射液治疗心绞痛的临床观察[J]. 临床误诊误治,2008,21(1):37-38.
[4] 唐 明. 瓜蒌皮注射液对冠心病心绞痛治疗的临床观察[J]. 内蒙古中医药,2011,31(24):4-5.
[5] 赵启韬,孟冰雪,黄臻辉,等. 不同品系栝楼果皮抗心肌梗塞药效学比较研究[J]. 药物评价研究,2013,36(2):95-99.
[6] Stow L R,Jacobs M E,Wingo C S,et al. Endothelin-1 generegulation[J]. FASEB,2011,25(1):16-28.
[7] Paine N J,Bosch J A,Van Zanten J J. Inflammation and vascular responses to acute mental stress:implications for the triggering of myocardial infarction. Curr Pharm Des,2012,18(11):1494-1501.
[8] Oikonomidis D L,Baltogiannis G G,Kolettis T M. Do endothelin receptor antagonists have an antiarrhythmic potential during acute myocardial infarction?Evidence from experimental studies[J]. J Interv Card Electrophysiol. 2010,28 (3):157-165.
[9] Li J,Zhang H,Zhang C. Role of inflammation in the regulation of coronary blood flow in ischemia and reperfusion:mechanisms and therapeutic implications[J]. J Mol Cell Cardiol.2012,52(4):865-872.
[10] Reiss A B,Edelman S D. Recent insights into the role of prostanoids in atherosclerotic vascular disease[J]. Curr Vasc Pharmacol. 2006,4(4):395-408.
[11] Li Z L,Hu J,Li Y L,et al. The effect of hyperoside on the functional recovery of the ischemic/reperfused isolated rat heart:potential involvement of the extracellular signal-regulated kinase 1/2 signaling pathway[J]. Free Radic Biol Med. 2013,57:132-140.
[12] Venardos K M,Perkins A,Headrick J,et al. Myocardial ischemia-reperfusion injury,antioxidant enzyme systems,and selenium:a review[J]. Curr Med Chem,2007,14(14):1539-1549.
[13] Morita K. Surgical reoxygenation injury of the myocardium in cyanotic patients:clinical relevance and therapeutic strategies by normoxic management during cardiopulmonary bypass[J].Gen Thorac Cardiovasc Surg,2012,60(9):549-556.
[14] Yuhki K,Kojima F,Kashiwagi H,et al. Roles of prostanoids in the pathogenesis of cardiovascular diseases:Novel insights from knockout mouse studies[J]. Pharmacol Ther,2011,129(2):195-205.

