乳痛软坚片对大鼠乳腺组织VEGF、MVD 表达研究
刘 慧, 刘丽芳* , 姚 菲
(1. 湖南中医药大学第一附属医院,湖南 长沙410007;2. 广西中医药大学第一附属医院,广西 南宁530023)
乳腺增生病占女性患病率首位,非典型增生认为是乳腺癌的临界性病变[1]。中医药是目前治疗乳腺增生病的最佳治疗手段之一,乳痛软坚片是我院院内制剂,已在临床上使用多年有着稳定确切的疗效,本研究将对其治疗乳腺增生病作用机理进行进一步探讨。
1 材料及方法
1.1 实验资料
1.1.1 实验动物 健康,未孕,SD 雌性大鼠60 只,(200 ±20)g,由湖南中医药大学实验动物中心提供(实验动物质量合格证:SCXK (湘)2009-0012)。
1.1.2 药物 乳痛软坚片:柴胡、陈皮、延胡索、川楝子、白芍、当归、莪术、贝母、海蛤粉、党参、甘草等,由湖南中医药大学第一附属医院制剂室提供(0.3 g/片,湘药制字Z20070274,批号101109);红金消结浓缩丸:金荞麦、五香血藤、大红袍、柴胡、三七、香附、八角莲、鼠妇虫、黑蚂蚁、鸡矢藤等(云南楚雄云中制药有限公司,0.2 g/丸,国药准字Z20080315,批号100604)。
1.1.3 试剂 苯甲酸雌二醇(天津金耀氨基酸有限公司,批号1005061);黄体酮(天津金耀氨基酸有限公司,批号1012091);F ⅧAg 多 克 隆 抗 体 (factor v3related antigen(F8)兔抗:博士德BA0046);VEGF-R1 (兔抗,博士德BA0487);SABC 试剂盒 (小鼠/兔,博士德SA1020);DAB 显色试剂盒(黄)X20 (博士德AR1022);3%双氧水(博士德AR1108);PBS、枸橼酸钠缓冲液均由博士德提供;无水乙醇、二甲苯、苏木素、盐酸、多聚甲醛、生理盐水、中性树脂等均为国产分析纯。
1.1.4 主要仪器 电子天平;生物组织自动脱水机;生物组织包埋中心;石蜡切片机;弹片烤片机;电热恒温水温箱;微波炉(WP800TL23-K3);纤维摄像系统;Motic Images Advanced3.2;图像分析系统;IEISS 三目生物显微镜;游标卡尺;自制大鼠灌胃器等。
1.2 方法
1.2.1 乳腺增生病模型大鼠建立与评价 60 只SD 大鼠随机分为正常对照组(A 组,10 只)、模型制备组(50 只),正常组大鼠大腿外侧肌肉注射生理盐水0.5 mg/kg,每天1 次,连续30 d;模型制备组肌肉注射苯甲酸雌二醇0.5 mg/kg,每天1 次,连续25 d,随后肌肉注射黄体酮4 mg/kg,每天1 次,连续5 d,并夹尾刺激30 min/d,建立肝郁痰凝型乳腺增生病模型。造模后,模型动物出现毛色枯黄,体质量增加慢甚至停滞等现象;肉眼观察,模型动物的乳头高度明显高于正常组;随机取模型制备组10只、正常组2 只取乳腺组织做病理切片,光镜下与正常组比较乳腺小叶数目增多,腺泡明显扩张等增生病理改变出现表明造膜成功。
1.2.2 分组与给药 造膜成功的大鼠进行随机均衡分组,B 组为模型对照组,根据实验设C、D、E 分别为乳痛软坚片低、中、高剂量实验组,F 组为红金消结浓缩丸阳性药物对照组,A 组仍为正常对照组,每组均为8 只。按照陈奇[2]《中药药理实验方法学》体表面积换算,乳痛软坚片中剂量组换算为临床日用量等效剂量,C、D、E 组按1 ∶2 ∶4比例用药,分别为0.32、0.64、1.29 g/kg;F 组0.55 g/kg,药物研末,分别称取各剂量药物,用蒸馏水溶解稀释,置于4 ℃冰箱内储存待用,最终各组均以10 mL/(kg·d)的溶剂灌胃,A、B 组大鼠灌相当量的生理盐水,为期30 d。
1.2.3 病理取材及检测 6 组大鼠造膜30 d、灌胃30 d 后脱颈处死,取第2 对乳腺组织,左乳腺组织经石蜡包埋,切片(4 ~5 μm),HE 染色;右乳经石蜡切片用SABC 法进行免疫组化染色:切片常规脱蜡至水,3%H2O2消除内源性过氧化酶,枸橼酸工作液微波炉中抗原热修复,冷却后BSA 封闭,一抗VEGF-R1 (浓度1 ∶150,FⅧAg 浓度为1 ∶100)4 ℃过夜,二抗、辣根过氧化酶依次孵育,DAB避光显色,苏木素复染,盐酸酒精封色,中性树脂封片,观察。
1.3 指标检测
1.3.1 大鼠行为学指标 观察大鼠是否存在“皮毛欠光、竖毛、脱毛、弓背、怕冷、倦怠、反应迟钝、易激惹、急躁”,分别按“无、轻微、明显”各项均采取等级分别打0、1、2 分[3];最终9 项分数在0 ~5 之间者,终得分计为0 分,在6 ~11 之间者终得分计为1 分,在12 ~18 之间者终得分计为2 分。
1.3.2 乳房直径及乳头高度、直径 于最后一次灌胃后24 h 处死大鼠后用游标卡尺精确测量大鼠第2 对左右两乳房直径、乳头高度和直径,并对其外形进行观察。
1.3.3 乳腺病理观察 取HE 染色切片光镜下观察,利用图像分析软件采集图像并测量乳腺小叶及腺泡,在200 倍下测量乳腺小叶数量;400 倍下测量乳腺小叶的腺泡数量和直径,每张病理片观测3 个视野取其平均值作为统计数据。
1.3.4 血管内皮生长因子 (Vascular Endothelial Growth Factor,VEGF)、微 血 管 密 度 (Micro-Vascular Density,MVD) 免疫组化染色切片用三目生物显微镜观察,Motic Images Advanced 3.2 采集图像,并进行图像分析。微血管密度(MVD)采取血管内皮细胞抗原(FⅧAg)来反映,主要标记于核周,细胞周围也有少量标记,MVD 计数参照Weidner 法[4]:乳腺组织内孤立的棕黄色血管内皮细胞或细胞族代表1 条单独的微血管。先在低倍镜下(100X)浏览全片,找出微血管密度大的“热点”(hot spot),换高倍镜(200X),每张切片记录5 个“热点”,取其平均数作为该病例的MVD;VEGF 染色结果参照《实用肿瘤病理方法学》[5]:细胞浆、胞核内出现棕黄色颗粒为阳性,随机选取5 个高倍镜视野,计每个视野200 个细胞中阳性细胞数,计算阳性细胞百分率,取其平均值: <25% (-),25%~50% (+),50% ~75% (+ +),>75% (+ + +)。
2 结果
2.1 大鼠行为学指标 造模后模型对照组大鼠几乎都出现竖毛、皮毛欠光、脱毛、弓背、倦怠、怕冷、反应迟钝、易激惹、急躁等表现(与正常对照组比较,P <0.01),表明造模后大鼠出现性情改变,病证模型出现;药物干预后经乳痛软坚片中、高剂量组及红金消结浓缩丸阳性药物组症状均得到不同程度的改善(与模型对照组比较,均为P <0.01);且中、高剂量组、阳性药物组均优于低剂量组(与低剂量组比较,均为P <0.01);表明药物干预可以改善大鼠的性情,且跟剂量相关。见表1,数据经单因素方差分析Dunnett’s T3 检验。
表1 大鼠行为学指标[终得分(±s)]
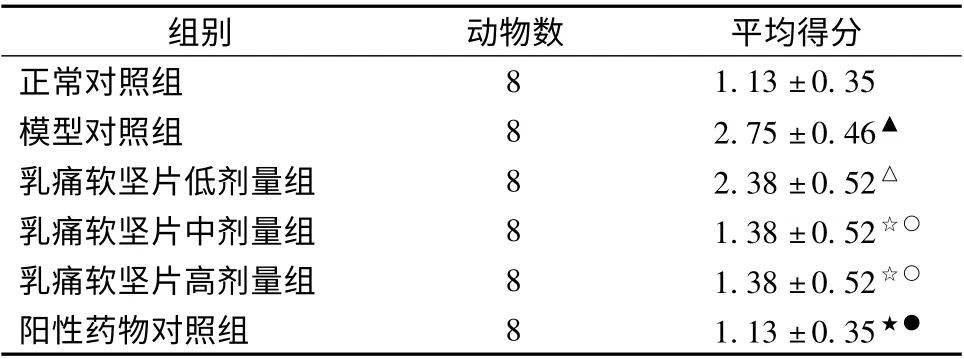
表1 大鼠行为学指标[终得分(±s)]
注:与正常对照组比较,△P <0.05,▲P <0.01;与模型对照组比较,☆P <0.05,★P <0.01;与低剂量组比较,○P <0.05,●P <0.01
组别 动物数 平均得分正常对照组1.13 ±0.35模型对照组 8 2.75 ±0.46▲乳痛软坚片低剂量组 8 2.38 ±0.52△乳痛软坚片中剂量组 8 1.38 ±0.52☆○乳痛软坚片高剂量组 8 1.38 ±0.52☆○阳性药物对照组 8 1.13 ±0.35 8★●
2.2 第2 对乳头高度、直径及乳房直径 造模后肉眼观察大鼠乳房明显可见乳头高耸、变粗,乳头周围毛发裸区范围均明显扩大(P <0.01),颜色鲜红,经药物干预后乳痛软坚片中、高剂量组及阳性药物组得到不同程度的改善(P <0.01)。详见表2,数据经单因素方差分析LSD。
表2 乳头高度、乳头直径、乳房直径(±s)

表2 乳头高度、乳头直径、乳房直径(±s)
注:与正常对照组比较,△P <0.05,▲P <0.01;与模型对照组比较,☆P <0.05,★P <0.01;与低剂量组比较,○P <0.05,●P <0.01;与中剂量组比较,◇P <0.05,◆P <0.01
组别 动物数 乳头高度/mm 乳头直径/mm 乳房直径/cm正常对照组1.14 ±0.11 0.81 ±0.03 0.55 ±0.09模型对照组 8 1.94 ±0.14▲ 0.94 ±0.03▲ 1.37 ±0.10▲乳痛软坚片低剂量组 8 1.83 ±0.13▲ 0.93 ±0.03▲ 1.36 ±0.12▲乳痛软坚片中剂量组 8 1.49 ±0.12▲★● 0.92 ±0.02▲ 1.20 ±0.08▲★●乳痛软坚片高剂量组 8 1.38 ±0.15▲★● 0.88 ±0.02▲★●◆ 0.70 ±0.10▲★●◆阳性药物对照组 8 1.40 ±0.13▲★● 0.85 ±0.02▲★●◆ 0.73 ±0.10 8▲★●◆
2.3 乳腺病理切片 正常乳腺组织导管上皮细胞排列整齐,导管腔腺腔无扩张,小叶及小叶腺胞数相对较少(图1A)。经造模后乳腺组织均可见到典型的增生灶,导管上皮细胞结构紊乱,细胞增生,管腔明显扩张,内可见较多脱落的上皮细胞及分泌物,小叶及腺泡数明显增加(P <0.01),细胞层数增加(P <0.05),间质可见毛细血管扩张增多,纤维结缔组织也可见增生(图1B)。干预后,病理增生得到不同程度改善,乳腺导管上皮排列基本规则,扩张明显减轻,小叶体积及腺泡数明显减少(P <0.01),高剂量组导管上皮细胞增生层数减少(P <0.05) (图1C至1F)。见表3、图1。腺泡数目比较用当因素方差分析LSD 法,细胞增生层数用Dunnett’s T3 法。
表3 乳腺病理镜检(±s)
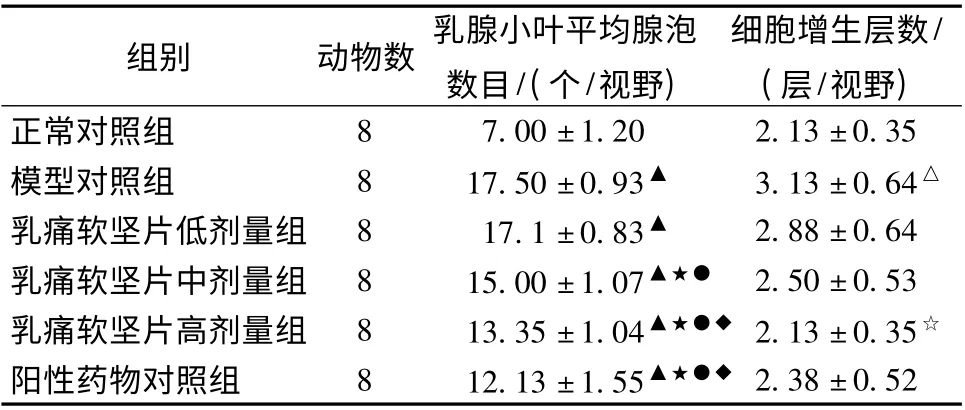
表3 乳腺病理镜检(±s)
注:与正常对照组比较,△P <0.05、▲P <0.01;与模型对照组比较,☆P <0.05,★P <0.01;与低剂量组比较,○P <0.05,●P <0.01;与中剂量组比较,◇P <0.05,◆P <0.01
组别 动物数 乳腺小叶平均腺泡数目/(个/视野)细胞增生层数/(层/视野)8 7.00 ±1.20 2.13 ±0.35模型对照组 8 17.50 ±0.93▲ 3.13 ±0.64△乳痛软坚片低剂量组 8 17.1 ±0.83▲ 2.88 ±0.64乳痛软坚片中剂量组 8 15.00 ±1.07▲★● 2.50 ±0.53乳痛软坚片高剂量组 8 13.35 ±1.04▲★●◆ 2.13 ±0.35☆阳性药物对照组 8 12.13 ±1.55▲★●◆正常对照组2.38 ±0.52

图1 大鼠病理图片(HE,×400)
2.4 血管内皮生长因子( VEGF) 、微血管密度( MVD)正常对照组MVD 数目较少,可见少量被染成棕黄色的血管及单个内皮细胞(图2A),造模后腺泡及其周围可见较多阳性着色(P <0.01)(图2B);经干预后,乳痛软坚片高剂量组及阳性药物组MVD 数目有不同程度下降(P <0.05)(图2E 到图2F)。正常对照组VEGF 阳性细胞数目亦较少,颜色较浅(图3A);造模后腺泡及其周围可见较明显阳性着色(P <0.01)(图3B);经干预后,乳痛软坚片中、高剂量组及阳性药物组VEGF 的阳性表达强度下降(P <0.01) (图3D 到图3F)。见表4、图2、图3。VEGF用等级资料的秩和检验,MVD 用单因素方差分析LSD 法。
3 讨论
血管生成与乳腺增生、非典型增生及癌前病变这一变化过程密切相关。血管形成在肿瘤生长、转移、浸润中起重要作用,并受一系列促进和抑制因子的调节作用,血管内皮生长因子VEGF 是其中最重要的促进因子之一,具有诱导内皮细胞增殖和迁移的功能,特异性促进内皮细胞进行分裂增殖,同时增加血管通透性,使血浆蛋白外漏,基底膜随之降解,最终导致新的基质及血管形成。乳腺癌彩色血流分级随着VEGF 表达水平的升高而明显增多,且乳腺癌者VEGF 蛋白在乳腺的表达与MVD 数值呈正相关[6]。乳腺非典型增生过程中已伴随有新生血管生成,并随非典型增生程度的加重而增多,MVD 可以反映乳腺癌前病变的恶性倾向[7]。随着乳腺增生程度的加重及中医证型从肝郁气滞到痰瘀互结型的转变,VEGF、MVD 表达呈升高趋势[8-9]。临床上药物控制新生血管生成,对于逆转乳腺癌前病变及预防乳腺癌的发生意义重大。检测药物对血管生成的影响能反映药物干预乳腺增生进程的作用及作用机制。
表4 乳腺组织VEGF、MVD 表达(±s)
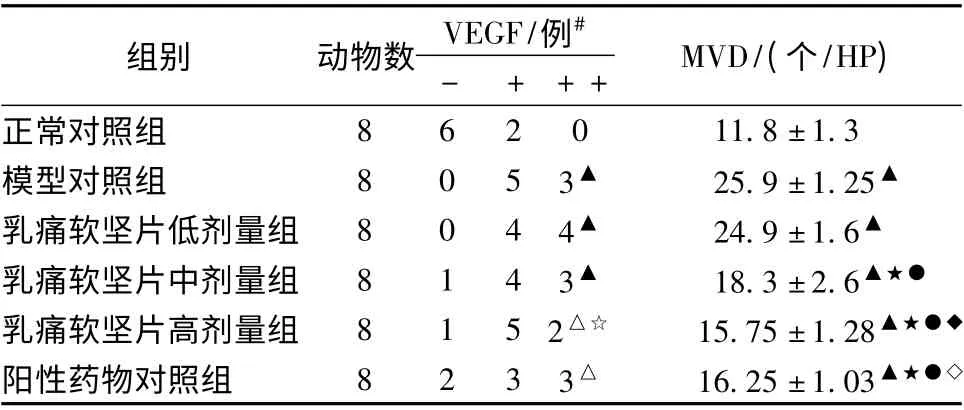
表4 乳腺组织VEGF、MVD 表达(±s)
注:与正常对照组比较,△P <0.05、▲P <0.01;与模型对照组比较,☆P <0.05,★P <0.01;与低剂量组比较,○P <0.05,●P <0.01;与中剂量组比较,◇P <0.05,◆P <0.01。VEGF 总体比较,χ2 =13.92,#P=0.016,P <0.05
组别 动物数 VEGF/例#- + + + MVD/(个/HP)8 6 2 0 11.8 ±1.3模型对照组 8 0 5 3▲ 25.9 ±1.25▲乳痛软坚片低剂量组 8 0 4 4▲ 24.9 ±1.6▲乳痛软坚片中剂量组 8 1 4 3▲ 18.3 ±2.6▲★●乳痛软坚片高剂量组 8 1 5 2△☆ 15.75 ±1.28▲★●◆阳性药物对照组 8 2 3 3△ 16.25 ±1.03正常对照组▲★●◇

图2 大鼠乳腺组织MVD 表达(免疫组化,×400)
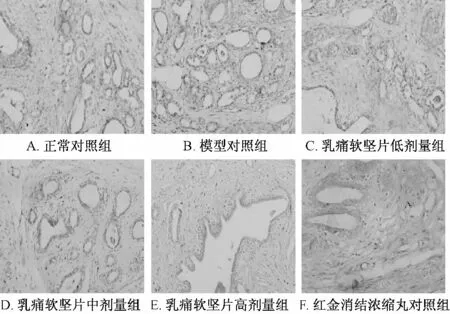
图3 大鼠乳腺组织VEGF 表达(免疫组化,×400)
乳腺增生病属中医“乳癖”范畴,由郁怒伤肝、思虑伤脾、气滞血瘀、痰凝成核,气、血、痰三者夹杂同时致病[10],只是有所偏重之不同,但肝郁气滞、痰凝血瘀是其基本病机。乳痛软坚片是我院专家根据多年的临床经验总结而创制,由柴胡、陈皮、延胡索、川楝子、白芍、当归、莪术、贝母、海蛤粉、党参、甘草等组成。其中柴胡疏肝和胃、行气解郁;陈皮理气调中、开胃化痰之功,是气滞痰凝之必用药;延胡索、川楝子走肝经,可行血中之气滞、气中之血滞,尤以止痛见长;白芍、当归、莪术养血活血,破瘀止痛,莪术还能入血分,活血破瘀兼能调经;贝母、海蛤粉化痰软坚散结,与活血药物配伍,散结力增;考虑本病用药疗程长,恐耗气伤正,故佐党参、甘草辅助药效。诸药合聚,共奏疏肝解郁、化痰散结、活血止痛之功,切中乳癖的病因病机。经过多年的研究观察发现,乳痛软坚片成分稳定[11],临床疗效确切[12]。药理研究也发现乳痛软坚片组方中的柴胡、白芍、莪术等具有抗炎,解除组织水肿,改善血流变及血管通透性,抗血管生成,抗肿瘤等作用[13]。
通过实验研究探讨发现,乳痛软坚片可以明显改善大鼠行为学表现,可降低模型大鼠乳腺组织VEGF 表达,抑制新生血管形成,降低微血管密度(MVD),改善腺体微循环,达到抑制或逆转乳腺增生组织的病理改变,治疗乳腺增生的作用。但均显示出只有在达到一定剂量时才显示出较明显的作用,且在30 d 的短疗程内并未使其改变的病理组织变化恢复到正常,提示中药与西药一样必须达到一定的血药浓度方可显示出疗效,并且可能必须达到一定的持续作用时间方可使改变的病理组织变化得以恢复。但中药逆转其病理组织改变的趋势是值得肯定的。乳腺增生与乳腺癌有显著关联,属中度危险因素,二者都与情志郁结、痰凝血瘀等因素密切相关[14-15],干预这些病因在阻止乳癖向乳岩发展中也有着重要作用。乳痛软坚片集疏肝解郁、化痰散结、活血止痛之功于一体,切中二者的基本病因病机。也可能正是基于此,其能干预血管生成,缩小乳房肿块,在阻止乳腺增生向乳腺癌进展这一进程中也起着重要作用。
[1] 王 琰,崔雨佳,邢 敏. 乳腺增生病与乳腺癌的相关性研究[J]. 医学创新,2010,7(20):191-193.
[2] 陈 奇. 中药药理实验方法[M]. 北京:人民卫生出版社,1994:20.
[3] 马朝群. 补肾疏肝法对乳腺增生大鼠疗效观察[D]. 南京:南京中医药大学,2009.
[4] Weidner N. Intratumor microvessel density as a prognostic factor in cancer [J]. Am J Pathol ,1995 ,147(1):9-19.
[5] 许良中. 实用肿瘤病理方法学[M]. 上海:上海医科大学出版社,1997:150-160.
[6] Garvin S,Dabrosin C. In vivo measurement of tumor estradiol and vascular endothelial growth factor in breast cancer patients[J]. BMC Cancer,2008,8:70-73.
[7] 路艳清,李朝平. 从实验指标变化看乳腺增生病与乳腺癌的关系[J]. 甘肃中医,2008,21(2):38-39.
[8] 宋爱莉,孙贻安,杨 毅,等. 乳腺增生病中医证型与血管生成关系的临床观察[J]. 中国中西医结合杂志,2005,5(5):454-456.
[9] 刘晓菲,宋爱莉. 影像学在建立乳腺增生病辨证量化指标中的应用[J]. 中国中医药信息,2011,18(9):16-18.
[10] 刘 靖,靳小磊,耿 刚. 乳腺增生病发病因素的分析[J]. 内蒙古中医学,2010,29(5):121-123.
[11] 陈维旗. 乳痛软坚片中芍药苷的质量控制[J]. 中国医药学报,2004,19(4):251-252.
[12] 陈其华,刘 慧. 乳痛软坚片治疗乳腺增生病41 例[J].中医杂志,2011,52(23):2048-2049.
[13] 赵国平,戴 慎,陈仁寿. 中药大辞典[M]. 上海:上海科学技术出版社,2008.
[14] 张素赕,李德辉,廖 锐,等. 从情志方面探讨乳腺增生病因病机[J]. 时珍国医国药,2013,24(1):175-176.
[15] 王素燕,李燕芳,吕英杰,等. 健康体检中女性乳腺疾病及相关因素分析[J]. 中国医药导报,2013,10(3):135-137.

