多杀菌素分离纯化工艺的研究
夏燕春 王 超 吴江磊 邹球龙 李 春 张晓琳
多杀菌素分离纯化工艺的研究
夏燕春1,2王 超2吴江磊3邹球龙2李 春1张晓琳2
(石河子大学化学化工学院新疆兵团化工绿色过程重点实验室-省部共建国家重点实验室培育基地1,石河子 832003)
(国家粮食局科学研究院2,北京 100037)
(武汉轻工大学生物与制药工程学院3,武汉 430023)
利用大孔树脂吸附结合硅胶柱层析技术对发酵液中多杀菌素的分离纯化进行了研究。首先考察了提取溶剂、发酵液pH和料液比对浸提多杀菌素的影响;然后对7种不同极性的大孔吸附树脂进行了静态和动态吸附性能的研究,考察了不同吸附、解吸条件对大孔吸附树脂性能的影响,最后对硅胶柱层析法精制多杀菌素的工艺条件进行了探索。结果表明:当发酵液pH为8.0,料液比1∶3(g∶v)时,乙醇可高效浸提多杀菌素;大孔吸附树脂DM11对多杀菌素的静态吸附量和解吸率分别为12 508μg/g(湿树脂)和93.47%;大孔树脂动态吸附最佳pH为9.0,最佳载样比为多杀菌素质量(mg):树脂体积(mL)=2.5∶1;采用70%~95%乙醇梯度洗脱,多杀菌素洗脱率为97.5%;多杀菌素精制时硅胶柱以石油醚/乙酸乙酯/甲醇(2∶1∶0.2和1∶1∶0.25)为洗脱剂进行分段洗脱。该工艺得到的多杀菌素回收率为67.25%,纯度为90.58%。
多杀菌素 大孔吸附树脂 硅胶层析 分离 纯化
多杀菌素(spinosad)是一种新型的绿色广谱大环内酯类生物杀虫剂,其主要活性成份为spinosyn A(约占 85% ~90%)和 spinosyn D(约占 10% ~15%)[1-2]。它是由美国礼来公司筛选得到的放线菌刺糖多孢菌(Saccharopolyspora spinosa)经有氧发酵后产生的胞内次级代谢产物[3-4]。因其独特的杀虫机理,能有效防治多种储粮害虫,用药量极少、持效期长、残留低、无交互抗性,对哺乳动物、鱼类、鸟类和大多数益虫具有极高的安全界限等优点,3次获得美国“总统绿色化学品挑战奖”(Presidential Green Chemistry Challenge Award)[5-7]。1997年第一次注册登记用于多种作物(棉花、果蔬、烟草和中药等),2002年被有机原料评估协会(Organic Materials Review institute)允许用于有机食品生产中,2005年被美国环保局批准用作储粮防护剂,2007年被欧盟批准用于有机物上[8-9]。

图1 多杀菌素A和D的结构式
多杀菌素难溶于水,易溶于甲醇、乙醇、丙酮、乙酸乙酯和乙腈等有机溶剂,因此,常用的提取方法有溶媒萃取法、吸附色谱法和离子交换法[10-12]。溶媒萃取法较其他方法分离速度快,收率高,且产品质量有保证,但是此法需消耗大量有机试剂。如果产生乳化现象,则需要高速离心设备,造成分离纯化过程复杂,并降低了产品收率。此外,有机试剂还会带来严重污染,并且通过萃取方法很难得到高纯度产品。大孔吸附树脂是一类不含交换基团且具有大孔结构的有机高聚物吸附剂[11,13]。采用大孔吸附树脂法提取多杀菌素可节约大量有机溶剂,操作简便安全,树脂可以再生,反复利用可以降低生产成本[14]。
国内关于多杀菌素的制备工艺尚未形成高效、高得率的工业生产技术,因此从成分复杂的发酵液中分离纯化多杀菌素,建立多杀菌素高效、实用的分离纯化技术就显得尤为重要。为此,本研究根据发酵培养基的组成和多杀菌素的浓度,选择合适的溶剂进行提取,然后利用大孔吸附树脂进行分离纯化,最后通过硅胶柱层析进行精制,获得目标纯度的多杀菌素,旨在为多杀菌素的工业化生产提供理论依据和参考。
1 材料与方法
1.1 材料
多杀菌素标准品(98%):Sigma公司;甲醇、乙腈(色谱纯):Merck公司;硅胶(200~300目):青岛海洋化工有限公司;玻璃层析柱(2 cm×23 cm,4 cm×50 cm和10 cm×100 cm):北京瑞泽康生物科技有限公司。
高效液相色谱仪(515Pump,717plusAutosampler,2487Detector):美国 Waters公司;Delta320型 pH计:瑞士MettlerToledo公司;Eppendorf AG22331Hamburg型离心机:德国Eppendorf公司;LABOROTA 4000 efficient旋转蒸发仪:德国Heidolph公司。
1.2 吸附剂
本试验选择大孔吸附树脂包括DM系列树脂:山东鲁抗立科药物化学有限公司;Hp20、SP70、SP825和SP207型号树脂:日本三菱化学公司;XAD-16树脂:美国罗姆-哈斯公司,其理化性质如表1所示。树脂预处理在玻璃层析柱上进行:树脂装柱→乙醇(95%)浸泡过夜→大量水洗净乙醇→3 BV(1倍柱体积记为1 BV)的3~5%盐酸冲洗柱床→去离子水冲洗至pH接近中性→3 BV的4~6%的NaOH冲洗柱床→去离子水冲洗至pH接近中性即可使用。

表1 大孔吸附树脂的物理和化学性质
1.3 多杀菌素浸提液制备
利用课题组前期通过物理化学诱变和分子生物学改造获得的多杀菌素高产刺糖多孢菌(Saccharopolyspora spinosa ASAGF73,由国家粮食局科学研究院保藏)进行发酵罐液体发酵,获得高浓度多杀菌素发酵液(≥2 g/L)。发酵液 4 000 r/min,离心 15 min,收集菌丝体,调节pH,加入3倍体积的乙醇浸提24 h。于4 000 r/min离心 15 min,取上清液,HPLC检测浓度后经真空浓缩至原始体积的1/10,即得多杀菌素提取液,置于4℃冰箱中保存备用。
1.4 大孔吸附树脂的选型
分别称取2.0 g预处理树脂于250 mL具塞磨口三角瓶中,按树脂/提取液1∶60(g/v)的比例加入多杀菌素提取液,置于29℃、160 r/min摇床上振荡吸附6 h。取经吸附后的残液,14 000 r/min离心10 min,上清液通过HPLC检测多杀菌素浓度,计算树脂的吸附量和吸附率,重复3次。

式中:Q为吸附量/μg/g;EA为吸附率/%;W为树脂质量/g;C0为浸提液初始质量浓度/μg/mL;Ce为吸附后残夜浓度/μg/mL;Vi为吸附液体积/mL。
当吸附达到平衡时,将树脂过滤,去离子水洗涤,加入50 mL乙醇于29℃,160 r/min摇床解吸附6 h。HPLC分析残液中多杀菌素的浓度,计算树脂的解吸量和解吸率,重复3次。

式中:Ed解吸率/%;Cd解吸液质量浓度/μg/mL;Vd解吸液体积/mL。
1.5 大孔吸附树脂上样量确定
分别量取12份300 mL经预处理过的多杀菌素发酵提取液,旋蒸后分别上样于相同规格填装有不同体积大孔树脂(2.5~50 mL)的层析柱中,用3 BV水洗,分段收集流出液,每10 mL收集1次,收集10份共100 mL的上样液,依次编号,用HPLC分析洗脱液中多杀菌素的浓度。以大孔树脂体积为横坐标、多杀菌素浓度为纵坐标绘制过载曲线。
1.6 pH对大孔树脂吸附性能的影响
250 mL具塞磨口三角瓶中加入100 mL多杀菌素浸提液,用1 mol/L NaOH或 HCl分别调为不同pH(5~11),每组3个平行,按大孔树脂与提取液1∶60的比例加入2 mL预处理过的树脂,置于29℃、160 r/min摇床上振荡吸附6 h,取上清液,14 000 r/min离心15 min,HPLC分析多杀菌素浓度,计算不同pH条件下对大孔树脂吸附性能的影响。
1.7 动态吸附洗脱试验
将预处理好的树脂湿法装入玻璃层析柱中(2.0 cm×23 cm),先将多杀菌素浓缩液上柱,待树脂吸附多杀菌素后用去离子水洗至流出液无色,再用不同浓度的乙醇梯度洗脱,按一定体积收集洗脱液。通过TLC跟踪检测多杀菌素,考察各种因素对大孔树脂吸附性能的影响,确定大孔树脂最大吸附量及最佳的洗脱剂浓度。
由图2可知,丙酮为提取溶剂时效率较高,多杀菌素浓度为1 247.83μg/mL,相比于甲醇(1 145.71 μg/mL)和乙醇(1 193.37μg/mL)提取率并无显著差异(P>0.05),但丙酮有害性高于甲醇及乙醇。综合考虑提取效率及试剂的安全性,本试验中采用乙醇作为浸提溶剂。
以乙醇为浸提溶剂,考察了不同量的菌丝体与提取溶剂比例对多杀菌素提取效率的影响,结果如下图3所示。
1.8 硅胶层析法精制多杀菌素
硅胶的活化→样品的准备→装柱(采用干法装柱)→加样→洗脱(采用不同比例的石油醚/乙酸乙酯/甲醇(4∶1∶0.1、3∶1∶0.1、2∶1∶0.1、2∶1∶0.2、2∶1∶0、1∶1∶0.25和 1∶2∶0.5)进行梯度洗脱),TLC跟踪检测,根据洗脱液中多杀菌素含量考察各种洗脱液对硅胶精制的影响,确定最佳的洗脱剂比例。
1.9 多杀菌素的HPLC检测
取一定体积的提取液,加入甲醇稀释后,14 000 r/min离心10 min,上清液进行HPLC分析,检测条件为:C18反相柱(ZORBAX Ecllipe XDB-C18,4.6 mm×100 mm,3.5μm);流动相为乙腈∶甲醇∶水(45∶45∶10,含 0.05%乙酸铵;进样量为 10μL;流速为1.0 mL/min;检测波长为244 nm。根据多杀菌素A和D组分的积分面积,参照标准品计算其质量浓度,两组分之和为多杀菌素含量[15]。
1.1 0 数据处理
试验数据均采用Excel 2007和SPSS 13.0软件进行整理统计和分析。文中图形采用Origin 8.0软件绘制。
2 结果与分析
2.1 不同因素对多杀菌素浸提效率的影响
考察不同提取溶剂(甲醇、乙醇、丙酮和乙腈)对多杀菌素提取效率的影响,结果如图2所示。

图2 提取溶剂对多杀菌素提取效率的影响

图3 不同料液比对多杀菌素提取效率的影响
由图3可知,多杀菌素的提取效率随提取料液比的增大而增大,这是由于料液比越高,细胞内外浓度差越大,从而传质推动力大,扩散速度也越大,因此有利于多杀菌素的溶出。当料液比为1∶3时,多杀菌素的提取浓度达到最高为1 322.88μg/mL,此时细胞内外多杀菌素已达到溶解平衡。因此本试验选用提取试剂体积为菌丝体质量3倍作为最佳的提取料液比。
此外,由多杀菌素的理化性质可知,多杀菌素在pH 5~13范围内较稳定[16],因此本试验选择在pH 6.0~11.0范围内测定乙醇对多杀菌素的提取效率,结果见图4。

图4 pH对多杀菌素提取效率的影响
由图4可知,在中性偏碱性环境下,多杀菌素的提取率较好。当发酵液pH为8.0时,多杀菌素的提取率最高。这可能是由于在碱性条件下,部分蛋白被沉淀,使提取试剂与细胞之间接触更充分,传质阻力减小,从而加速了多杀菌素的溶出。因此,确定最佳的提取pH值为8.0。
2.2 大孔吸附树脂分离纯化多杀菌素
2.2.1 大孔吸附树脂的选型
树脂吸附量的大小是吸附分离提取法的关键,因此需根据被分离物的特性、树脂的极性(功能基)及其空间结构(孔径、比表面、孔容)选择树脂进行分离纯化[17]。本试验选取了DM系列树脂、Hp20、XAD16等7种不同极性大孔树脂进行静态吸附和解吸附试验,比较不同大孔树脂对多杀菌素吸附量、解吸量和解吸率的大小,结果如图5所示。
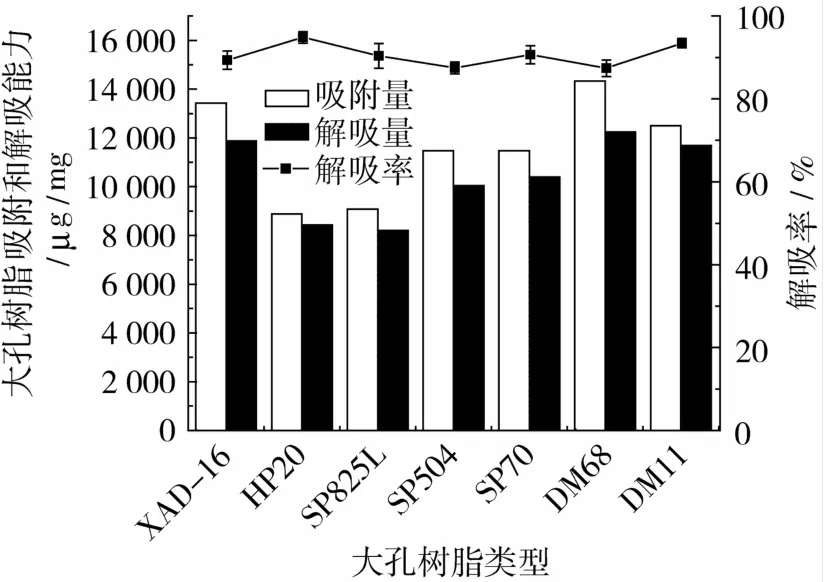
图5 不同树脂吸附性能的比较
从图5可以得出XAD-16、DM68和DM11 3种树脂对多杀菌素的饱和吸附量较大,分别为:13 421、14 332和 12 508μg/g(树脂)。但 XAD-16和DM68的解吸率(分别为89.37%和87.42%)相对于DM11(93.47%)较低。综合考虑大孔树脂的吸附和解吸附性能,选取DM11用于多杀菌素的分离纯化。
2.2.2 pH对大孔吸附性能的影响
pH值是影响大孔树脂吸附能力的一个关键参数,它影响溶质电离的程度,导致溶质和溶液之间亲和力的改变[18]。多杀菌素为弱碱性化合物,根据酸性物质在酸性介质中有利于吸附,碱性物质在碱性介质中有利于吸附的规律,在碱性条件下大孔树脂吸附对多杀菌素的吸附效果更佳。因此,本试验考察了在pH 5.0~11.0范围内大孔树脂对多杀菌素的静态吸附特性,结果如图6所示。

图6 pH对大孔树脂吸附性能的影响
由图6可知,随着pH的升高,大孔树脂对多杀菌素的吸附量显著增高,当pH大于9.0时,吸附量趋于稳定。结果表明,大孔树脂在碱性范围内有利于多杀菌素的吸附。但随着碱性增强,发酵液或提取液中会产生大量的絮状沉淀。因此,确定最佳的大孔树脂吸附pH为9.0。
2.2.3 大孔树脂动态吸附试验
当大孔树脂吸附量达到饱和时对多杀菌素的吸附能力减弱甚至消失,此时多杀菌素开始泄露流出。本研究考察大孔树脂DM11的动态吸附性能,结果如图7所示。

图7 DM11大孔树脂载样量确定
由图7可知,随着大孔树脂体积的增大,树脂的吸附量也不断增加,当大孔树脂体积为40 mL时,对多杀菌菌素的吸附量趋向饱和,为98.67 mg,随后大孔树脂的吸附量不再随树脂体积的增大而增加,即达到吸附平衡。故大孔树脂的最佳载样比为多杀菌素质量(mg)∶树脂体积(mL)=2.5∶1。
2.2.4 乙醇浓度对多杀菌素解吸附性能的影响
将DM11型树脂湿法装柱,待树脂吸附饱和后先用2 BV去离子水洗脱除去水溶性杂质,再以10%~95%乙醇为洗脱剂进行梯度洗脱,按BV收集,合并各收集的组分,HPLC检测洗脱液中多杀菌素浓度,结果如图8所示。
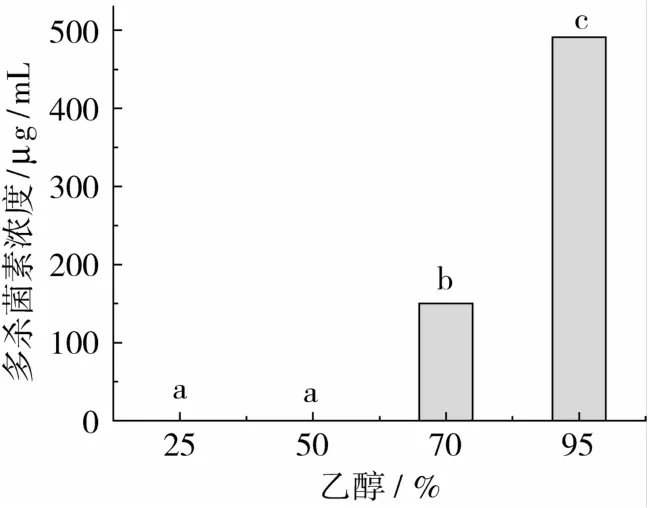
图8 乙醇对多杀菌素解吸性能的影响
由图8可知,乙醇体积分数为10%~50%洗脱液呈深黄色,未检测到多杀菌素。当乙醇体积分数为70%时,多杀菌素被大量洗脱,直至95%乙醇洗脱后几乎检测不到多杀菌素。因此,收集乙醇体积分数为70%~95%范围内的洗脱液进行真空浓缩和冷冻干燥。
3 硅胶柱层析法精制多杀菌素
干法装柱后,先用1 BV的石油醚打通硅胶柱,然后依次用不同比例的石油醚/乙酸乙酯/甲醇进行梯度洗脱。当石油醚/乙酸乙酯/甲醇比例为2∶1∶0.2时,多杀菌素被大量洗脱,洗脱液呈浅黄色,当石油醚/乙酸乙酯/甲醇洗脱至1∶2∶0.5时,TLC结果显示,大量杂质一同被洗脱下来,收集并浓缩石油醚/乙酸乙酯/甲醇2∶1∶0.2至 1∶1∶0.25段洗脱流分,真空浓缩和冷冻干燥流分得到多杀菌素纯品。称取一定量分离纯化后的多杀菌素,经甲醇充分溶解后,HPLC检测其纯度并计算回收率,结果如表2所示。

表2 DM11型树脂与硅胶柱层析分离纯化多杀菌素试验结果
4 讨论
大孔树脂吸附的实质为一种物质高度分散或表面分子受作用力不均等而引起的表面吸附现象,利用分子间的范德华力、氢键作用和大孔树脂的多孔结构对分子大小不同的物质进行筛选分离。本研究根据被分离物质的特性选取了DM系列树脂、Hp20、XAD16等7种不同极性大孔树脂进行静态吸附和解吸附试验,最终确定了DM11弱极性树脂。该树脂既能够从非水介质中吸附极性物质,又能从极性溶液中吸附非极性物质[19]。胡西洲等[20]、王琨等[21]的研究结果也证明了弱极性树脂有利于多杀菌素的吸附。另外本研究发现,非极性树脂DM68对多杀菌素的吸附量最大,但其解吸率较低,分析原因可能是DM68的比表面积较大,因此其吸附量也较高,但其孔径相对较小,与多杀菌素的结合能力较强,不利于多杀菌素的解吸附。而DM11树脂具有适当的比表面积和孔径,其吸附和解吸附率都较为理想。
本研究还发现pH对多杀菌素的提取效率以及大孔树脂的吸附性能均有较大影响。夏立秋等[22]在进行刺糖多孢菌发酵液中多杀菌素分离纯化工艺研究时,为提高多杀菌素的提取效率,将浸提液的pH调为8.5~11.5。秦为辉等[23]研究发现pH为10.0时,多杀菌素提取效果较好。王琨等[21]的研究结果表明,当pH大于9.0时,DM11树脂对多杀菌素的吸附率稳定在90%以上。胡西洲等[20]考察树脂吸附的泄漏率时发现,pH为11.0时大孔树脂对多杀菌素的泄漏率最低。以上研究结果表明,在碱性条件下(pH为9.0~11.0),有利于大孔树脂对多杀菌素的吸附。
本研究通过DM11大孔树脂对多杀菌素发酵液进行分离纯化后,多杀菌素的纯度仅为70%。为了提高多杀菌素的纯度,采用硅胶柱层析进行了进一步的精制研究。硅胶柱层析分离洗脱过程实质上是流动相分子与被分离的溶质竞争占据吸附剂表面活性中心的过程。强极性的组分应选用极性强的流动相洗脱,相反,对弱极性的组分则应选用弱极性的流动相进行洗脱[24]。由于多杀菌素为弱极性化合物,本研究选用了石油醚/乙酸乙酯/甲醇为洗脱液进行梯度洗脱,最终得到了纯度为90%以上的多杀菌素。
5 结论
本文利用大孔树脂吸附结合硅胶柱层析技术对发酵液中多杀菌素的分离纯化工艺进行了研究。结果表明:当发酵液pH为8.0,料液比为1∶3时,乙醇可高效浸提多杀菌素;大孔树脂DM11对多杀菌素的静态吸附量和解吸附率分别为12 508μg/g(湿树脂)和93.47%;大孔树脂动态吸附最佳pH为9.0,最佳载样比为多杀菌素质量(mg)∶树脂体积(mL)=2.5∶1;采用70%~95%乙醇梯度洗脱,多杀菌素洗脱率为97.5%;多杀菌素精制时硅胶柱以石油醚/乙酸乙酯/甲醇(2∶1∶0.2和 1∶1∶0.25)为洗脱剂进行分段洗脱,该工艺得到的多杀菌素纯度为90.58%,回收率为67.25%。
[1]Jin Z H,Xu B,Lin SZ,et al.Enhanced production of spi-nosad in Saccharopolyspora spinosa by genome shuffling[J].Applied Biochemistry and Biotechnology,2009,159(3):655-663
[2]Goran A,Peter K,Marijana PG.Effects of spinosad and abamection on different population of rice weevil sitophilus oryzae(L.)in treated wheat grain[J].Pesticidi i fitomedicina,2011,26(4)377-384
[3]罗莉斯,李能威,张晓琳,等.96孔板高通量筛选多杀菌素高产菌株的研究[J].中国农业科技导报,2010,12(2):133-137
[4]Sharma A,Strivastava A,Ram B,et al.Dissipation behavior of spinosad insecticide in soil,cabbage and cauliflower under sub-tropical conditions[J].Electronic Journal of Environmental Agricultural and Food Chemistry,2008,7(12):2611-2617
[5]陈园,熊犍,郭伟群,等.多杀菌素产生菌的高通量诱变选育[J].中国抗生素杂志,2013,38(5):339-347
[6]李丽,罗莉斯,王艳萍,等.刺糖多孢菌生长特性及培养条件的优化[J].中国粮油学报,2010,25(11):89-93
[7]李能威.多杀菌素生产菌的诱变及其发酵工艺优化[D].广州:华南理工大学,2009
[8]Hruskova M,Machova D.Changes of wheat flour properties during short term storage[J].Czech Journal of Food Science,2002,20(4):125-130
[9]Holt K M,Opit G P,Nechols J R,et al.Testing for nontarget effects of spinosad on two spotted spider mites and their predator Phytoseiulus persimilis under greenhouse conditions[J].Experimental and Applied Acarology,2006,38(2-3):141-149
[10]虞龙,余增亮.离子束生物工程及应用研究[J].中国兽药杂志,2001,35(1):55-59
[11]Baker PJ.PCT Int.Application[P].WO9106552,1991
[12]Boeck L V.Process for producing A83543 compounds:USA,5362634[P].1994-11-08
[13]罗艳玲,欧仕益.大孔树脂在食品性成分分离中的应用[J].食品与机械,2005,21(5):81-83
[14]周剑,丁玉峰.大孔吸附树脂分离中草药有效成分的应用[J].中国医院药学杂志,2006,26(1):69-71
[15]熊犍,李能威,张晓琳,等.多杀菌素的高效液相色谱测定[J].现代食品科技,2009,25(6):704-706
[16]秦为辉.多杀菌素的提取纯化工艺研究[D].武汉,武汉工业学院,2010
[17]Liu JH,Sun Y,Luo D Y,et a1.The influence of Lithospermum Ruderale on medical abortion with miferpristone and misoprostol[J].Journal of Reproductive Medicine,2000,9(3):155-158
[18]Li H,Chen B,Nie L,Yao S,et a1.Solvent effects on focused microwave assisted extraction of polyphenolic acids from eucommia ulmodies[J].Phytochemical Analysis,2004,15(1):306-312
[19]顾觉奋.八十年代大孔吸附树脂吸附剂在抗生素分离纯化中的应用新进展(上)[J].离子交换与吸附,1992,8(1):77-80
[20]胡西洲,贺玉平,戴经元,等.大孔吸附树脂提取多杀菌素的方法[J].华中农业大学报,2006,25(4):397-399
[21]王琨,金志华,林建平,等.大孔吸附树脂分离提取多杀菌素[J].离子交换与吸附,2005,21(5):444-451
[22]夏立秋,丁学知,余子全,等.一种从刺糖多孢菌发酵液中分 离多杀菌的工艺:中国,10190624[P].2010-12-08
[23]秦为辉,陈新,张晓琳,等.多杀菌素的提取和萃取条件研究[J].西北农林科技大学学报,2010,38(4):151-156
[24]姜瑞清,周琳,黎继烈,等.硅胶柱层析纯化花生根中白藜芦醇工艺研究[J].食品科技,2010,35(1):199-202.
Extraction and Purification of Spinosad
Xia Yanchun1Wang Chao2Wu Jianglei3Zou Qiulong2Li Chun1Zhang Xiaolin2
(School of Chemistry and Chemical Engineering Key Laboratory for Green Process of Chemical Engineering of Xinjiang Bingtuan Shihezi University1,Shihezi 832003)
(Academy of State Administration of Grain2,Beijing 100037)
(School of Biology and Pharmaceutical Engineering3Wuhan Polytechnic University,Wuhan 430023)
Extraction and purification of spinosad from fermentation broth has been studied by macroporous resin adsorption supported with silica gel chromatography technology.First,the influences of the type of extraction solvents,extraction solvents volume and pH in spinosad extraction process were investigated.Second,the static and dynamic adsorption expressions of seven varieties of macroporous resins for spinosad extraction were studied and the op-timum macroporous resin was selected in present process.Finally,the silica gel chromatography technology was explored for spinosad purification.The results showed that ethanol had ability to extract the spinosad efficiently on the condition of the pH of fermentation broth 8.0,the ratio of material and solvent was 1∶3(g/v).DM11 was selected as the optimum macroporous resin to extract and separate spinosad on the experimental condition;the adsorption and desorption ratio of DM11 macroporous resin for spinosad was 12 508μg/g(wet resin)and 93.47%respectively.The maximum adsorption capacity of DM11 macroporous resin for spinosad could be reached at pH 9.0.The optimal ratio of spinosad and macroporous resin for adsorption was 2.5∶1(mg∶mL).When 70% ~95%ethanol was utilized as eluant,the desorption capacity reached 97.5%.The silica gel column chromatography was adopted for further purification of spinosad by gradient elution using a mixture of petroleum ether:ethyl acetate:methanol(2∶1∶0.2 and 1∶1∶0.25),and the highest purity of 90.58%was obtained under these conditions.
spinosad,macroporous resin,silica gel column,separation,purification
S482.3+9
A
1003-0174(2014)03-0095-07
时间:2014-03-13 16:56
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20140313.1656.010.html
“十二五”国家科技支撑计划(2011BAD03B02-2),2013年“农业科技成果转化资金项目”(2013GB 24490638)
2013-08-24
夏燕春,女,1987年出生,硕士,生物化工通讯作者:李春,男,1970年出生,教授,生物化工
张晓琳,女,1975年出生,研究员,微生物学

