RNA干扰沉默信息调节因子2同源蛋白1阻滞前列腺癌PC3细胞周期
李 驰 王忠利
前列腺癌是男性常见的恶性肿瘤之一,多发生于老年男性。临床技术手段的不断进步使原位癌及大部分转移癌的切除已不存在技术问题,但术后癌的复发、转移以及化疗耐药是导致前列腺癌患者死亡的主要原因[1-2]。目前缺乏治疗晚期前列腺癌的有效手段,对前列腺癌发生发展的分子机制知之甚少,因此寻找抑制前列腺癌细胞生长和转移的重要分子靶点显得尤为重要。RNA干扰(RNA interference,RNAi)是生物普遍存在的在RNA水平上调节基因表达的方式,是一种特异性失活功能基因的方法,已成为研究基因功能的重要工具[3-4]。该方法选择性高,但不改变其他正常基因的功能。本研究通过在前列腺癌PC3细胞株中特异性干涉沉默信息调节因子2同源蛋白1(silent mating type information regulation 2 homolog 1,SIRT1),探讨下调SIRT1的表达对人前列腺癌PC3细胞系的细胞周期影响,分析前列腺癌发生发展的可能机制,为SIRT1作为治疗前列腺癌的一个潜在靶点提供实验依据。
1 材料与方法
1.1 主要试剂与仪器
SIRT1 siRNA和scramble siRNA(上海吉玛公司);Lipofectamine 2000(美国Invitrogen公司);RPMI 1640/F12培养液(美国Corning公司);M-MLV逆转录酶(美国Promega公司);SIRT1抗体(美国Merck Millipore公司);PRb抗体、P21、P27和β-actin抗体(美国Santacruz公司);HRP标记的山羊抗兔、抗鼠IgG(北京中杉金桥生物技术有限公司);MTT、Western细胞裂解液、BCA蛋白浓度测定试剂盒(北京碧云天生物技术公司);ECL化学发光试剂盒(美国Piece Biotechnology公司)。BB16UV CO2培养箱(德国Heraeus公司);PCR扩增仪(美国Eppendorf公司);Sunrise自动酶标检测仪(美国Tecan公司);流式细胞仪(美国BD Biosciences公司);凝胶自动成像仪GDS8000、水浴式电转印槽、电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养 人前列腺癌PC3细胞系购自上海生命科学院细胞和生物化学研究所,培养基为含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640/F12培养基,在饱和湿度、37℃和5%CO2孵箱中培养,0.25%胰蛋白酶消化传代。当细胞处于对数生长期时,以1×105/mL浓度接种于培养瓶或培养板中。
1.2.2 SIRT1 siRNA的合成和转染 针对人SIRT1的cDNA序列(GenBank No.NM_012238)寻找候选RNAi靶点序列,通过Blast同源性比对分析其基因特异性。SIRT1 siRNA序列正义链为5'-GAAGUUGACCUCCUCAUUGUdTdT-3',反义链为 5'-ACAAUGAGGAGGUCAACUUCdTdT-3'[5],由上海吉玛公司纯化合成。PC3细胞接种6孔细胞培养板中,细胞转染按照Lipofectamine 2000说明书进行。实验分空白对照(Mock)组、发夹siRNA对照(scramble siRNA)组和SIRT1 siRNA 转 染 组 。20 μ M scramble siRNA 或SIRT1 siRNA转染48 h后收集细胞进行后续实验。
1.2.3 RT-PCR方法检测SIRT1 mRNA表达水平 采用Trizol一步法提纯各组PC3细胞中总RNA,并测定RNA浓度,当A260/A280比值为1.9~2.0可用于逆转录反应。使用M-MLV逆转录酶进行逆转录和PCR。逆转录条件为42℃30 min,99℃ 5 min,5℃ 5 min。SIRT1引物序列上游为5'-GACTCCAAGGCCACGGATAG-3';下游为5'-GGAAGTCTACAGCAAGGCGA-3',预期片段长度为335 bp。GAPDH引物序列上游为5'-CGGAGTCAACG GATTTGGTCGTAT-3';下游为 5'-AGCCTTCTCCATG GTGGTGAAGAC-3',长度为306 bp。反应条件为94℃预变性3 min;94℃变性30 s、55℃ 退火30 s、72℃ 延伸1 min,共35个循环;72℃终延伸7 min。取PCR产物10 μL进行琼脂糖凝胶电泳并拍照。
1.2.4 MTT方法检测PC3细胞生长抑制率 取对数生长期PC3细胞,调整细胞数接种于96孔板培养板上,每组6个平行复孔。37℃培养箱中培养24 h后,细胞融合率达80%~90%进行转染。24 h或48 h后,取出96孔板,在每孔中加入新鲜配制的20 μL MTT溶液(5 mg/mL),继续培养4 h;弃去培养液,加入150 μL/孔二甲基亚砜(DMSO),振荡15 min,充分溶解紫色结晶。酶标仪测定490 nm吸光度值(A值),并计算细胞生长抑制率。
1.2.5 流式细胞术检测细胞周期 SIRT1 siRNA或scramble siRNA转染PC3细胞,在无血清培养液中培养24 h使细胞周期同步化。同步化的上述细胞种植于细胞培养皿中,加入含10%胎牛血清的培养液继续培养48 h,胰酶-EDTA消化离心细胞,PBS洗涤细胞。在收集的细胞中加入100 μg/mL RNase A,室温放置30 min。避光条件下加入10 μg/mL碘化丙啶(propidium iodide,PI)染液重悬细胞至单细胞悬液,室温放置30 min后流式细胞术分析各组细胞的DNA含量,计算细胞周期。
1.2.7 Western blot方法检测SIRT1、P21、P27和Rb蛋白表达 取出各组细胞,蛋白裂解液提取细胞总蛋白,BCA法测定蛋白浓度,加入5×SDS样品缓冲液,100℃煮沸5 min,离心后检测。10%SDS-PAGE电泳分离,将蛋白转至硝酸纤维素膜上,使用含5%脱脂奶粉的TBS(pH为7.4)封闭滤膜2 h。再分别与SIRT1、PRb抗体(稀释比为1:1 000),P21、P27抗体(稀释比为1:200)及β-actin抗体(稀释比为1:1 000)4℃温育过夜。TTBS洗涤3次后,HRP偶联的IgG(稀释比为1:5 000)室温温育2 h,洗膜3次,每次10 min,ECL发光法显色。
1.3 统计学分析
应用SPSS 13.0软件进行数据统计与分析。各组数据以均数±标准差(±s)表示,多样本均数检验采用方差分析的方法。P<0.01为显著性差异。
2 结果
2.1 SIRT1 siRNA转染PC3细胞效率的验证
与Mock组和scramble siRNA组比较,SIRT1 siRNA转染组明显抑制PC3细胞内源性SIRT1 mRNA水平和蛋白表达(图1)。
2.2 下调SIRT1表达对PC3细胞体外增殖的影响
与Mock组和scramble siRNA组比较,SIRT1 siRNA转染组能够显著抑制PC3细胞的生长增殖,比较差异具有统计学意义(P<0.01,图2)。

图1 PC3细胞转染SIRT1 siRNA后SIRT1 mRNA和蛋白表达水平Figure 1 Expression levels of SIRT1 mRNA and protein in SIRT1 siRNA-transfected PC3 cells
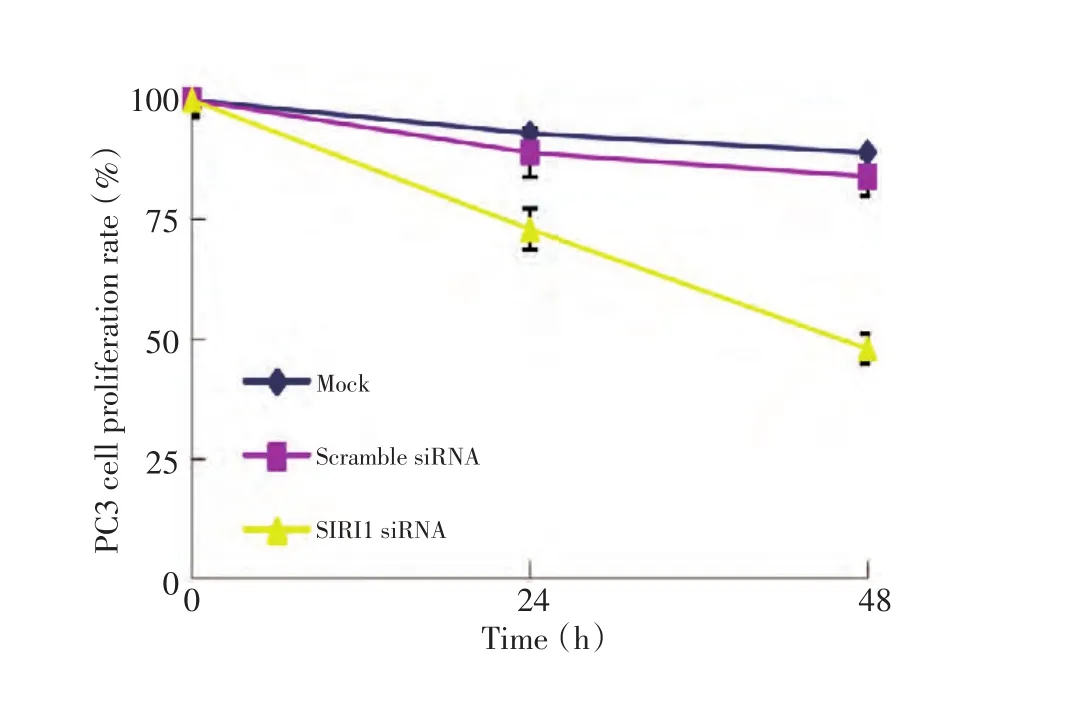
图2 MTT方法检测转染SIRT1 siRNA后的PC3细胞增殖Figure 2 PC3 cell proliferation rate as evaluated using methyl thiazolyl tetrazolium assays
2.3 干扰SIRT1表达对PC3细胞周期的影响
与Mock组[(45.49±1.89)%]和scramble siRNA组[(48.00±2.76)%]比较,SIRT1 siRNA转染组PC3细胞周期中G1期细胞所占比例增加[(63.73±2.86)%](P<0.01);与Mock组[(27.60±1.13)%]和scramble siRNA组[(28.46±2.05)%]比较,SIRT1 siRNA转染组S期细胞所占比例减少[(13.77±2.09)%](P<0.01)。
2.4 干扰SIRT1表达对P21、P27细胞周期蛋白和Rb蛋白表达水平的影响
与Mock组和scramble siRNA组比较,SIRT1 siRNA转染组降低P21和P27蛋白表达升高,Rb蛋白磷酸化表达降低(图3)。

图3 PC3细胞转染SIRT1 siRNA后P21、P27和Rb蛋白表达Figure 3 Western blot analysis of P21,P27,and phosphorylated Rb protein expression levels in SIRT1 siRNA-transfected PC3 cells
3 讨论
SIRT1属于sirtuin家族,为烟酰胺腺嘌呤二核苷酸(NAD+)依赖性的组蛋白去乙酰化酶,是III类去乙酰化酶中的重要一员[6]。通过去乙酰化众多组蛋白和非组蛋白,参与调控细胞的能量代谢、凋亡、能量摄入限制、DNA修复,影响细胞存活、衰老和神经退行性病变等多种病理生理过程[7-8]。SIRT1具有众多生物学作用,其究竟是发挥促癌作用还是抑癌作用及能否作为未来肿瘤治疗的潜在新靶点都引起很多关注[9]。SIRT1在不同肿瘤组织中的来源和类型不同,其所发挥的作用也不同。SIRT1通过抑制P53、Bax-Ku70和FOXO转录因子而发挥促癌作用[10],SIRT1通过NF-κB/Cyclin D1信号通路抑制胃癌的发生发展[11]。既往有关SIRT1与前列腺癌关系的报道不一致[12-13],为探索SIRT1在前列腺癌发生中的作用,本研究使用RNA干扰下调SIRT1表达,观察SIRT1对前列腺癌PC3细胞增殖和细胞周期的影响。
本研究首先应用Lipofectamine 2000转染针对人SIRT1序列特异的siRNA,用RT-PCR和Western blot方法验证了SIRT1 siRNA显著降低内源性SIRT1mRNA水平和蛋白表达,说明siRNA作用的特异性。MTT测定结果表明干扰SIRT1表达后,PC3细胞出现明显的生长抑制状态。细胞周期是反映细胞增殖速度的一个重要指标,为了研究内源性SIRT1对细胞周期的影响,本研究使用SIRT1 siRNA转染PC3细胞48 h后采用流式细胞术分析细胞周期。结果表明,与对照组比较,SIRT1 siRNA处理后G1期细胞比例增加,细胞周期阻滞在G1期。P21、P27和P16等细胞周期蛋白依赖性激酶抑制剂(cyclin-dependent kinase inhibitor,CDKI)可特异性抑制细胞周期蛋白(CYCLIN)与CDK形成的复合物的活性,使磷酸化状态的Rb蛋白脱磷酸,并且结合E2F1阻止细胞通过G1/S调控点,导致细胞周期阻滞[14-15]。为了探讨SIRT1可能阻滞G1期的分子机制,本研究检测了细胞周期关键调控分子P21、P27的蛋白表达和Rb蛋白的磷酸化状态。PC3细胞中SIRT1被干扰后细胞周期抑制性蛋白P21和P27表达增加,而磷酸化的Rb蛋白表达降低。以上结果表明下调SIRT1表达后,通过上调PC3细胞中P21和P27蛋白表达,使磷酸化的Rb蛋白脱磷酸进而阻滞细胞于G1期。
总之,本实验表明特异性干扰SIRT1表达能够抑制前列腺癌PC3细胞的增殖和阻滞PC3细胞周期,其机制可能与上调PC3细胞中P21和P27蛋白表达,并抑制Rb蛋白的磷酸化相关。本研究结果提示,SIRT1在前列腺癌的发生发展中起重要作用,有望成为前列腺癌潜在治疗的分子靶点。
1 Chen J,Li HM,Zhang XN,et al.Dioscin-induced apoptosis of human LNCaP prostate carcinoma cells through activation of caspase-3 and modulation of Bcl-2 protein family[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(1):125-130.
2 Khan MI,Adhami VM,Lall RK,et al.YB-1 expression promotes epithelial-to-mesenchymal transition in prostate cancer that is inhibited by a small molecule fisetin[J].Oncotarget,2014,5(9):2462-2474.
3 Li JP,Cao NX,Jiang RT,et al.Knockdown of GCF2/LRRFIP1 by RNAi causes cell growth inhibition and increased apoptosis in human hepatoma HepG2 cells[J].Asian Pac J Cancer Prev,2014,15(6):2753-2758.
4 Civenni G,Malek A,Albino D,et al.RNAi-mediated silencing of Myc transcription inhibits stem-like cell maintenance and tumorigenicity in prostate cancer[J].Cancer Res,2013,73(22):6816-6827.
5 Abdelmohsen K,Pullmann R Jr,Lal A,et al.Phosphorylation of HuR by Chk2 regulates SIRT1 expression[J].Mol Cell,2007,25(4):543-557.
6 Byles V,Zhu L,Lovaas JD,et al.SIRT1 induces EMT by cooperating with EMT transcription factors and enhances prostate cancer cell migration and metastasis[J].Oncogene,2012,31(43):4619-4629.
7 Yuan H,Su L,Chen WY.The emerging and diverse roles of sirtuins in cancer:a clinical perspective[J].Onco Targets Ther,2013,6:1399-1416.
8 Li Y,Wong K,Giles A,et al.Hepatic SIRT1 attenuates hepatic steatosis and controls energy balance in mice by inducing fibroblast growth factor 21[J].Gastroenterology,2014,146(2):539-549.
9 Wang RH,Sengupta K,Li C,et al.Impaired DNA damage response,genome instability,and tumorigenesis in SIRT1 mutant mice[J].Cancer Cell,2008,14(4):312-323.
10 Hori YS,Kuno A,Hosoda R,et al.Regulation of FOXOs and p53 by SIRT1 modulators under oxidative stress[J].PLoS One,2013,8(9):e73875.
11 Yang Q,Wang B,Gao W,et al.SIRT1 is downregulated in gastric cancer and leads to G1-phase arrest via NF-κB/Cyclin D1 signaling[J].Mol Cancer Res,2013,11(12):1497-1507.
12 Kojima K,Ohhashi R,Fujita Y,et al.A role for SIRT1 in cell growth and chemoresistance in prostate cancer PC3 and DU145 cells[J].Biochem Biophys Res Commun,2008,373(3):423-428.
13 Baptista T,Graça I,Sousa EJ,et al.Regulation of histone H2A.Z expression is mediated by sirtuin 1 in prostate cancer[J].Oncotarget,2013,4(10):1673-1685.
14 Zhang XM,Liu C,Zhao S,et al.Mechanism of 9-cisRA in inhibiting the proliferation of thyroid squamous cell carcinoma cell SW579[J].Chin J Clin Oncol,2012,39(11):761-764.[张秀梅,刘 超,赵颂,等.9-顺式维甲酸抑制甲状腺鳞癌细胞SW579增殖的作用机制[J].中国肿瘤临床,2012,39(11):761-764.]
15 Burke JR,Liban TJ,Restrepo T,et al.Multiple mechanisms for E2F binding inhibition by phosphorylation of the retinoblastoma protein C-terminal domain[J].J Mol Biol,2014,426(1):245-255.
