miR-26a通过调节MTDH基因表达抑制CAOV3细胞系生长
王淑芬,董巍蕾,谢 晶,何 璐,周 曦,蔡艳林,刘 杰,谢宛玉(南华大学附属第一医院妇产科,湖南 衡阳 421001)
microRNAs(miRNAs)是一类非编码的内源性小RNA分子,通过与靶基因非编码区特异性碱基配对从而调控靶基因的表达。miRNAs靶向调控大量的mRNAs,通过与基靶基因的3′非编码区相互结合,从而诱导mRNA降解或者抑制蛋白的翻译[1-2]。研究表明,miR-26a存在于两个染色体位点,miR-26a-1位于3号染色体,miR-26a-2位于12号染色体。目前有关miR-26a在肿瘤中的作用的研究报道很少。研究表明miR-26a在肝癌中下调,其表达水平与肝癌患者生存时间及对干扰素治疗的敏感性相关[3]。miR-26a在鼻咽癌中表达下调且能通过靶基因组蛋白甲基化转移酶(enhancer of zeste homolog 2,EZH2)抑制鼻咽癌细胞生长和致瘤性[4]。同时miR-26a在乳腺癌组织和细胞中显著下调,miR-26a模拟物能明显抑制乳腺癌细胞增殖生长。通过凋亡试剂盒检测发现,过表达miR-26a能诱导乳腺癌细胞凋亡[5]。miR-26a在肝癌、鼻咽癌、胃癌以及乳腺癌组织和细胞中表达下调,且抑制肿瘤细胞的生长增殖[3-5]。MTDH,又名AEG-1,在多种肿瘤如食管鳞癌、胃癌、肾细胞癌、前列腺以及非小细胞肺癌中表达上调[6-10]。Li C等[11]研究显示,MTDH在晚期黏液性卵巢癌中高表达,并且与患者的预后差和对顺铂耐药相关。目前对于miR-26a与MTDH在卵巢癌中的研究尚未见报道。本研究拟采用qRT-PCR、Western blot以及MTT法检测miR-26a在卵巢癌中的生物学作用及作用机制。
1 材料与方法
1.1 病例资料
收集2008年1月~2013年7月期间,本院收治确诊卵巢癌患者52例。所有患者术前未经任何化疗药物治疗,中位年龄53(39~70)岁。病理诊断结果均经两名以上病理科医生确认,癌旁组织取自距癌组织5 cm以外。本次研究获得南华大学附一医院伦理组织批准以及研究对象的知情同意。
1.2 细胞株
CAOV3为卵巢癌细胞株,由中山大学肿瘤防治中心惠赠。
1.3 主要材料
miR-26a mimics及对照mimics购自Ambion公司。MTDH siRNA质粒购自santa cruz公司。MTDH抗体和β-actin抗体购自santa cruz公司。Trizol和Lipofectamine 2000转染试剂购自美国Invitrogen公司。PRIM1640培养基和胎牛血清为Gibco公司产品。MTS细胞生长增殖/毒性检测试剂盒购自美国Sigma公司。
1.4 qRT-PCR
取适量组织,用RNA提取试剂盒提取总RNA,逆转录合成cDNA。PCR扩增反应为20 μL体系,包括:Taq DNA polymerase(5 U/μL)0.2 μL,2×SYBR Mix 10 μL,miRNA RT product 2.0 μL,MiR-PCR primers(5 μmol/L)0.4 μL,灭菌蒸馏水7.4 μL。循环体系为:95 °C ×3 min,95 °C ×12 s,62 °C ×35 s,72 °C ×30 s,共35 个循环。以U6 snRNA为内参,所测定的miR-26a的相对表达量采用2-ΔΔCT法分析。检测MTDH mRNA 方法同上,其引物序列正向:5′-TGGCAAATGTGGCCAACA-3′,反向: 5′-TATTAGGTAACCGACCCCCTCTT-3′,以β-actin为内参,所测定的MTDH mRNA的相对表达量采用2-ΔΔCT法分析。
1.5 Western blot
将miR-26a mimics 或MTDH siRNA质粒转染CAOV3细胞,48 h后提取细胞总蛋白,BCA法测定蛋白浓度。各组取等量样本,进行SDS-PAGE凝胶电泳,然后将蛋白转移至PVDF膜上,5%BSA封闭,加入MTDH或GAPDH抗体,4 ℃过夜。TBST洗膜30 min,加入二抗室温孵育1 h,TBST洗膜30 min,加入ECL发光剂,X片曝光、显影、定影。
1.6 MTT法检测细胞增殖活性
取转染后的CAOV3细胞,消化后接种细胞于96孔板中,每空5 000个细胞,每组设6个复孔,放37 ℃、5% CO2培养箱中培养。在未接种细胞的孔中加入RPMI-1640培养基中作为调零孔。接种72 h后,每孔加20 μL MTS检测试剂,37 ℃孵育2 h,用酶标仪测定492 nm波长吸光度值(OD492)。实验重复3次。
1.7 统计学处理
2 结 果
2.1 卵巢癌及其相应癌旁组织中miR-26a表达水平分析
qRT-PCR结果显示,miR-26a在52例卵巢癌癌旁组织、癌组织中的表达分别为1.05±0.18、0.69±0.16,两者相比,差异有显著性(P<0.01,图1A);MTDH在52例卵巢癌癌旁组织、癌组织中的表达分别为1.11±0.21、3.49±0.54,两者相比,差异具有显著性(P<0.01,图1B)。
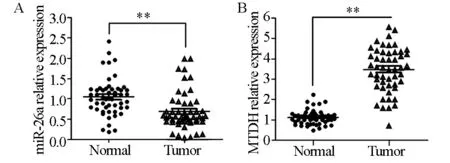
图1 miR-26a与MTDH在卵巢癌组织和癌旁组织中表达水平的分析
2.2 miR-26a对卵巢癌CAOV3细胞中MTDH蛋白表达的影响
研究已表明MTDH是miR-26a的靶基因[12],为了明确miR-26a对MTDH的蛋白质表达的调控作用,将miR-26a mimics转染卵巢癌CAOV3细胞,以转染miR-26a-control为阴性对照,转染MTDH siRNA为阳性对照,转染48 h后收集蛋白。Western blot检测结果显示,转染miR-26a组和MTDH siRNA组MTDH蛋白表达水平较阴性对照组明显降低(图2)。即miR-26a能下调卵巢癌CAOV3细胞系中MTDH蛋白质的表达。

图2 Western blot检测miR-26a对MTDH蛋白的影响
2.3 miR-26a对卵巢癌细胞增殖能力的影响
分别将miR-26a-mimics,miR-26a-control(阴性对照组)和MTDH siRNA以及siRNA-control(阴性对照组)转入CAOV3细胞24、48、72 h后,通过MTT法检测其对细胞增殖活性的影响。结果显示,转染MTDH siRNA和miR-26a mimics组CAOV3细胞从48 h起增殖速度明显减慢,与miR-26a control对照组细胞相比,差异均有显著性(P<0.05,图3),高表达miR-26a通过下调MTDH的表达,从而抑制卵巢癌CAOV3细胞的生长增殖。
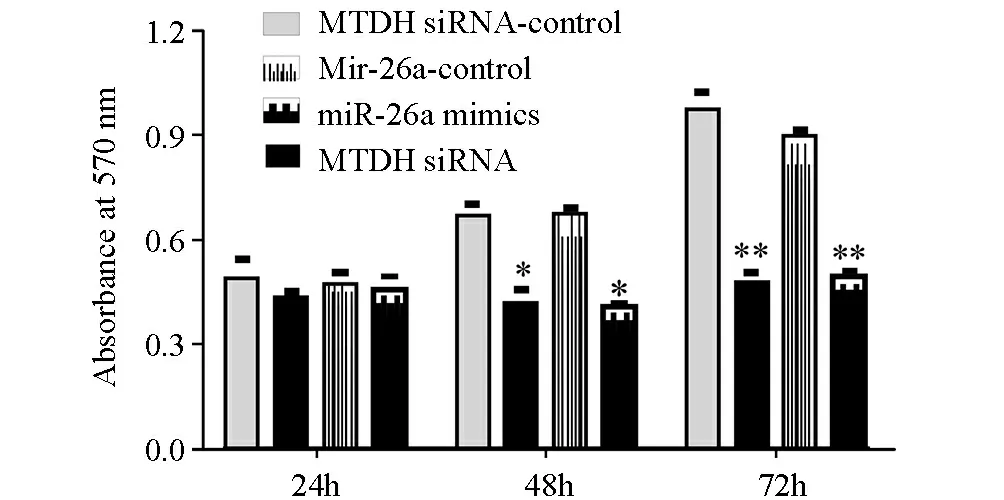
图3 miR-26a与MTDH siRNA抑制CAOV3细胞增殖
2.4 在卵巢癌及其癌旁组织中miR-26a与MTDH的表达成负相关
经SPSS 16.0软件相关性分析发现,在卵巢癌及其癌旁组织中miR-26a与MTDH的表达成负相关,相关系数r=-0.043,P=0.032,差异具有显著性(图4)。
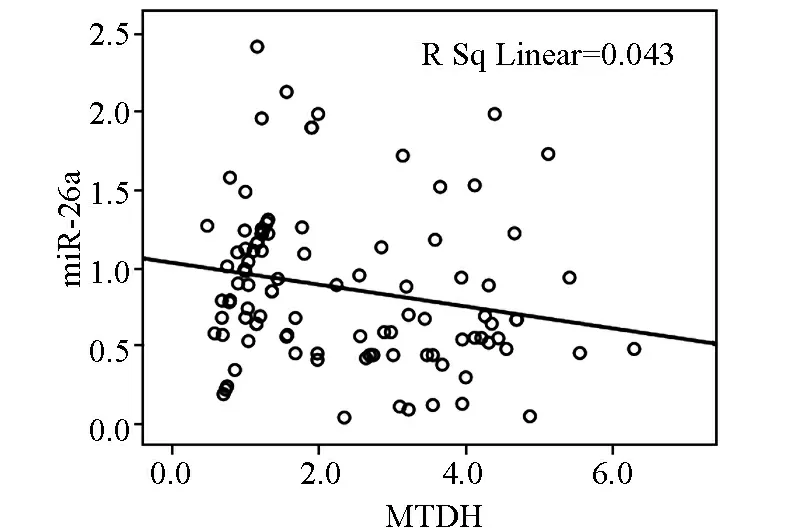
图4 miR-26a与MTDH在卵巢癌及其癌旁组织中的相关性分析
3 讨 论
卵巢癌在女性生殖肿瘤中的发病率居第六位,每年大约有230 000例新发病例[13]。卵巢癌的早期生存率很高,但是由于大多数患者就诊时已是晚期,而且大部分病人对目前的化疗案产生耐药,所以化疗药物对卵巢癌患者的治疗成功率很低[13]。每年约有140 000位患者死于卵巢癌,严重威胁着人民的生命健康[14]。这一状况近十年来未能改善,卵巢癌生存率仍然很低,死亡率居各类妇科恶性肿瘤的首位,对妇女生命造成严重威胁,迫切需要新的治疗药物提高卵巢癌的生存率。
miRNA是长20-23nt的非编码RNA,通过与靶基因3′-非翻译区完全或不完全互补结合,抑制基因的翻译或降解mRNA发挥调控基因表达的功能。目前,有上千的miRNA被发现,已证实许多miRNA参与了发育、分化、凋亡、增殖及细胞死亡等生物过程并发挥重要作用[1,15]。多个miRNA在肿瘤中表达失调。其可能的机制有:miRNA所在基因发生缺失、扩增、转位、转录因子调控、表观遗传调控[2]。研究表明,miRNA在卵巢癌的发生发展中发挥癌基因/抑癌基因的作用,调控肿瘤增殖、浸润、凋亡及耐药性等功能[16]。研究表明miR-26a在肝癌中下调,其表达水平与肝癌患者生存时间及对干扰素治疗的敏感性相关[3]。miR-26a在鼻咽癌中表达下调且能通过靶基因EZH2抑制鼻咽癌细胞生长和致瘤性[4]。同时miR-26a能明显抑制乳腺癌细胞增殖生长、诱导乳腺癌细胞凋亡[17]。然而目前关于miR-26a在卵巢中的研究报道尚少见,本研究通过对卵巢癌和癌旁组织中miR-26a的表达检测,发现miR-26a在卵巢组织中表达明显下调。研究已表明MTDH是miR-26a的靶基因,且本研究通过蛋白质印迹试验也进一步证实MTDH是miR-26a调控的靶基因。MTDH最初在胎儿胶质细胞瘤中发现,是一个HIV诱导的基因,并且作为癌基因参与多种肿瘤的发生发展。研究证实MTDH在多种恶性肿瘤中表达上调,并且通过PI3K-AKT,NF-κB,MAPK以及Wnt/β-catenin信号途径参与肿瘤发生的多种生物学过程[18]。本研究还发现在CAOV3细胞中过表达miR-26a或干扰MTDH后能明显抑制CAOV3细胞的增殖活力,表明miR-26a可能通过下调MTDH的表达,从而抑制卵巢癌CAOV3细胞的增殖。综上所述,miR-26a在卵巢癌细胞中表达下调,并通过直接靶向调控MTDH的表达发挥生物学作用,本文继续深入miR-26a在卵巢癌中的功能和分子研究,系统阐明miR-26a参与卵巢癌发生发展的可能分子机制,为卵巢癌的治疗提供了新的治疗靶点。
[1]Tang H,Deng M,Tang Y,et al.miR-200b and miR-200c as prognostic factors and mediators of gastric cancer cell progression[J].Clin Cancer Res,2014,19(20):5602-5612.
[2]Tang H,Kong Y,Guo J,et al.Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22[J].Cancer letters,2013,340(1):72-81.
[3]Ji J,Shi J,Budhu A,et al.MicroRNA expression,survival,and response to interferon in liver cancer[J].N Engl J Med,2009,361(15):1437-1447.
[4]Lu J,He ML,Wang L,et al.MiR-26a inhibits cell growth and tumorigenesis of nasopharyngeal carcinoma through repression of EZH2[J].Cancer Res,2011,71(1):225-233.
[5]Gaedcke J,Grade M,Camps J,et al.The rectal cancer microRNAome-microRNA expression in rectal cancer and matched normal mucosa[J].Clin Cancer Res,2012,18(18):4919-4930.
[6]Yu C,Chen K,Zheng H,et al.Overexpression of astrocyte elevated gene-1 (AEG-1) is associated with esophageal squamous cell carcinoma (ESCC) progression and pathogenesis[J].Carcinogenesis,2009,30(5):894-901.
[7]Jian-bo X,Hui W,Yu-long H,et al.Astrocyte-elevated gene-1 overexpression is associated with poor prognosis in gastric cancer[J].Med Oncol,2011,28(7):455-462.
[8]Chen W,Ke Z,Shi H,et al.Overexpression of AEG-1 in renal cell carcinoma and its correlation with tumor nuclear grade and progression[J].Neoplasma,2010,57(6):522-529.
[9]Thirkettle HJ,Girling J,Warren AY,et al.LYRIC/AEG-1 is targeted to different subcellular compartments by ubiquitinylation and intrinsic nuclear localization signals[J].Clin Cancer Res,2009,15(9):3003-3013.
[10]Song L,Li W,Zhang H,et al.Over-expression of AEG-1significantly associates with tumour aggressiveness and poor prognosis in human non-small cell lung cancer[J].J Pathol,2009,219(1):317-326.
[11]Li C,Li Y,Wang X,et al.Elevated expression of astrocyte elevated gene-1 (AEG-1) is correlated with cisplatin-based chemoresistance and shortened outcome in patients with stages Ⅲ-Ⅳ serous ovarian carcinoma[J].Histopathology,2012,60(6):953-963.
[12]Zhang B,Liu XX,He JR,et al.Pathologically decreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J].Carcinogenesis,2011,32(1):2-9.
[13]Fung-Kee-Fung M,Oliver T,Elit L,et al.Optimal chemotherapy treatment for women with recurrent ovarian cancer[J].Curr Oncol,2007,14(4):195-208.
[14]Wright JD,Shah M,Mathew L,et al.Fertility preservation in young women with epithelial ovarian cancer[J].Cancer,2009,115(18):4118-4126.
[15]Gao J,Li L,Wu M,et al.MiR-26a Inhibits Proliferation and Migration of Breast Cancer through Repression of MCL-1[J].PLoS One,2013,8(12):e651
[16]Schoof CR,Botelho EL,Izzotti A,et al.MicroRNAs in cancer treatment and prognosis[J].Am J Cancer Res,2012,2(2):414-433.
[17]凌宏艳,廖端芳.微小RNA研究进展[J].中国动脉硬化杂志,2008,16(5):409-412.
[18]Butowski NA,Sneed PK,Chang SM.Diagnosis and treatment of recurrent high-grade astrocytoma[J].J Clin Oncol,2006,24(8):1273-1280.

