二氢青蒿素对胃癌细胞血管生成及相关基因表达的影响
王爱军 施 华 郑宝军 冯俊伟 王红钰 吴 肖
胃癌是我国发病率较高的恶性肿瘤之一,且易发生远处转移。肿瘤细胞增殖和远处转移均依赖于血管生成提供营养,而肿瘤细胞分泌的多种血管生成因子如VEGF-C、COX-2等在血管新生过程中发挥极其重要的作用。二氢青蒿素(dihydroartemisinin,DHA)是青蒿素类药物在体内的主要活性代谢产物,具有较强的抗肿瘤作用。有报道称,青蒿素通过抑制VEGF从而抑制肿瘤淋巴管生成[1],DHA能抑制胰腺癌细胞中血管生成[2]。本研究利用人胃癌细胞株SGC7901,观察DHA对SGC7901细胞血管生成及相关基因表达的影响及意义,为DHA的临床抗肿瘤应用提供依据。
1 材料与方法
1.1 材料
试剂与仪器 RPMI 1640、胰蛋白酶、胎牛血清均为美国 Gibco公司产品;胰蛋白酶、二甲亚砜、3-(4,5-二甲基噻唑)-2,5-二苯基氮唑溴盐(MTT)购自美国Sigma公司;二氢青蒿素(批号:100184-200402)购于中国生物药品检定所;VEGF-C、COX-2、VCAM-1、PTEN和GAPDH一抗购自美国Santa Cruz公司;TRIzol试剂为美国invitrogen公司产品;逆转录试剂盒购自Promega公司;Real-Time PCR试剂盒购自加拿大Fermentas公司;引物由上海生工生物技术公司合成。Real-Time PCR仪购自美国ABI公司;电泳和转膜系统购自Bio-Rad公司。
1.2 方法
1.2.1 细胞株培养和实验分组 胃癌细胞SGC7901购自中国科学院上海细胞生物研究所。SGC7901细胞接种于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640培养液中,于37℃、5%CO2的培养箱中培养,80%汇合后胰蛋白酶消化法传代培养,于传代后第2天换液。
1.2.2 MTT分析 96孔板接种5×104/孔SGC7901细胞,培养24 h 后,5、10、20、40、80 μmol/L DHA处理细胞24、48、72 h。以含0.1%DMSO的培养基为阴性对照组。取其中1个96孔板加入20 μL/孔新鲜配制的MTT溶液(5 mg/mL),继续培养4 h,小心吸去培养液,加入 150 μL/孔 DMSO,室温振荡 10 min,于酶标仪490 nm波长测OD值。另取96孔板分别加入5、10、20、40、80 μmol/L的DHA,每组6个复孔,分别继续培养24、48、72 h,结束前4 h加入20 μL/孔新鲜配制的MTT,每孔加入MTT溶液(5 mg/mL),37℃继续孵育4 h,小心吸去培养液,加入150 μL/孔DMSO,室温振荡10 min,于酶标仪490 nm波长检测代表细胞的增殖活性(OD值)。
1.2.3 总RNA提取及荧光定量RT-PCR 80%汇合后的SGC7901细胞经胰蛋白酶消化法传代,培养24 h后,5、10、20、40、80 μmol/L DHA刺激细胞 24 h,或50 μmol/L DHA 刺激细胞 24、48、72 h,以含 0.1%DMSO的培养基为阴性对照组。各组细胞总RNA采用TRIzol试剂按照说明书进行提取,经核酸定量分析仪测定浓度和纯度后,采用1%琼脂糖凝胶电泳鉴定完整性后用于反转录和荧光定量RT-PCR实验。取2 μg总的RNA在 25 μL体系中逆转成cDNA,根据M-MLV逆转录试剂盒说明书操作。荧光定量RT-PCR反应如下:95℃4 min,进行35个循环。条件为:95℃ 30 s,60℃ 30 s,72℃ 30 s;最后72℃ 5 min。使用的序列(表1)。所有反应均设3个平行组,实验结束后,每对引物的扩增产物均进行溶解曲线分析及相对表达量的计算。实验重复3次。
1.2.4 Western blot检测 80%汇合后的SGC7901细胞经胰蛋白酶消化法传代,培养24 h后,5、10、20、40、80 μmol/L DHA处理细胞24 h,或50 μmol/L DHA处理细胞24、48和72 h,以含0.1%DMSO的培养基为阴性对照组。收集细胞,并将细胞用预冷的PBS洗涤2遍,用含RIPA的裂解液提取总蛋白,BCA法测定蛋白浓度。每泳道40 μg上样,10%SDS-PAGE电泳,转移至PVDF膜。5%脱脂奶粉室温封闭2 h,TBST洗膜后加入特异性一抗(稀释比例为1:500~1:1 000),4℃过夜。洗膜后加入1:5 000的HRP标记的相应二抗37℃孵育1 h,洗膜后ECL发光剂显色、曝光、显影、定影。实验重复3次。

表1 引物序列Table1 Primer sequences
1.3 统计学分析
2 结果
2.1 DHA对细胞活力的影响
通过MTT实验测定DHA对细胞的活力的影响,结果显示,与含0.1%DMSO对照组比较,各浓度DHA对细胞活力均有明显的抑制作用,细胞活力随着DHA浓度的增加及作用时间延长而降低,组间差异有统计学意义(P<0.05)。由此表明,DHA显著抑制细胞生长,且抑制效应呈剂量和时间依赖性(图1)。
2.2 DHA对胃癌细胞血管生成相关因子mRNA表达的影响
荧光定量RT-PCR的结果显示,与含0.1%DMSO对照组比较,40 μ mol/L DHA作用细胞48 h,VEGF-C、COX-2和VCAM-1 mRNA表达明显下调(P<0.05),PTEN mRNA表达明显升高(P<0.05),组间差异有统计学意义(P<0.05,图2)。
2.3 DHA对胃癌细胞血管生成相关因子蛋白表达的影响
Western blot分析的结果显示,与含0.1%DMSO对照组比较,40 μmol/L DHA作用细胞48 h,VEGF-C、COX-2和VCAM-1蛋白表达明显降低(P<0.05),PTEN蛋白表达明显升高(P<0.05),组间差异有统计学意义(P<0.05,图3)。

图1 DHA对细胞的活力的影响Figure1 Effect of DHA on cell viability
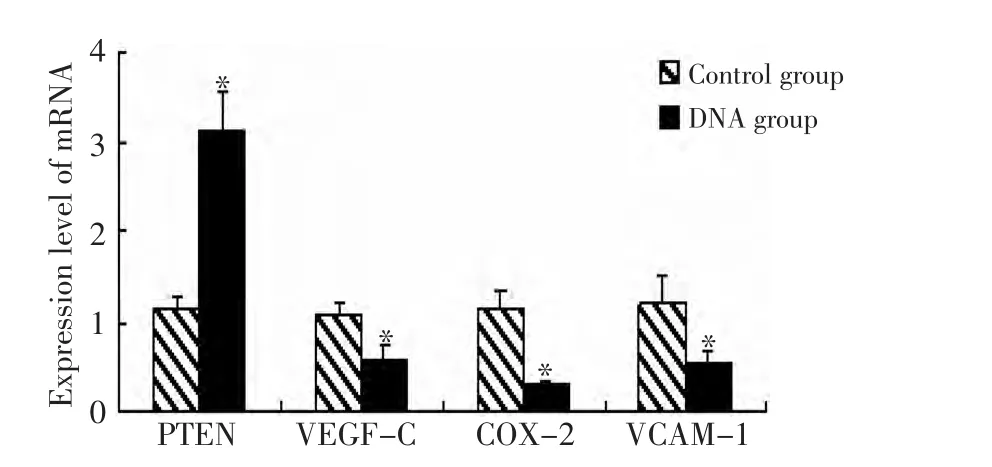
图2 DHA对胃癌细胞血管生成相关因子mRNA表达的影响Figure2 DHA expression and blood vessel correlative factor mRNA in gastric cancer cells

图3 DHA对胃癌细胞血管生成相关因子蛋白表达的影响Figure3 DHA expression and blood vessel correlative factor protein in gastric cancer cells
3 讨论
肿瘤所在的微环境是除了肿瘤自身因素外决定肿瘤发生发展的重要因素,尤其肿瘤周围微血管的生成是肿瘤发生发展转移的关键因素,与预后密切相关,而肿瘤血管的生成又会受到血管生成促进因子和血管生成抑制因子双方面的调节。血管生成促进因子增多和(或)血管生成抑制因子减少,均可导致血管生成过程的启动。
由于中药作用于肿瘤具有多靶点调节的优势,且目前许多化疗药物在治疗过程中不良反应大,治疗效果不理想,因此,在植物中寻找低毒高效的抗肿瘤药物已成为目前国内外重要的研究课题。二氢青蒿素是青蒿素类药物在体内主要活性代谢产物,且呈现出比其他青蒿素类药物更强的抗肿瘤活性。近年来发现,DHA能抑制如胰腺癌[3]、前列腺癌[4]和肺癌[5]等多种肿瘤细胞生长,具有较好的应用前景。
本实验中使用6.25~100 μmol/L的DHA作用细胞,以剂量和时间依赖的方式抑制细胞增殖。在此基础上,进一步从分子角度探讨了DHA对肿瘤血管生成因子表达的影响,结果显示DHA能以剂量和时间依赖性抑制SGC7901细胞中VEGF-C、COX-2和VCAM-1的转录和翻译,同时对PTEN的转录和翻译则有明显的促进作用。VEGF是目前已知的作用最强的促血管生成因子,能够特异地促进内皮细胞增殖、迁移以及肿瘤血管生成[6]。多种肿瘤组织中VEGF表达上调,且其表达上调与血管生成密切相关。国内研究人员发现,中药能抑制VEGF的表达,如雷公藤内酯醇、胃安宁颗粒及健脾解毒方都能通过抑制胃癌细胞或胃癌组织中VEGF表达发挥抗肿瘤作用[7-9],本研究发现DHA也具有较强的抑制胃癌细胞VEGF表达的作用,因此推测DHA也可能通过抑制VEGF表达从而抑制胃癌组织血管生成,后续体内实验将进一步明确这一结果。
环氧合酶(cyclooxygenase,COX)是前列腺素(PGs)合成过程中的一个重要限速酶,已经明确,COX-2具有明显的促进肿瘤血管生成的作用[10-13]。有研究发现,COX-2和VCAM-1在胃癌组织中表达较高,与VEGF变化一致,且同时伴MVD升高[14];PTEN在胃癌组织中表达较低,与VEGF变化相反[15]。本研究结果显示,DHA也能抑制胃癌细胞COX-2和VCAM-1的表达,促进PTEN表达。
综上所述,中药DHA能通过影响不同类型肿瘤血管生成相关基因的表达,以多靶点、多角度的方式抑制胃癌细胞的生长。本研究为临床上以中药治疗或者辅助治疗胃癌提供了有力的证据,但由于基础研究与体内药物作用有所差异,相关体内研究机制探讨将在后续实验中得到印证。
1 Wang J,Zhang B,Guo Y,et al.Artemisinin inhibits tumor lymphangiogenesis by suppression of vascular endothelial growth factor C[J].Pharmacology,2008,82(2):148-155.
2 Wang SJ,Sun B,Cheng ZX,et al.Dihydroartemisinin inhibits angiogenesis in pancreatic cancer by targeting the NF-κB pathway[J].Can Chem Phar,2011,68(6):1421-1430.
3 Aung W,Sogawa C,Furukawa T,et al.Anticancer effect of dihydroartemisinin(DHA)in a pancreatic tumor model evaluated by conventional methods and optical imaging[J].Anti Res,2011,31(5):1549-1558.
4 Morrissey C,Gallis B,Solazzi JW,et al.Effect of artemisinin derivatives on apoptosis and cell cycle in prostate cancer cells[J].Anti Drugs,2010,21(4):423-432.
5 Zhou HJ,Zhang JL,Li A,et al.Dihydroartemisinin improves the efficiency of chemotherapeutics in lung carcinomas in vivo and inhibits murine Lewis lung carcinoma cell line growth in vitro[J].Canc Chem Phar,2010,66(1):21-29.
6 Chen P,Zhu J,Liu DY,et al.Over-expression of survivin and VEGF in small-cell lung cancer may predict the poorer prognosis[J].Med Oncol,2014,31(1):775.
7 Wang GP,Yin CJ,Ouyang S,et al.And the effects of triptolide on the expression of vascular endothelial growth factor on proliferation of human gastric cancer cell line SGC-7901[J].J of Prac Medi,2008,24(1):17-19.[王国平,尹成进,欧阳曙,等.雷公藤内酯醇对人胃癌细胞SGC-7901增殖及表达血管内皮生长因子的影响[J].实用医学杂志,2008,24(1):17-19.]
8 Xu YQ,Shen MQ,Wu H,et al.Experimental study of weianning granules inhibit tumor angiogenesis[J].Jiangsu J of Trad Chin Medi,2010,42(4):76-77.[许尤琪,沈明勤,吴 昊,等.胃安宁颗粒抑制肿瘤血管生成的实验研究[J].江苏中医药,2010,42(4):76-77.]
9 Liu NN,Wang Y,Zhou LH,et al.Inhibition of jianpi jiedu recipe on angiogenesis in helicobacter plori-induced gastric cancer[J].Chin J of Exp Trad Medi Form,2011,17(1):88-95.[刘宁宁,王 炎,周利红,等.健脾解毒方对幽门螺杆菌诱发胃癌血管新生的抑制研究[J].中国实验方剂学杂志,2011,17(1):88-95.]
10 Cheng J,Fan XM.Role of cyclooxygenase-2 in gastric cancer development and progression[J].World J Gastroenterol,2013,19(42):7361-7368.
11 Kargi A,Uysal M,Bozcuk H,et al.The importance of COX-2 expression as prognostic factor in early breast cancer[J].J Buon,2013,18(3):579-584.
12 Ma JX,Sun YL,Wang YQ,et al.Triptolide induces apoptosis and inhibits the growth and angiogenesis of human pancreatic cancer cells by downregulating COX-2 and VEGF[J].Oncol Res,2013,20(8):359-368.
13 Li W,Tang YX,Wan L,et al.Effects of combining Taxol and cyclooxygenase inhibitors on the angiogenesis and apoptosis in human ovarian cancer xenografts[J].Oncol Lett,2013,5(3):923-928.
14 Tang H,Wang J,Bai F,et al.Positive correlation of osteopontin,cyclooxygenase-2 and vascular endothelial growth actor in gastric cancer[J].Can Inv,2008,26:60-67.
15 Huang J,Kontos CD.PTEN modulates vascular endothelial growth factor-mediated signaling and angiogenic effects[J].J Biol Chem,2002,277(13):10760-10766.

