生物转化液下游预处理工艺开发
许贤恩,王仁凤,王亚军
(1.浙江工业大学 生物工程研究所,浙江 杭州 310014;2.生物转化与生物净化教育部工程研究中心,浙江 杭州 310014)
生物催化正迅速成长为生物技术应用的主导方向[1],是现代绿色化学加工业的重要组成部分,对化学工业技术进步起着重要的作用[2],越来越多的化学品采用生物催化技术来合成。但是生物酶法催化反应体系中往往含有大量的酶蛋白、催化细胞、细胞内容物、细胞碎片等而导致后续产物回收困难,溶剂萃取时则会产生严重的乳化现象,降低后续提炼产物的提取收率。因此,需要通过一些措施去除转化液中的菌体及蛋白质。工业生产中往往采用活性炭吸附过滤的方法,该方法方便易行,但是大量蛋白质或菌体细胞的存在会使滤饼极其粘滞,堵塞滤孔而中断过滤,因而下游的生物转化液中的产物分离回收成为生物酶法催化生产工艺开发的一个棘手问题。
混凝现象是指微粒凝结现象,包括凝聚和絮凝现象。在发酵领域中,混凝技术主要应用于生化产品的制备过程中的菌体回收[3],菌体、蛋白去除。通过菌体混凝技术提高产品的产量,其工作原理是添加混凝剂使颗粒细小的胶体、菌体细胞、细胞碎片、残留培养基等固形物凝聚成较大的颗粒,易于沉降,从而更有利于发酵液的固液分离,极大的降低了固液分离的成本[4]。但是鲜有文献报道高细胞浓度的生物转化液中的菌体及蛋白质的去除方法。本文考察了混凝和破乳技术应用于生物催化法合成1-氰基环己基乙酸、阿托伐他汀关键手性前体6-氰基-(3R,5R)-二羟基己酸叔丁酯、1-氰基环己基乙酸生物转化液中菌体、蛋白质去除的可行性。
1 实验部分
1.1 材料和仪器
试剂:6-氰基-(3R,5R)-二羟基己酸叔丁酯由浙江新东港药业股份有限公司馈赠,6-氰基-(5R)-羟基-3-羰基己酸叔丁酯标准品,实验室自制;1-氰基环己基乙腈、1-氰基环己基乙酸由浙江手心医药化学品有限公司馈赠。其余各种试剂均为市售分析纯。
UV-2000型紫外可见分光光度计,尤尼柯仪器有限公司,中国上海。Leica DM4000 B生物显微镜,德国。
1.2 生物转化液制备
低粘度生物转化液A:1-氰基环己基乙酸的生物转化液,含有底物约为150 g/L的1-氰基环己基乙酸腈(固体,不易溶于水),菌体含量16 g DCW/L,搅拌反应7 h转化率95%以上,无其他添加物。
高粘度生物转化液B:6-氰基-(3R,5R)-二羟基己酸叔丁酯生物转化液,制备过程参考文献[5],含有约200 g/L 6-氰基-(3R,5R)-二羟基己酸叔丁酯、300 g/L葡萄糖酸,菌体含量15 g DCW/L,反应体系为0.1 mol/L磷酸钾缓冲溶液。
1.3 混凝剂使用方法
选择 AlCl3·6H2O、Al2(SO4)3·18H2O、FeCl3、Fe2(SO4)3·XH2O、MnCl2·4H2O、ZnSO4·7H2O、聚合硫酸铝(PAS)、聚合硫酸铁(PFS)等8种混凝剂作为考察对象,预先用去离子水配制300 g/L工作贮液,使用时按体积量取使用。
1.4 混凝实验步骤
参照文献[6]方法。配制混凝剂溶液,将100 mL生物转化液置于250 mL圆底烧瓶中,控制温度20~30℃,pH值为初始值约7.0,同时300 rpm转速搅拌。加入设定量混凝剂的同时开始计时,保持快速搅拌1 min。降低搅拌速度至50 rpm促使絮体形成并保持絮体悬浮,低速搅拌15 min后停止搅拌,取样,显微镜下观察絮体形态。静置30 min后减压过滤记录过滤速度,除去絮体后取样检测,计算蛋白去除率或者细胞去除率。
1.5 生物转化液去乳化方法
将100 mL生物转化液置于250 mL圆底烧瓶中缓慢机械搅拌(50 rpm),加入一定量的表面活性剂充分溶解,低速搅拌30 min后取样,用显微镜观察乳化现象。
1.6 分析方法
对于以细胞破碎液为催化剂的转化液,各样品进行絮凝操作,过滤除絮体后取样,根据Bradford法测定OD595值,计算蛋白质含量[7]。根据公式(1)计算蛋白质去除率:

其中,ΔCo为添加混凝剂前的蛋白质浓度,g/L;ΔCI为添加混凝剂处理后的残留蛋白质浓度,g/L。
对于以静息细胞为催化剂的转化液,各样品进行絮凝操作后过滤除絮体后取样分光光度计测定OD600值。根据公式(2)计算菌体细胞去除率:

其中,ΔAo为添加混凝剂前的转化液OD600值;ΔAi为添加混凝剂处理后的转化液OD600值。
2 结果与讨论
2.1 生物转化液形貌分析

图1 不同生物转化液体系的显微形态(10×20):a,生物转化液A;b,生物转化液B。
实验选择实验室制备的中低粘稠度的转化液A与高粘稠度的转化液B。如图1所示,生物转化液A体系较均匀,图中颜色较深的为聚集在一起的菌体,而生物转化液B存在大量不同尺寸的液滴,即发生了乳化现象,整个体系粘滞。实验发现,向生物转化液A中添加混凝剂铁盐、铝盐等作为混凝剂能有效聚结、沉淀转化液中的菌体、蛋白质等物质;而对于已经发生了乳化现象的生物转化液B,乳化现象会影响混凝剂与蛋白质、菌体的相互作用从而影响混凝效果,因此需要解决转化液的乳化现象。
2.2 低粘度生物转化液的菌体去除
铁盐、铝盐及其高聚物是研究的比较透彻的混凝剂并且廉价易得[8],本试验我们考察了AlCl3·6H2O,Al2(SO4)3·18H2O,FeCl3,Fe2(SO4)3·XH2O,MnCl2·4H2O,ZnSO4·7H2O,聚合硫酸铝(PAS)和聚合硫酸铁(PFS)等8种混凝剂对生物转化液A中菌体蛋白混凝效果。在3.0~16.5 g/L浓度范围内,不同混凝剂的混凝效果示于图 2。除MnCl2·4H2O,ZnSO4·7H2O外,其他6种混凝剂在一定浓度范围内的蛋白去除率可以达到接近100%(图2)。这6种混凝剂的蛋白去除率随着投药量的增大而增大,但过高的混凝剂用量反而会降低蛋白质的去除效率,尤其是AlCl3·6H2O,FeCl3这两种混凝剂 (图 2)。
对不同混凝剂混凝后的絮体进行形貌观察示于图 3。MnCl2·4H2O、ZnSO4·7H2O 处理得到的絮体细密,空隙极小,显示该混凝过程中主要是电荷中和起的凝聚作用。而其它6种混凝剂则絮体疏松、空隙较大。这表明在絮体形成的过程中除了电荷中和、双电层压缩的作用外,水解产物的网捕卷扫对絮凝效果也起了重要的作用,导致混凝剂的使用量相对较少,混凝效果也相对较好[9]。
不同混凝剂处理对生物转化液减压抽滤时间的影响示于图4。Al2(SO4)3·18H2O处理后的絮体最粘稠, 抽滤速度最慢;FeCl3,ZnSO4·7H2O 次之。图5考察了不同菌体细胞浓度的生物转化液混凝所需要的 Al2(SO4)3·18H2O 用量,在 4~24 g DCW/L菌体浓度范围内,随着浓度增大Al2(SO4)3·18H2O用量也相应增大。

图2 不同混凝剂不同浓度下的混凝效果

图3 不同混凝剂混凝处理后的生物转化液形貌(40×10)。其中,0,空白对照;1,AlCl3·6H2O;2,Al2(SO4)3·18H2O;3,FeCl3;4,Fe2(SO4)3·XH2O;5,MnCl2·4H2O;6,ZnSO4·7H2O;7,PAS;8,PFS。

图4 不同混凝剂对混凝处理后的生物转化液的过滤时间的影响

图5 不同菌体用量与硫酸铝混凝剂用量的关系
2.3 生物转化液破乳
考察了十二烷基磺酸钠、十二烷基硫酸钠、溴代十六烷基吡啶、十二烷基三甲基氯化铵和十六烷基三甲基氯化铵等5种表面活性剂的破乳效果。结果表明,十二烷基硫酸钠具有较好的破乳效果,十二烷基磺酸钠次之 (图6)。图中可以看到十二烷基硫酸钠处理过的生物转化液几乎不存在乳化小液滴,十二烷基磺酸钠处理过的样品仍然含有部分小液滴,其他3种表面活性剂则不同程度的加剧了乳化现象。
向20 g/L表面活性剂处理过的生物转化液B中添加乙酸乙酯萃取,十二烷基硫酸钠处理的样品不出现乳化现象,十二烷基磺酸钠处理的样品仍然有部分乳化,其它3种表面活性剂对乳化现象没有任何改善。
经不同浓度的十二烷基硫酸钠处理后,生物转化液B中的乳化小液滴数量随着十二烷基硫酸钠的增加而减少,超过15 g/L十二烷基硫酸钠处理能基本消除了乳化小液滴,直接乙酸乙酯萃取也不会出现乳化现象(图7)。因此,十二烷基硫酸钠可以去除生物转化液B的乳化现象,并且较高浓度处理后的生物转化液直接进行溶剂萃取亦不发生乳化现象。
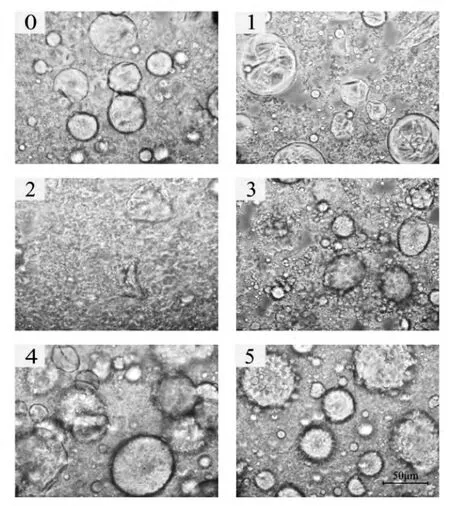
图6 不同表面活性剂处理后的生物转化液形貌 (10×20)。其中,0,空白对照;1,十二烷基磺酸钠;2,十二烷基硫酸钠;3,溴代十六烷基吡啶;4,十二烷基三甲基氯化铵;5,十六烷基三甲基氯化铵。

图7 不同浓度十二烷基硫酸钠处理后的生物转化液形貌(10×20)。其中,a,0 g/L;b,4.0 g/L;c,15.0 g/L;d,20.0 g/L。
2.4 发生乳化现象的高粘度生物转化液菌体去除
乳化后的生物转化液可以先表面活性剂处理使去乳化后,再混凝除去菌体及蛋白质等物质。表1考察了不同浓度十二烷基硫酸钠处理后所需的混凝剂添加量,十二烷基硫酸钠的最佳添加量为4.0 g/L,FeCl3用量9.0 g/L,其它混凝剂的添加量均可以为18.0 g/L。上述预处理工艺条件均能有效去除蛋白质,去除率接近100%。
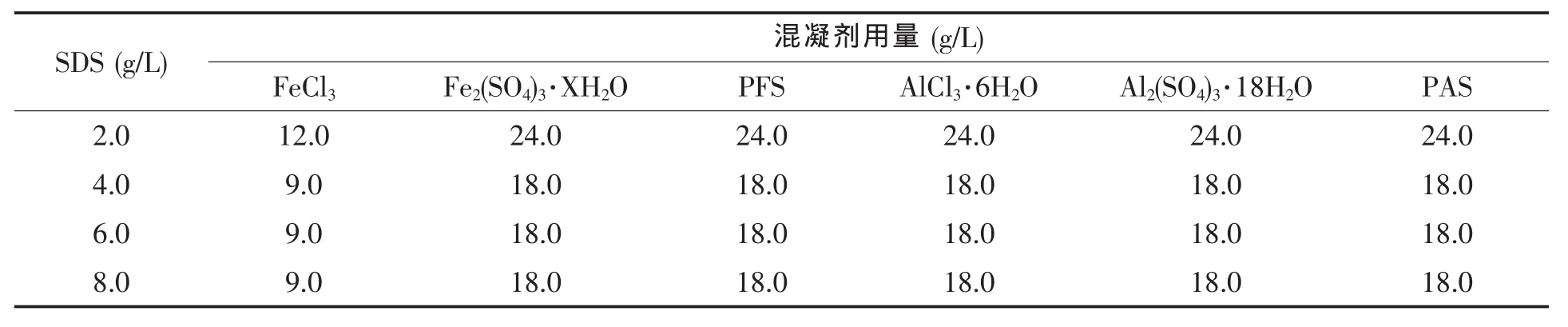
表1 发生乳化现象的生物转化液经不同浓度十二烷基硫酸钠处理后所需的混凝剂用量

图8 生物转化液形貌变化。其中,a,未处理生物转化液;b,4.0 g/L十二烷基硫酸钠、18.0 g/L硫酸铁处理过的生物转化液;c,处理后的生物转化液直接萃取效果。
图8所示以硫酸铁混凝剂为例,乳化后生物转化液先采用4.0 g/L十二烷基硫酸钠处理,然后18.0 g/L硫酸铁混凝处理,可以明显看到原本均匀分布的、稳定的菌体蛋白质、菌体碎片等物质混凝成肉眼可见的易于去除的大颗粒 (图8b),处理后转化液未过滤直接加入乙酸乙酯萃取也不会发生乳化现象 (图8c),且容易两相分离,蛋白质、菌体絮体悬浮在中间层。
3 结论
环境保护迫在眉睫,生物催化合成技术被越来越多地被工业采用。我们通过试验提出了简单易行的生物转化液后处理方法:未发生乳化的低粘度生物转化液直接加入铝盐、铁盐或者其高聚物混凝处理;对于已经发生乳化现象的高粘度生物转化液,先添加少量表面活性剂十二烷基硫酸钠处理后再混凝处理。处理后的生物转化液几乎检测不到蛋白质残留,减少了后续分离操作中产物的损失,提高了生物过程的经济性。
[1]欧阳平凯,韦萍,姚忠.生物化工研究现状与发展趋势[J].化工进展,2003,22(1):1-7.
[2]谭天伟.生物化工现状与展望[J].化工中间体,2003(11):6-10.
[3]Finkler L.,Luna-Finkler C.L.,Pinto J.C.,et al.Concentration of Cupriavidus necator cells by flocculation and sedimentation[J].World Journal of Microbiology and Biotechnology,2007,23(12):1789-1795.
[4]石亚静,赵永强,王聪,等.絮凝剂在制药发酵液预处理过程中的应用研究[J].医药工程设计,2009,30(5):13-15.
[5]曹政,王亚军,肖黎,等.羰基还原酶不对称还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯的研究[J].生物加工过程,2013,11(1):17-22.
[6]Whittington P.N.Fermentation broth clarification techniques[J].Applied Biochemistry and Biotechnology,1990,23(2):91-121.
[7]Bradford M.M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of pro tein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[8]袁宗宣,郑怀礼,舒型武.絮凝科学与技术的进展[J].重庆大学学报,2001,24(2):143-147.
[9]叶健,吴纯德,梁佳莉,等.硫酸铝作为混凝剂时絮体破碎与再絮凝的研究[J].中国给水排水,2011,27(7):71-74.

