毛泡桐二倍体及其同源四倍体的AFLP和MSAP分析
翟晓巧,张晓申,范国强,赵振利,曹喜兵
(1. 河南省林业科学研究院,河南 郑州 450003; 2. 河南农业大学 泡桐研究所,河南 郑州 450002)
毛泡桐二倍体及其同源四倍体的AFLP和MSAP分析
翟晓巧1,2,张晓申2,范国强2,赵振利2,曹喜兵2
(1. 河南省林业科学研究院,河南 郑州 450003; 2. 河南农业大学 泡桐研究所,河南 郑州 450002)
分别用AFLP和MSAP分子标记技术,研究了毛泡桐二倍体及其同源四倍体幼苗DNA碱基序列及其甲基化的变化。结果表明,毛泡桐二倍体及其同源四倍体DNA碱基序列在AFLP水平上没有发生变化;在MSAP扩增电泳凝胶上,毛泡桐二倍体及其同源四倍体分别检测到2 262和2 180个扩增位点,DNA甲基化位点占总扩增位点的比例分别为35.32%和38.58%,其中DNA全甲基化比例则为12.86%和14.13%;毛泡桐同源四倍体DNA甲基化和去甲基化频率高于其二倍体,总DNA甲基化多态性低于二倍体。
毛泡桐;二倍体;同源四倍体;DNA甲基化;AFLP;MSAP
在植物进化过程中,多倍化是植物适应环境的一种表现形式。自然界大约70%的被子植物在进化史中经历过一次或一次以上的多倍化事件[1]。植物多倍化后,因染色体数目增多,基因的剂量效应和互作效应会引起植物一系列生理生化代谢活动的改变,最终在形态特征等方面表现出差异[2-3]。植物多倍化过程中,一方面染色体结构[4-7]和基因表达模式发生了变化[8-11],另一方面DNA甲基化也发生了变化[12-14]。DNA甲基化通过DNA构象、DNA稳定性、DNA与蛋白质相互作用方式和染色质结构等的改变,从而控制基因的表达[15-17]。泡桐Paulownia spp.是我国重要的速生用材和绿化树种之一,在生态环境改善、缓解目前我国木材短缺局面和提高农民生活水平等方面发挥着重要作用,但因其种质资源匮乏、遗传背景窄等原因造成现有二倍体泡桐品种存在丛枝病发生严重和“低干大冠”等问题,严重影响了泡桐效益的发挥。近年来,四倍体泡桐新种质的成功诱导[18-23],一方面扩大了其遗传背景,另一方面也为筛选泡桐新品种提供了材料支撑。为了解二倍体及其同源四倍体泡桐遗传差异及DNA甲基化的作用,利用AFLP和MSAP分子标记技术,开展了毛泡桐二倍体及其同源四倍体DNA碱基序列及其甲基化变化研究工作,以期阐明四倍体泡桐优良特性的分子机理,为四倍体泡桐的大面积推广提供理论支撑。
1 材料与方法
1.1 试验材料
材料为河南农业大学泡桐研究所林木生物技术实验室培养30 d 的二倍体毛泡桐Paulownia tomentosa及其同源四倍体毛泡桐组织培养苗。剪取适量生长状况良好、大小一致、长约0.5 cm的幼苗顶芽,用液氮速冻后放于-86℃冰箱内备用。组培苗培养条件为温度(25±2)℃、光照强度130 µmol·m-2s-1、光照时间 16 h·d-1。
1.2 试验方法
1.2.1 泡桐DNA的提取
毛泡桐二倍体及其同源四倍体DNA的提取方法参照文献[24]。
1.2.2 泡桐AFLP和MSAP分析
毛泡桐二倍体及其同源四倍体DNA的AFLP和MSAP扩增所需的96对引物组合的碱基序列和扩增过程及其产物的电泳分析方法分别参照文献[25-26]。
1.2.3 电泳凝胶的谱带分析
AFLP和MSAP扩增产物电泳结束、凝胶显影后,先在UMAX PowerLook 2100XL型扫描仪扫描成像,再分别统计分析不同MMS浓度处理样品间AFLP和MSAP凝胶谱带的变化。对MSAP凝胶谱带来说,H和M分别为EcoRⅠ/ HpaⅡ和EcoRⅠ/ MspⅠ双酶切产物电泳谱带。每一条谱带代表一个酶切位点。将谱带有或无分别记作“1”或“0”。 每个DNA样品的H和M扩增谱带可划分为4 种[种类I(H,M= 1,1),无甲基化发生;种类Ⅱ(H,M =1,0),单链 DNA外甲基化;种类Ⅲ(H,M =0,1),双链 DNA内甲基化;种类IV(H,M =0,0),双链DNA外甲基化]。DNA甲基化类型分为多态性和单态性类型。DNA多态性类型包括:A(甲基化) 型、B(去甲基化) 型和C(不定) 型。其中,A型中的A1和A2代表DNA重新甲基化(对照样H和M泳道均有带,而处理样仅H或M泳道有带),A3和A4代表DNA超甲基化(对照样仅H或M有一条带,而处理样H和M泳道都没带)。B型(Bl、B2、B3和 B4)代表DNA去甲基化,DNA甲基化谱带与A型相反。C型代表DNA甲基化的不确定性(对照样与处理样DNA甲基化差异谱带无法确定)。单态性类型为D型(二倍体与四倍体间DNA谱带相同)。同时,计算样品的总DNA甲基化水平[(种类II + 种类Ⅲ)/(种类I + 种类II + 种类III)×100%]和总DNA甲基化多态性[(A+B+C)/(A+B+C+D)×100%]及DNA单态性[D/(A+B+C+D)×100%]。
2 结果与分析
2.1 毛泡桐二倍体及其同源四倍体DNA的AFLP分析
由毛泡桐二倍体及其同源四倍体DNA的AFLP扩增结果(见图1)可以看出,毛泡桐二倍体及其四倍体DNA的AFLP酶切位点相同。尽管同源四倍体毛泡桐与其二倍体的DNA经不同引物AFLP扩增后,产生片段的大小和数量存在一定的差异,但是经同一引物扩增后产生了数量相同和长度一致的DNA片段。也就是说,毛泡桐二倍体染色体加倍前后DNA碱基序列在AFLP水平上没有发生变化。

图1 毛泡桐二倍体及其同源四倍体AFLP扩增产物的部分SDS-PAGEFig.1 SDS-PAGE of partial AFLP amplif i cation products of diploid and tetraploid P. tomentosa
2.2 毛泡桐二倍体及其同源四倍体基因组DNA甲基化变化
2.2.1 毛泡桐二倍体及其同源四倍体DNA
甲基化水平变化
毛泡桐二倍体及其同源四倍体MSAP的扩增产物电泳结果(见表1)表明,毛泡桐同源四倍体的DNA甲基化水平高于其二倍体。毛泡桐二倍体DNA的MSAP扩增出2 262个位点数,其中全甲基化位点数为291个(占总扩增带数的12.86%),半甲基化位点数为498个(占总扩增位点的22.02%),总甲基化位点为799个(占总扩增带数的35.32%);毛泡桐同源四倍体DNA的MSAP扩增出2 180个位点数,其中DNA全甲基化位点数为308个(占总扩增带数的14.13%),半甲基化位点数为533个(占总扩增位点的24.45%),总甲基化位点为841个(占总扩增带数的38.58%)。毛泡桐二倍体及其同源四倍体的DNA甲基化位点均以双链全甲基化为主,并且同源四倍体DNA全甲基化和半甲基化水平高于其二倍体。

表1 毛泡桐二倍体及其同源四倍体基因组DNA甲基化水平的变化Table 1 DNA methylation levels between diploid and autotetraploid P. tomentosa
2.2.2 毛泡桐二倍体及其同源四倍体基因组DNA甲基化模式的变化
由毛泡桐二倍体及其同源四倍体DNA的MSAP扩增产物凝胶电泳谱带及其分析结果(见图2、表2和表3)可以看出,毛泡桐二倍体DNA甲基化(A 型)位点数分别为335,占总甲基化多态性位点数的17.10%;去甲基化(B 型)位点数分别为372,占总甲基化多态性位点数的18.99%;其中,与毛泡桐二倍体相比,同源四倍体毛泡桐的DNA总甲基化多态性为 36.60%,单态性为63.40% 。同源四倍体毛泡桐的DNA甲基化和去甲基化频率高于其二倍体,总DNA甲基化多态性小于其二倍体。
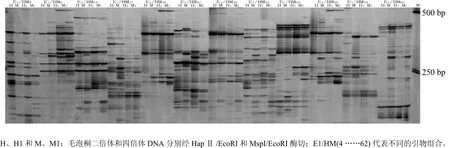
图2 毛泡桐二倍体及其同源四倍体基因组DNA甲基化模式变化Fig.2 DNA methylation patterns of diploid and tetraploid P. tomentosa

表2 毛泡桐二倍体及其同源四倍体DNA甲基化模式变化Table 2 Changes of DNA methylation patterns between diploid and autotetraploid P. tomentosa

表3 毛泡桐二倍体及其同源四倍体DNA甲基化状态变化Table 3 Changes of DNA methylation status between diploid and autotetraploid P. tomentosa
3 讨 论
植物同源四倍体是其二倍体染色体加倍后形成的新种质,在解决染色体加倍带来的核质平衡问题后,才能适应环境条件,完成其生活史。同源四倍体与其二倍体在形态特征等方面存在明显差异,产生这些差异的根本原因在于四倍体发生了基因表达水平的差异。有关植物二倍体及其同源四倍体DNA碱基序列上的差异,不同研究者得出的结论也不完全相同。焦锋等[27]和林强等[28]分别用RAPD分析了桑树二倍体及其同源四倍体的DNA 指纹后没有发现差异条带;聂丽娟等[29]利用AFLP没有检测到西瓜二倍体及其同源四倍体DNA碱基序列间的变化;土豆染色体加倍前后DNA碱基序列也没有发生变化[30]。然而,刘文革等[31]和王卓伟等[32]分别利用AFLP比较西瓜和桑树二倍体与其同源四倍体的结果表明,二者的DNA 碱基序列则发生了一定程度的改变。黄瓜二倍体及其同源四倍体的研究结果也是如此[33]。本试验中,利用AFLP分析发现,毛泡桐二倍体及其染色体加倍后的DNA碱基序列没有发生变化。该结果的出现可能与毛泡桐四倍体泡桐诱导过程中秋水仙碱用量较小、没有引起染色体重叠、不等交换及突变等有一定关系。植物染色体加倍后,植株细胞内因核质不平衡等事件的发生,染色体结构等必然会作出适当调整;此外,环境还迫使植物作出适宜的形态变化以适应周围温度、光照等条件,从而发生基因表达水平和表观遗传学变化[34-42]。因此,用MSAP技术就很容易检测出染色体加倍后DNA甲基化的变化情况[43-46]。在此需要说明的是,因AFLP检测的是DNA片段,故要证明毛泡桐二倍体及其同源四倍体DNA碱基序列是否相同,还需开展DNA单碱基(SNP)水平的研究工作。
[1] Wendel J F. Genome evolution in polyploids[J].Plant Mol.Biol.,2000,42:225-249.
[2] Hilu K W. Polyploidy and the evolution of domesticated plants[J].Am. J. Bot.,1993,80:1494-1499.
[3] Liu B, Wendel J F. Non-mendelian phenomena in allopolyploid genome evolution[J].Curr. Genomics.,2002,3:489-505.
[4] Swapna M, Sivaraju K, Sharma R K,et al. Single-strand conformational polymorphism of EST-SSRs: a potential tool for diversity analysis and varietal identif i cation in sugarcane[J].Plant Mol. Biol. Rep.,2011,29:505-513.
[5] Song K, Lu P, Tang K,et al.Rapid genome change in synthetic polyploids of Brassica and its implications for polyploid evolution[J].Proc. Natl. Acad. Sci.,1995,92:7719-7723.
[6] Pires J C, Zhao J W, Schranz M E,et al. Flowering time divergence and genomic rearrangements in resynthesized polyploids (Brassica)[J].Biol. J .Linn. Soc. Lond.,2004,82:675-688.
[7] Pontes O, Neves N, Silva M,et al. Chromosomal locus rearrangements are a rapid response to formation of the allotetraploidArabidopsis suecicagenome[J]. Proc. Natl.Acad.Sci., 2004,101:18240-18245.
[8] Lu B B, Pan X Z, Zhang L,et al. A genome-wide comparison of genes responsive to autopolyploidy in Isatis indigotica usingArabidopsis thalianaAffymetrix Genechips[J].Plant Mol. Biol.Rep.,2006,24:197-204.
[9] Adams K L, Cronn R, Percif i eld R,et al. Genes duplicated by polyploidy show unequal contributions to thetranscriptome and organspecific reciprocal silencing[J].Proc. Natl .Acad.Sci.,2003,100:4649-4654.
[10] Adams K L, Percif i eld R, Wendel J F. Organ-specif i c silencing of duplicated genes in a newly synthesized cotton allotetraploid[J].Genetics, 168:2217-2226.
[11] Kashkush K, Feldman M, Levy A A. Gene loss, silencing and activation in a newly synthesized wheat allotetraploid[J].Genetics, 2002, 160:1651-1659.
[12] Liu B, Wendel J F. Epigenetic phenomena and the evolution of plant allopolyploids[J].Mol. Phylogenet. Evol.,2003,29:365-379.
[13] Wang J, Tian L, Madlung A,et al.Stochastic and epigenetic changes of gene expession inArabidopsis polyploids[J].Genetics,2004,167: 1961- 1973.
[14] Levy A A, Feldman M. Genetic and epigenetic reprogramming of the wheat genome upon allopolyploidization[J].Biol. J. Linn.So.c Lond,2004, 82:607-613.
[15] Hao Y J, Deng X X. Stress treatments and DNA methylation afected the somatic embryogenesis of citrus callus[J]. Aeta Botanica Sinica, 2002 ,44(6):673-677.
[16] Yoder J A,Soman N S,Verdine G L,et al.DNA (cytosine-5)-methyltransferases in mouse cells and tissues.Studies with a mechanism-based probe[J]. J. Mol. Biol.,1997,270:385-395.
[17] Finnegan E J,Kovac K A.Plant DNA methylationforases[J].Plant Mol. Biol.,2000,43:189-201.
[18] 范国强, 杨志清, 曹艳春, 等. 秋水仙素诱导兰考泡桐源四倍体[J].核农学报,2006,20(6):473-476.
[19] 范国强, 杨志清, 曹艳春, 等. 毛泡桐同源四倍体的诱导[J].植物生理学通讯,2007,43(1):109-111.
[20] 范国强, 曹艳春, 赵振利, 等. 白花泡桐同源四倍体的诱导[J].林业科学,2007,43(4):31-35.
[21] 范国强, 魏真真, 杨志清. 南方泡桐同源四倍体的诱导及其体外植株再生[J].西北农林科技大学学报(自然科学版),2009,37(10): 83-90.
[22] 范国强, 翟晓巧, 魏真真, 等. 豫杂一号泡桐体细胞同源四倍体诱导及其体外植株再生[J].东北林业大学学报,2010,38(12): 22-26.
[23] 赵振利, 何 佳, 赵晓改. 泡桐9501 体外植株再生体系的建立及体细胞同源四倍体诱导[J].河南农业大学学报,2011,45(1): 59-65.
[24] 张延召, 曹喜兵, 翟晓巧, 等. 适用于AFLP分析的泡桐DNA提取方法研究[J].河南农业大学学报,2009,43(6):610-614.
[25] 曹喜兵, 何 佳, 翟晓巧, 等. 泡桐AFLP反应体系的建立及引物筛选[J].河南农业大学学报,2010,44(2):145-150.
[26] 曹喜兵, 赵改丽, 范国强. 泡桐MSAP反应体系的建立[J].河南农业大学学报,2012,46(5):536-541.
[27] 焦 锋, 楼程富, 张有做, 等. 桑树变异株系基因组DNA扩增多态性RAPD研究[J].蚕业科学,2001,27(3):165-169.
[28] 林 强, 邱长玉, 朱方容, 等. 桑树二倍体及其人工诱导同源四倍体遗传差异的RAPD分析[J].南方农业学报,2011,42(1):11-15.
[29] 聂丽娟, 王子成, 王一帆, 等. 二倍体和四倍体西瓜的DNA甲基化差异分析[J].核农学报,2009,23(1):80-84.
[30] Stupar R M, Bhaskar P B, Yandell B S,et al.Phenotypic and transcriptomic changes associated with Potato autopolyploidization [J]. Genetics, 2007,176:2055-2067.
[31] 刘文革, 王 鸣, 阎志红. 西瓜二倍体及同源多倍体遗传差异的AFLP分析[J].果树学报,2004,21(1):46-49.
[32] 王卓伟, 余茂德, 鲁 成. 桑树二倍体及人工诱导的同源四倍体遗传差异的AFLP分析[J].植物学通报,2002,19,(2):194-200.
[34] Finnegan E J, Peacock W J, Dennis E S. DNA methylation,a key regulation of plant development and other processes[J].Curr.Opion. Genet.Develop.,2000,10:217-223.
[35] Martelotto L G, Ortiz J P A, Stein J,et al.A comprehensive analysis of geneexpression alterations in a newly synthesized Paspalum notatum Autotetraploid[J].Plant Sci.,2005,169:211-220.
[36] Martelotto L G, Ortiz J P A, Stein J,et al. Genome rearrangements derived from autopolyploidization inPaspalumsp [J]. Plant Sci., 2007, 172:970-977.
[37] 王新建,张秋娟,谢碧霞,等.泡桐种间杂交遗传值研究[J].经济林研究,2006,24(1):77-80.
[38] 宋 丹,乌云塔娜,包文泉,等.内蒙古野生山杏优良单株果实性状的遗传变异分析[J].经济林研究,2013,31(3):1-9.
[39] 王东娜,牟长城,高 卓,等.胡桃楸天然种群遗传多样性的ISSR分析[J].经济林研究,2011,29(2):22-29.
[40] 文亚峰,韩文军,吴 顺,等.植物遗传多样性及其影响因素[J].中南林业科技大学学报,2010,30(12):80-87.
[41] 王 茜,张冬林,杨模华,等.马尾松优良家系优株ISSR遗传距离分析[J].中南林业科技大学学报,2013,33(12):72-76.
[42] 李芳东,袁德义,莫文娟,等.白花泡桐种源遗传多样性的ISSR分析[J].中南林业科技大学学报,2011,31(7):1-7.
[43] Keyte A L, Percifield R, Liu B,et al.Infraspecific DNA methylation polymorphism in cotton (Gossypium hirsutumL.)[J].Journal of Heredity, 2006,97:444-450.
[44] Chen L Z, Chen J F. Changes of cytosine methylation induced by wide hybridization and allopolyploidy in Cucumis[J].Genome,2008,51: 789-799.
[45] Ochogavia A C, Cervigni G, Selva J P,et al. Variation in cytosine methylation patterns during ploidy level conversions in Eragrostis curvula[J]. Plant mol.Biol., 2009,70:17-29.
[46] Rodriduez M P, Cervigni G D L, Quarin C L,et al.Frequencies and variation in cytosine methylation patterns in diploid and tetraploid cytotypes ofPaspalum notatum[J]. Biologia Plantarum,2012,56:276-282.
Analysis of diploid and its autotetraploid Paulownia tomentosa with AFLP and MSAP
ZHAI Xiao-qiao1,2, ZHANG Xiao-shen2, FAN Guo-qiang2, ZHAO Zhen-li2, CAO Xi-bing2
(1. Henan Academy of Forestry, Zhengzhou 450008, Henan, China; 2. Institute of Paulownia, Henan Agricultutral University, Zhengzhou 450002, Henan, China)
DNA base sequence and DNA methylation of diploid and autotetraploid Paulownia tomentosa seedlings were investigated with amplif i ed fragment length polymorphism (AFLP) and the methylation-sensitive amplif i cation polymorphism (MSAP) respectively.The results show that there was no change of their DNA base sequences between diploid Paulownia tomentosa and its autotetraploid;there were 2 262 and 2 180 sites were detected in the diploid and its autotetraploid by MSAP, and their methylation sites were 35.32%and 38.58% (where fully methylation rate were 12.86% and 14.13%) respectively; DNA methylation and demethylation levels of the autotetraploid Paulownia tomentosa were higher than those of its corresponding diploid, but its total DNA polymorphism was low than the diploid.
Paulownia tomentosa; diploid; autotetraploid; DNA methylation; AFLP; MSAP
S792.43; Q943
A
1673-923X(2014)01-0089-05
2013-08-10
国家自然科学基金项目(U1204309,30271082,30571496);河南省杰出人才计划项目(122101110700)
翟晓巧(1971-),女,河南宜阳人, 研究员,博士,主要从事林木遗传育种与生物技术研究;E-mail:user7117@163.com
范国强(1964-),男,河南禹州人,教授,博士,主要从事泡桐丰产栽培理论与生物技术研究;
E-mail:gqfan@henau.edu.cn
[本文编校:谢荣秀]

