ALOX12基因多态性与糖尿病和糖尿病肾病的相关性研究
李 颀,王 岩,邱一凡,董 玲,陈克林
(大庆油田总医院中心实验室,黑龙江大庆163001)
2 型糖尿病(type 2 diabetes mellitus,T2DM),是一种常见的多因子的代谢病,其发病原因是由环境和遗传因素共同作用。在不同种族人群中,T2DM的发病率都在持续增长,影响到各个年龄段的人群[1-2]。基因学的研究一致认为糖尿病是一个家族性的疾病。虽然目前对糖尿病有较多的全基因组范围关联研究(genome-wide association studies,GWAS),T2DM 的易感基因还是不清楚[3-13]。
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见的微血管并发症。DN引发的终末期肾病(ESRD)已成为威胁糖尿病患者生命的主要原因。DN是造成1型糖尿病和T2DM致死的主要原因[14]。DN的发生发展受环境和遗传因素的协同作用。
ALOX12是脂氧合酶超家族成员之一,在有氧条件下,催化多不饱和脂肪酸底物(包括花生四烯酸和亚油酸)形成氢基二十碳四烯酸(hydroxyeicosatetraenoic acid,HETE)。ALOX12基因位于染色体17p13.1,由14个外显子和13个内含子组成[15-16]。根据该基因的功能推测其与糖尿病的发生有关,这一观点也被研究证实[15,17-18]。在欧美人群中开展的研究已发现ALOX12基因多态性与T2DM易感性之间存在相关性[17],ALOX12基因R261Q位点的突变会显著增加DN蛋白尿症的发病风险[15]。
尽管ALOX12基因与T2DM的关系已有研究,但是关于汉族人群的该基因在T2DM发病风险中的作用至今未见报道。T2DM以及DN在中国人群的发病率中占有很大比例,因此研究ALOX12基因与DN的关系具有十分重要的理论和实践意义。Burdon等[19]研究发现,一种ALOX12基因的编码突变会导致氨基酸261位置上1个精氨酸被谷氨酸替代(Arg261Gln),该位点为 rs1126667,位于ALOX12基因6号外显子上。我们选取这一位点作为研究对象,探讨ALOX12基因多态性与中国汉族人群T2DM肾病易感性关系。
材料和方法
一、对象
采用病例-对照的方法。研究对象共343例,分为病例组和正常对照组。其中病例组为223例T2DM患者,均按照世界卫生组织(WHO)1999年公布的和2003年国际糖尿病专家委员会建议的标准诊断[20]。该组又分为2个亚组:(1)DN组134例,男75例,女59例,DN诊断标准为持续蛋白尿,间隔1个月以上连续测定尿蛋白,尿中白蛋白排泄率>300 mg/24 h,或糖尿病合并肾功能不全,并排除由心脏、肝脏及其他全身疾病引起蛋白尿、原发泌尿系统疾病和应用影响肾功能药物者;(2)T2DM无肾病组89例,男52例,女37例,尿中白蛋白排泄率<30 mg/24 h。正常对照组为120名健康人,男61名,女59名。研究对象均属于东北汉族人群,病例组选自东北地区大庆油田总医院内分泌科住院患者。正常对照组为大庆油田总医院同期健康体检人员120名,无糖尿病、高血压和肾病家族史,在年龄选择上与糖尿病病例组相一致。所有受检者相互间无血缘关系,抽血前签署知情同意书,填写一般资料调查表。
二、DNA 的提取
样本为外周血2 mL。用DNA提取试剂盒(天根生物技术有限公司,TIANamp Genomic DNA Kit)提取 DNA(按说明书操作),DNA保存于-70℃备用。
三、引物设计
从Hapmap数据库上的标签SNP中选择ALOX12基因Arg261Gln上1个位点rs1126667。
根据ALOX12基因的目标序列和所选择的多态性位点,利用Sequenom MassARRAY Assay Design 3.0软件设计这个位点的多重PCR特异性扩增引物和延伸引物。引物序列见表1。

表1 ALOX12基因rs1126667位点引物序列
五、基因分型分析
提取纯化后的基因组DNA样品浓度A260nm/A280nm比值为1.7 ~1.9,按设计顺序加样于384 孔板上,然后加PCR扩增体系使反应物的终浓度如下:Taq聚合酶0.1 U,基因组 DNA 5 ng,PCR 引物 2.5 pmol,dNTP 2.5 mmol。PCR 反应条件:95℃ 15 min,然后45个循环的95℃ 20 s、56℃30 s、72℃ 30 s。剩余的dNTP经添加0.3 U的碱性磷酸酶去除。单碱基延伸反应通过添加5.4 pmol延伸引物,50 μmol dNTP/ddNTP 混合物,0.5 U Thermosequenase DNA 聚合酶,反应条件为94℃ 2 min,然后94℃ 5 s、50 ℃ 5 s、72 ℃5 s 40个循环。反应产物用树脂脱盐20min后经自动点样仪点样于SpectroCHIP(Sequenom)芯片。点样后的芯片用基质辅助激光解吸附电离飞行时间质谱(SpectroREADER,Sequenom)检测。ALOX12基因rs1126667 SNP 3种基因型图谱见图1。

图1 ALOX12 rs1126667位点3种基因型图谱
六、统计学方法
对基因型分布频率进行Hardy-Weinberg平衡检验。采用SPSS 13.0软件进行统计分析,采用Logisitic回归以消除年龄对统计的影响。数据采用SPSS 13.0软件分析和互联网上的 SNPstats(http://bioinfo.iconcologia.net/SNPstats)进行分析[21]。
结 果
一、各组一般临床资料和检测结果比较
正常对照的性别构成与病例组相匹配。正常对照组和DN组性别构成、身高、体重指数(BMI)及胆固醇差异均无统计学意义(P>0.05)。
与正常对照组相比,DN组年龄、体重、血压、尿素氮、空腹血糖、肌酐、甘油三酯、高密度脂蛋白胆固醇及低密度脂蛋白胆固醇差异均有统计学意义(P <0.01、P <0.05);T2DM 无肾病组年龄、体重、舒张压、尿素、空腹血糖、甘油三酯及低密度脂蛋白胆固醇差异均有统计学意义(P<0.01)。见表2。
二、各组ALOX12基因rs1126667位点基因型分析
T2DM组和正常对照组ALOX12基因rs1126667位点的等位基因频率分布见表3。正常对照组和T2DM组等位基因频率差异无统计学意义(P >0.05)。
表2 各组一般情况比较 (±s)
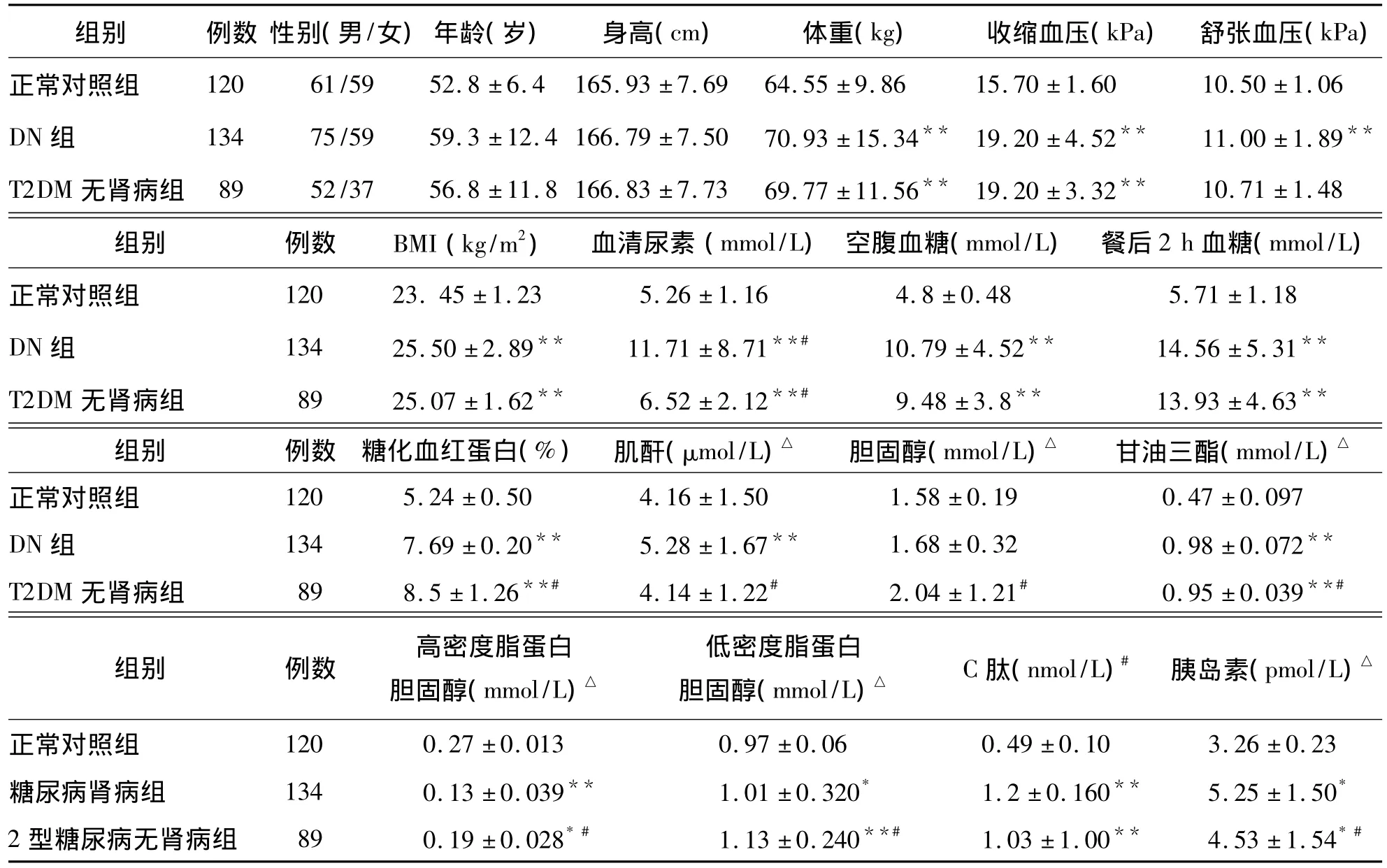
表2 各组一般情况比较 (±s)
注:与正常对照组比较,*P <0.05、**P <0.01;与 DN 组比较,#P <0.01;△表示自然对数
组别 例数 性别(男/女)年龄(岁) 身高(cm) 体重(kg) 收缩血压(kPa) 舒张血压(kPa)正常对照组 120 61/59 52.8 ±6.4 165.93 ±7.69 64.55 ±9.86 15.70 ±1.60 10.50 ±1.06 DN 组 134 75/59 59.3 ±12.4 166.79 ±7.50 70.93 ±15.34** 19.20 ±4.52** 11.00 ±1.89**T2DM 无肾病组 89 52/37 56.8 ±11.8 166.83 ±7.73 69.77 ±11.56** 19.20 ±3.32** 10.71 ±1.48组别 例数 BMI(kg/m2) 血清尿素(mmol/L) 空腹血糖(mmol/L) 餐后2 h血糖(mmol/L)120 23.45 ±1.23 5.26 ±1.16 4.8 ±0.48 5.71 ±1.18 DN 组 134 25.50 ±2.89** 11.71 ±8.71**# 10.79 ±4.52** 14.56 ±5.31**T2DM 无肾病组 89 25.07±1.62** 6.52±2.12**# 9.48±3.8** 13.93±4.63**组别 例数 糖化血红蛋白(%) 肌酐(μmol/L)△ 胆固醇(mmol/L)△ 甘油三酯(mmol/L)正常对照组△正常对照组 120 5.24 ±0.50 4.16 ±1.50 1.58 ±0.19 0.47 ±0.097 DN 组 134 7.69 ±0.20** 5.28 ±1.67** 1.68 ±0.32 0.98 ±0.072**T2DM 无肾病组 89 8.5 ±1.26**# 4.14 ±1.22# 2.04 ±1.21# 0.95 ±0.039**#组别 例数 高密度脂蛋白胆固醇(mmol/L)△低密度脂蛋白胆固醇(mmol/L)△ C肽(nmol/L)# 胰岛素(pmol/L)△正常对照组 120 0.27 ±0.013 0.97 ±0.06 0.49 ±0.10 3.26 ±0.23糖尿病肾病组 134 0.13±0.039** 1.01±0.320* 1.2±0.160** 5.25±1.50*2 型糖尿病无肾病组 89 0.19 ±0.028*# 1.13 ±0.240**# 1.03 ±1.00** 4.53 ±1.54*#
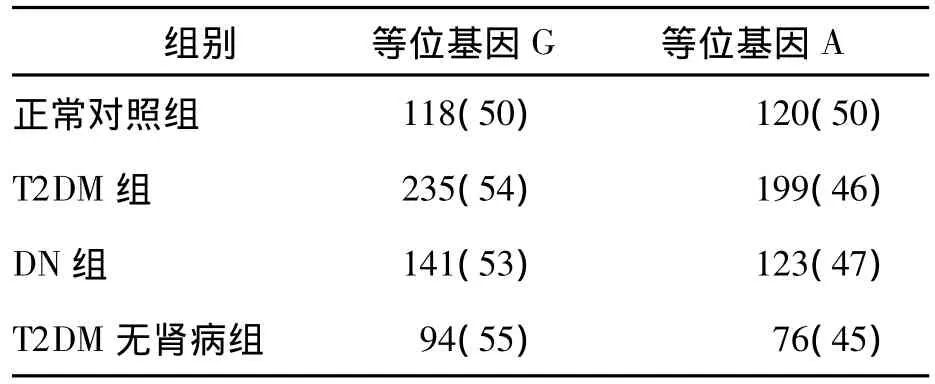
表3 正常对照组与T2DM组rs1126667位点等位基因频率分布 [例(%)]
对ALOX12基因的rs1126667位点行Hardy-Weinberg平衡检验,然后行χ2检验。如果位点在对照组中不符合Hardy-Weinberg平衡,我们通常会怀疑该位点的基因型鉴定的质量;如果该位点在对照组平衡而在病例组出现不平衡,则该位点很可能和疾病有关。T2DM组和正常对照组ALOX12基因rs1126667位点等位基因型频率和Hardy-Weinberg平衡检验结果见表4。结果显示该位点符合Hardy-Weinberg平衡定律,样本基因型检测结果经Hardy-Weinberg遗传平衡定律检验,具有群体代表性(P>0.05)。
三、各组Logistic回归分析
运用广义模型,对rs1126667位点进行Logistic回归分析,对年龄和性别做了校正后,计算相对危险度[OR(95%CI)]。结果显示T2DM组、DN组、T2DM无肾病组与正常对照组之间OR值差异无统计学意义(P>0.05),见表5。T2DM无肾病组与T2DM组差异无统计学意义(P>0.05),结果见表 6。
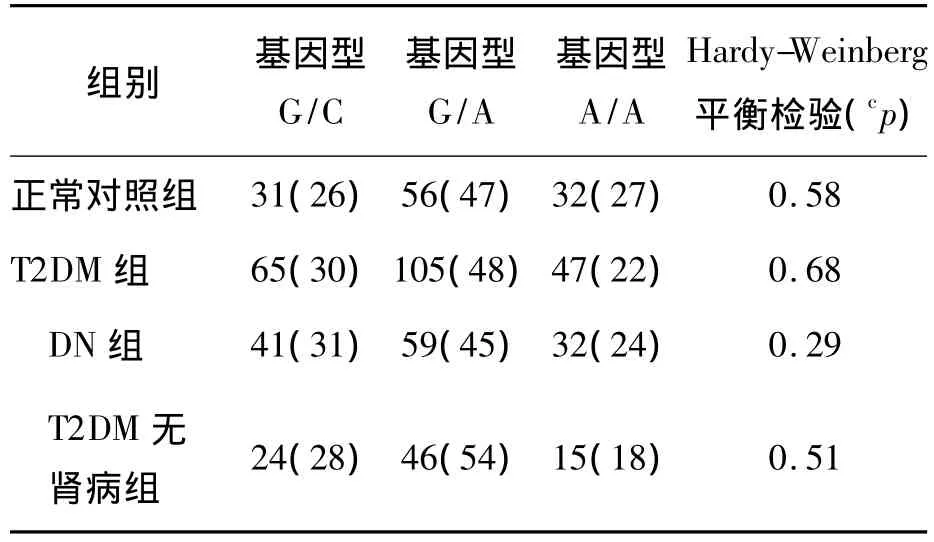
表4 正常对照组与T2DM组rs1126667位点基因型分布 [例(%)]
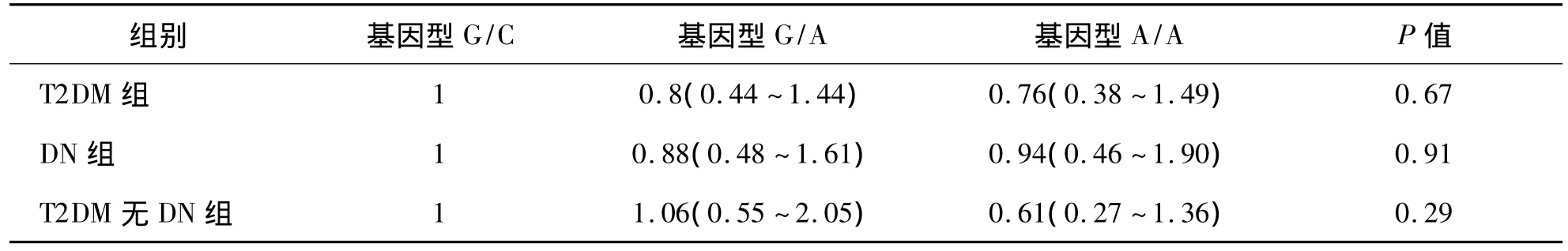
表5 正常对照组与T2DM组rs1126667位点与疾病的相关度(校正年龄和性别) [OR(95%CI)]
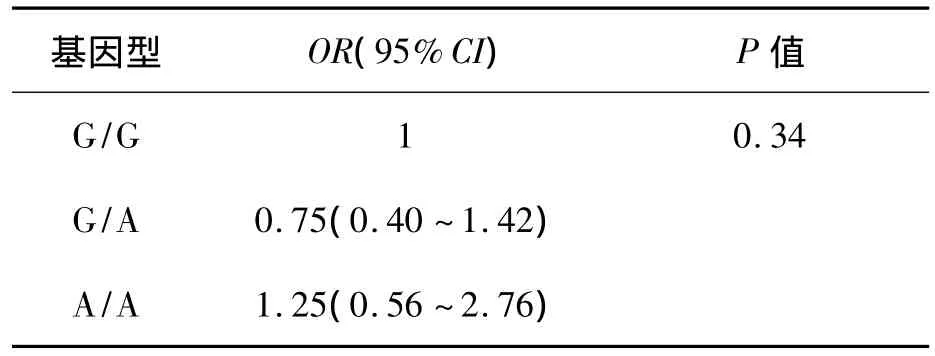
表6 T2DM无肾病组及DN组rs1126667位点与疾病相关度(校正年龄和性别)
讨 论
T2DM是一种具有明显遗传倾向的多基因疾病,其发病机制十分复杂,是由遗传、环境、行为多种因素共同参与、相互作用促成发生的一种多因子代谢病。
ALOX12是脂氧合酶超家族成员之一,在有氧条件下,催化多不饱和脂肪酸底物(包括花生四烯酸和亚油酸)形成氢基二十碳四烯酸(hydroxyeicosatetraenoic acid,HETE)。研究表明,多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)能通过改变细胞膜成分、细胞内钙离子水平以及花生酸产物进而影响调控脂代谢基因的表达,同时PUFAs及其代谢产物还可以通过结合不同的细胞核受体及转录因子影响基因转录。过氧化物酶体增殖物激活受体(peroxisome proliferatoractivated receptor,PPAR)是一种细胞核受体,已知有3种类型。已经被证实能够与PUFAs及其代谢产物相互作用,并在调控脂代谢相关基因表达中起重要作用[22]。其中过氧化物酶体增殖物激活受体γ(PPAR-γ)是重要的条件脂联素和胰岛素敏感、脂肪酸代谢的调节因子,在脂肪细胞分化、肥胖易感性和胰岛素抵抗中起重要的作用[18,23]。与其功能相近的基因在此方面已经有类似的研究[24-25]。根据该基因的功能推测其与糖尿病的发生有关,这一观点也被研究证实。在欧美人群中开展的研究已发现ALOX12基因多态性与 T2DM易感性之间存在相关性[17],ALOX12基因Arg261Gln位点的突变会显著增加DN蛋白尿症的发病风险,其多态性与欧美人群DN的发病机理密切相关[15]。
ALOX12基因位于染色体17p13.1,由14个外显子和 13 个内含子组成[15]。Burdon 等[19]研究发现,一种 ALOX12基因的编码,位点为rs1126667,位于ALOX12基因6号外显子上,当G转换成A时,会导致氨基酸261位置上1个精氨酸被谷氨酸替代(Arg261Gln)。本实验选取这一位点作为研究对象,探讨ALOX12基因多态性与中国汉族人群T2DM肾病易感性关系。
ALOX12基因与DN的关系已经在动物模型实验以及人体实验中被证实。动物模型中一系列研究数据表明,脂氧合酶12(12-lipoxygenase,12LO)与高血糖症引起的肾病密切相关[26]。当小鼠肾小球系膜细胞和肾小囊脏层细胞置于高浓度葡萄糖溶液环境中,12LO mRNA转录水平和蛋白水平含量激增。激增的12LO和HETE能够诱导肾脏组织细胞肥大以及肾小球系膜细胞外纤连蛋白的表达[26-28]。而DN与肾小球系膜细胞的增厚、肾小球细胞的肥大以及肾小球系膜细胞外基质的沉积有关[14]。由此推测12LO与DN的发生有关。人体中的花生四烯酸 12-脂氧合酶ALOX12和动物的12LO结构功能相似,可能参与DN的致病机理。Meirhaeghe等[23]研究证实在不同种族人群 PPAR-γ基因多态性(最常见为Pro12Ala)与T2DM易感性相关。而ALOX12的催化底物(花生四烯酸、亚油酸)及其催化产物是PPAR内源性配体,由此推测 ALOX12基因与T2DM的发病有关。Liu等[15]在研究ALOX12与T2DM蛋白尿症的血糖控制关系中发现,ALOX12基因p.Arg261Gln位点的突变会显著增加糖尿病肾病蛋白尿症的发病风险;ALOX12基因多态性与欧美人群的DN发病机理关系密切。然而该位点的突变与DN的确切关系还需要进一步的实验证明。
本研究探讨了东北汉族人群中ALOX12基因的rs1126667位点多态性与T2DM和DN的关联性。研究发现该基因的rs1126667位点多态性和T2DM及DN不相关。而Kasinath等[29]在欧美人群中的研究中发现,ALOX12基因多态性与T2DM存在相关性。这种不一致性可能是由于种群与地理位置不同造成。不同地区的人种群具有不同的发展历史。所以采用不同的人群进行研究,得到的结果可能不同。另外,对于ALOX12基因多态性与糖尿病的相关性研究主要集中在 rs1126667位点,可能也会出现在其它位点对该基因与疾病相关性的研究。后续研究中需要扩大该基因的研究位点,同时可选取更大的范围,扩大样本数量进行进一步研究。
[1]Burke JP,Williams K,Gaskill SP,et al.Rapid rise in the incidence of type 2 diabetes from 1987 to 1996:results from the San Antonio Heart Study[J].Arch Intern Med,1999,159(13):1450-1456.
[2]Harris MI,Flegal KM,Cowie CC,et al.Prevalence of diabetes,impaired fasting glucose,and impaired glucose tolerance in U.S.adults:the Third National Health and Nutrition Examination Survey,1988-1994[J].Diabetes Care,1998,21(4):518-524.
[3]Busfield F,Duffy DL,Kesting JB,et al.A genomewide search for type 2 diabetes-susceptibility genes in indigenous Australians[J].Am J Hum Genet,2002,70(2):349-357.
[4]Francke S,Manraj M,Lacquemant C,et al.A genome-wide scan for coronary heart disease suggests in Indo-Mauritians a susceptibility locus on chromosome 16p13 and replicates linkage with the metabolic syndrome on 3q27[J].Hum Mol Genet,2001,10(24):2751-2765.
[5]Frayling TM,Lindgren CM,Chevre JC,et al.A genome-wide scan in families with maturity-onset diabetes of the young:evidence for further genetic heterogeneity[J].Diabetes,2003,52(3):872-881.
[6]Hsueh WC,St Jean PL,Mitchell BD,et al.Genome-wide and fine-mapping linkage studies of type 2 diabetes and glucose traits in the Old Order Amish:evidence for a new diabetes locus on chromosome 14q11 and confirmation of a locus on chromosome 1q21-q24[J].Diabetes,2003,52(2):550-557.
[7]Imperatore G,Hanson RL,Pettitt DJ,et al.Sib-pair linkage analysis for susceptibility genes for microvascular complications among Pima Indians with type 2 diabetes:Pima Diabetes Genes Group[J].Diabetes,1998,47(5):821-830.
[8]Iwasaki N,Cox NJ,Wang YQ,et al.Mapping genes influencing type 2 diabetes risk and BMI in Japanese subjects[J].Diabetes,2003,52(1):209-213.
[9]Lindgren CM,Mahtani MM,Widén E,et al.Genomewide search for type 2 diabetes mellitus susceptibility loci in Finnish families:the Botnia study[J].Am J Hum Genet,2002,70(2):509-516.
[10]Martin LJ,Comuzzie AG,Dupont S,et al.A quantitative trait locus influencing type 2 diabetes susceptibility maps to a region on 5q in an extended French family[J].Diabetes,2002,51(12):3568-3572.
[11]Mori Y,Otabe S,Dina C,et al.Genome-wide search for type 2 diabetes in Japanese affected sibpairs confirms susceptibility genes on 3q,15q,and 20q and identifies two new candidate Loci on 7p and 11p[J].Diabetes,2002,51(4):1247-1255.
[12]Stern MP.The search for type 2 diabetes susceptibility genes using whole-genome scans:an epidemiologist's perspective[J].Diabetes Metab Res Rev,2002,18(2):106-113.
[13]Watanabe RM,Ghosh S,Langefeld CD,et al.The Finland-United States investigation of non-insulindependent diabetes mellitus genetics(FUSION)study:Ⅱ.An autosomal genome scan for diabetesrelated quantitative-trait loci[J].Am J Hum Genet,2000,67(5):1186-1200.
[14]Parving H,Osterby R,Anderson PW,et al.Diabetic nephropathy[C].Philadelphia,Brenner BM(ed):Saunders,1996:1864-1892.
[15]Liu Y,Freedman BI,Burdon KP,et al.Association of arachidonate 12-lipoxygenase genotype variation glycemic control with albuminuria in type 2 diabetes[J].Am J Kidney Dis,2008,52(2):242-250.
[16]Weisinger G,Grafi-Cohen M,Hirsh M,et al.12SLipoxygenase is necessary for human vascular smooth muscle cell survival[J].Exp Cell Res,2013,319(10):1586-1593.
[17]Fridman C,Ojopi EP,Gregório SP,et al.Association of a new polymorphism in ALOX12 gene with bipolar disorder[J]. Eur Arch Psychiatry Clin Neurosci,2003,253(1):40-43.
[18]Kuliczkowska J,Filus A,Trzmiel A,et al.PPAR-gamam2 Pro12Ala polymorphism in the population of obese and non-obese men of the city of Wroclaw[J].Endokrynol Pol,2008,59(4):312-15.
[19]Burdon KP,Rudock ME,Lehtinen AB,et al.Human lipoxygenase pathway gene variation and association with markers of subclinical anthorosclerosclerosis in the diabetes heaart study[M].New York:Hindawi Publishing Corporation,2010:1-9.
[20]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010年版)[M].北京:北京大学医学出版社,2011:5-8.
[21]Solé X,Guinó E,Valls J,et al.SNP Stats:a web tool for the analysis of association studies[J].Bioinformatics,2006,22(15):1928-1929.
[22]Sampath H,Ntambi JM.Polyunsaturated fatty acid regulation of genes of lipid metabolism[J].Annu Rev Nutr,2005,25:317-340.
[23]Meirhaeghe A,Amouyel P.Impact of genetic variation of PPARgamma in humams[J].Mol Genet Metab,2004,83(1-2):93-102.
[24]刘国政,晏文强,刘 双,等.TCF7 L2基因rs7903146多态性与2型糖尿病的相关性研究[J].检验医学,2012,127(7):549-553.
[25]郭 翀,杨慧英,徐玉善,等.脂联素与2型糖尿病及糖尿病早期肾病的相关性分析[J].检验医学,2011,26(7):482-483.
[26]Lechner D,Lathrop GM,Gut IG,et al.Large-scale genotyping by mass spectrometry:experience,advances and obstacles[J].Curr Opin Chem Biol,2002,6(1):31-38.
[27]Jurinke C,van den Boom D,Cantor CR,et al.The use of Mass ARRAY technology for high throughput genotyping[J].Adv Biochem Eng Biotechnol,2002,77:57-74.
[28]Dronavalli S,Duka I,Bakris GL.The pathogenesis of diabetic nephropathy[J].Nat Clin Pract Endocrinol Metab,2008,4(8):444-452.
[29]Kasinath BS.Lipoxygenases in renal injury--loading the matrix[J].Kidney Int,2003,64(5):1918-1919.

