CaCl2对NaCl胁迫下酸枣幼苗抗氧化酶活性和膜脂过氧化作用的影响
王策,鲁晓燕,樊新民,石国亮,杨双双
(石河子大学农学院,石河子 832003)
我国为世界盐碱地大国之一,其盐渍土面积为3630.53×104hm2,占全国可利用土地4.88%,已成为限制农业发展的一个重要因素[1]。
枣(Ziziphus jujube Mill)是我国的第一大干果树种,作为世界上最大的枣生产国和唯一的枣产品出口国,枣果及其加工品是我国最有国际竞争力的农副产品之一[2]。 酸枣(Zizyphus spinosus Hu)作为枣的优良砧木,具有抗干旱、耐盐碱的特性,是开发利用沙荒地、盐碱地的优良经济树种[2]。我国共有枣和酸枣品种730个,枣树业正呈现出新的发展趋势[3]。适度的盐分是优质枣果生产的有利环境因子,但是酸枣树抗盐碱能力不是无限的,新疆调查中发现很多枣园由于土壤含盐过高,酸枣缺苗问题严重;叶片和新梢生长减少,不能形成木质化而无法越冬[4]。枣树栽培中的盐碱胁迫,影响着这项产业的健康发展。因此,探索枣的耐盐机制和改善枣树的耐盐性具有一定的理论价值和现实意义。
钙是植物必需的矿质营养元素之一,对于维持细胞壁、细胞膜及膜结合蛋白的稳定性,调节无机离子运输起重要作用[5]。钙信使系统参与植物对非生物逆境的应答反应已被广泛证实。植物可通过Ca2+与CaM结合调节一些蛋白或酶活性而引发有利于自身适应逆境的生理生化反应[6]。研究发现,钙盐在对于拟南芥[7]、小麦[8]、水稻[9]、番茄[10]、黄瓜[11]以及苹果[12]等植物在遭受盐胁迫时能起到有效的缓解作用。枣的耐盐性研究较少,徐呈祥等[13]报道土壤施硅可缓解盐离子对金丝小枣光合作用的抑制与伤害[13-14],改善盐胁迫下金丝小枣叶片中盐分离子的平衡及微域分布。潘贤良等[15]曾探究过酸枣种子在Na2SO4胁迫下的萌发及根系生长的情况。但国内外对施钙或钙对酸枣耐盐性影响的鲜有报道。
本实验以酸枣幼苗为试材,研究了外源CaCl2对NaCl胁迫下酸枣幼苗叶片和根系中相对电导率、SOD、POD和CAT活性以及MDA含量的影响,探索CaCl2缓解酸枣盐胁迫的效应与可能的作用方式,为盐碱地上发展枣果业提供新的参考依据。
1 材料与方法
1.1 材料
试验于2013年3-4月进行,选取饱满一致的种子浸种催芽后育苗,待子叶展平后浇1/2剂量的园试配方营养液,第2片真叶展开后挑选整齐一致的幼苗定植到1倍剂量的园试配方的营养液中进行水培。水培盒大小为20 cm×13 cm×12 cm,每个水培盒加营养液500 mL,每3 d更换1次营养液,期间水分的蒸发量以蒸馏水补足,定植培养20 d后进行试验预处理。
试验设以下4个处理:
(1)CK,园试配方营养液;
(2)Ca 处理,园试配方营养液+10mmol/L CaCl2;
(3)Na处理,园试配方营养液+200 mmol/L NaCl;
(4)Na+Ca处理,园试配方营养液+200 mmol/L NaCl+10 mmol/L CaCl2。
( 来源:国家统计局 2018-08-24 http://www.stats.gov.cn/tjsj/sjjd/201808/t20180824_1618769.html )
其中Na处理和Na+Ca处理提前用100 mmol/L NaCl预处理3 d,以防止植物盐激反应。
每个水培盒定植酸枣10株,每个处理3次重复,水培盒随机排列。
1.2 方法
试验于处理后第 2、4、6、8、10 天(4 月 8 日、10日、12日、14日、16日)5次取样,分别取幼苗地上部和地下部,用蒸馏水冲洗干净,擦干水分后,分别称鲜样质量,测定各项指标。
质膜透性的测定采用相对电导率法[16];超氧化物歧化酶(SOD)活性测定采用NBT法[17];过氧化物酶(POD)活性测定采用愈创木酚法[17];过氧化氢酶(CAT)活性测定采用过氧化氢法[17];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[16]。
采用SPSS 17.0软件的 Duncan′s多重比较法(P<0.05)对所得实验数据进行统计分析。
2 结果与分析
2.1 CaCl2对NaCl胁迫下酸枣幼苗细胞质膜透性的影响
由图1可知:随着处理时间延长,各处理的组织电导率都出现不同程度的增加。在酸枣叶片中(图1a),Na处理的电导率始终显著高于其他3组处理,在第8天Na处理的电导率是CK的2.4倍,Ca处理后的电导率与CK无显著差异。Na+Ca处理的酸枣叶片电导率显著低于Na处理,第2、4、6、8天的降幅分别是 15.8%、21.9%、26.2%、22%,酸枣根系(图1b)的电导率变化波动较叶片缓和,但4组处理间始终存在显著性差异,Na处理一直处于最高水平且在第6天比CK高66%,Na+Ca处理的酸枣根系电导率低于Na处理,第2、4、6、8天的降幅分别是 10.6%、16.4%、16%、13.5%。
由此可见,NaCl胁迫会造成酸枣幼苗电解质外渗,并随着时间延长逐渐加重,增施外源CaCl2可以缓解NaCl胁迫对酸枣叶片和根系的质膜的伤害。
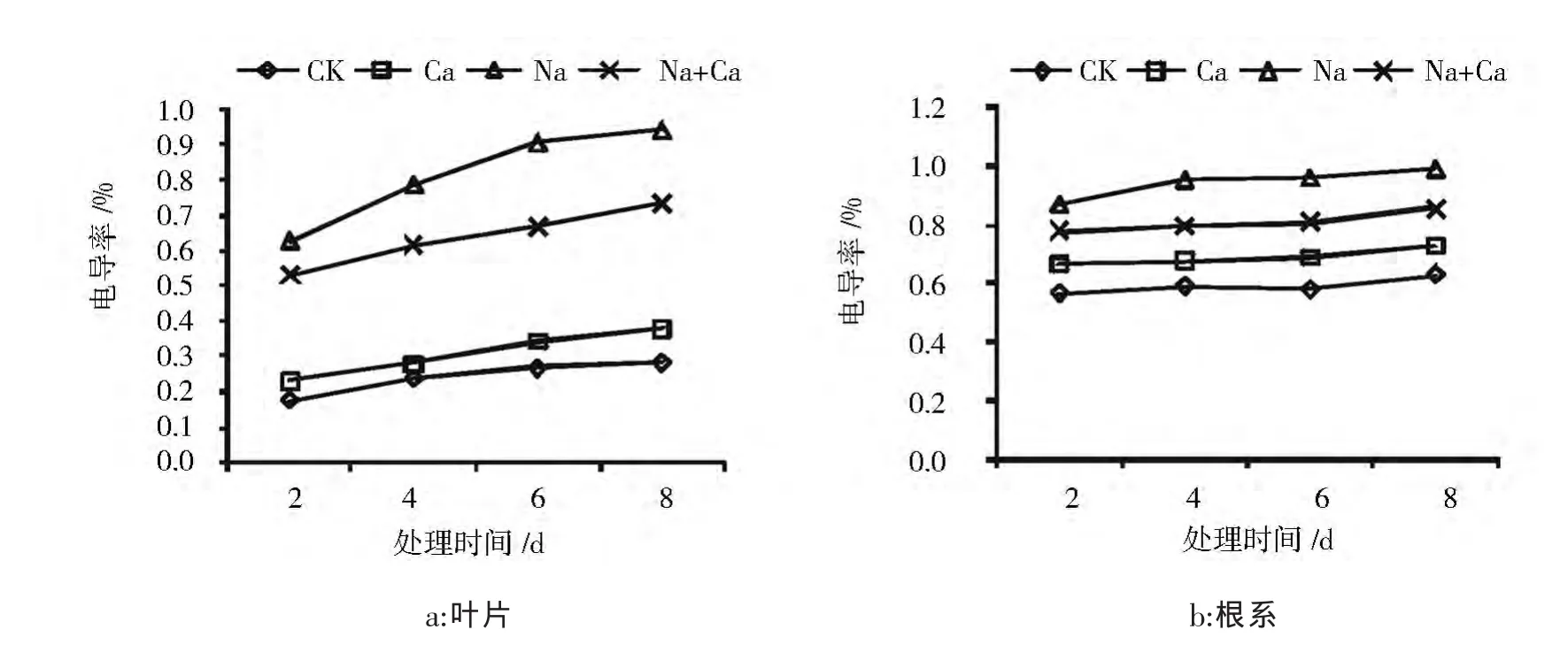
图1 CaCl2对NaCl胁迫下酸枣幼苗叶片和根系电导率的影响Fig.1 Effects of CaCl2 on electrical conductivity in leaves and roots of Sour jujube seed lings under NaCl stress
2.2 CaCl2对NaCl胁迫下酸枣幼苗抗氧化酶系统的影响
2.2.1 CaCl2对NaCl胁迫下酸枣幼苗SOD活性影响
结果如图2所示,由图2可见:
在酸枣叶片中 (图2a),Na处理和Ca处理的SOD活性整体较CK低,第10天Na处理显著低于CK,降幅达24.2%,其它3组间无显著性差异。Na+Ca处理有效提高了SOD活性,使得SOD活性始终显著高于 Na 处理,第 2、4、6、8、10 天的增幅分别是54.3%、51.5%、36%、21%、41.8%。
在酸枣根系(图2b)处理后的第2天和第4天,各处理之间SOD活性无明显差异,处理第6天各处理SOD活性都高于对照,Na处理和Na+Ca处理达到最大值,Na处理比CK高59.3%,Na+Ca处理比Na处理提高20.2%,然后开始下降。其它3组之间无显著性差异。
上述分析表明:NaCl处理后,根系SOD的反应比叶片迅速;CaCl2能有效提高NaCl胁迫下酸枣幼苗叶片和根系的SOD活性。但是第10天Na+Ca处理显著降低。
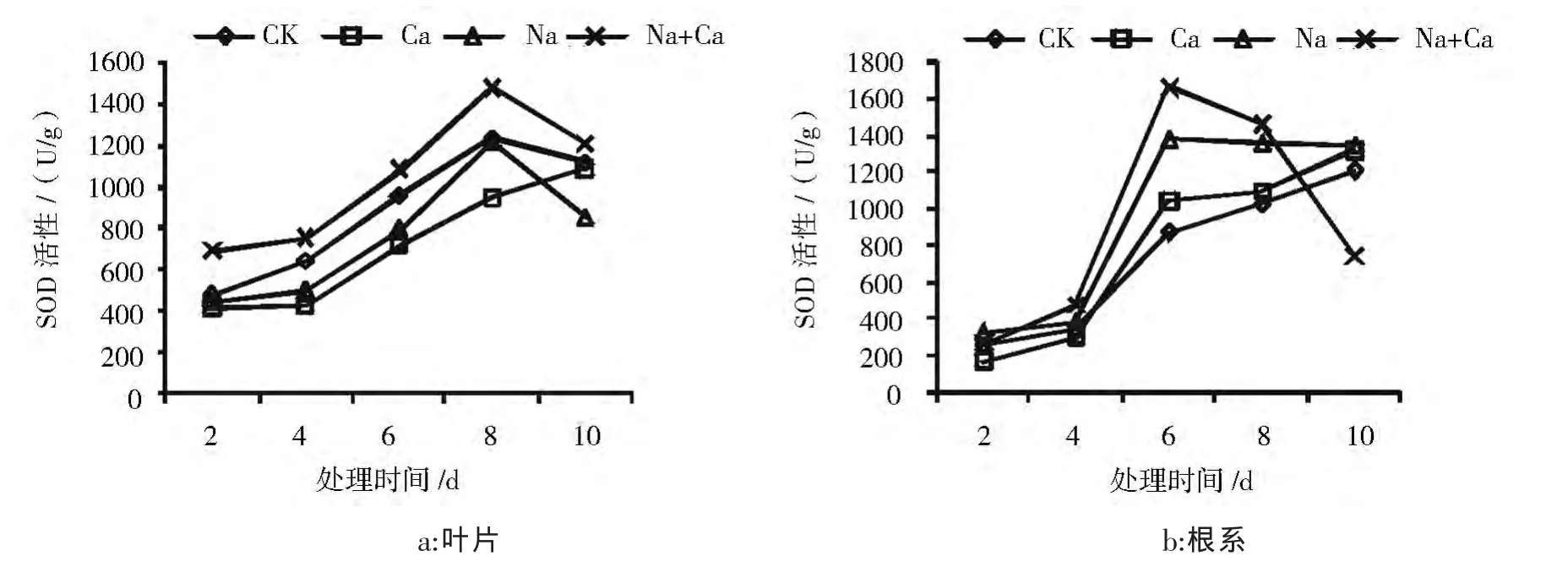
图2 CaCl2对NaCl胁迫下酸枣幼苗叶片和根系SOD活性的影响Fig.2 Effects of calcium on SOD CaCl2 in leaves and roots of Sour jujube seedlings under NaCl stress
2.2.2 CaCl2对NaCl胁迫下酸枣幼苗POD活性影响
结果如图3所示,由图3可见:
在叶片中 (图3a),Ca处理的POD活性与CK间没有显著性差异,Na处理从第2-8天POD活性均显著高于CK,第8天比CK高1.6倍,然后开始下降;Na+Ca处理POD活性始终高于Na处理,且在第8天和第10天有显著性差异,分别比Na处理高45.4%和141.5%。
在根系中(图3b),Na处理的POD活性从第2-8天均高于CK,在第10天显著降低,Na+Ca处理的POD活性始终显著高于Na处理,在第8天最为显著,高出对照58.6%,第10天回落至对照水平。
上述分析表明:在高NaCl环境下,CaCl2可有效提高NaCl胁迫下酸枣幼苗叶片和根系POD活性。
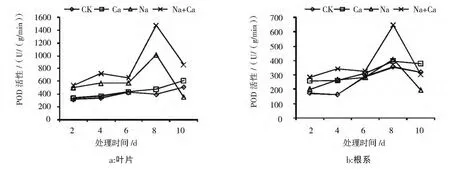
图3 CaCl2对NaCl胁迫下酸枣幼苗叶片和根系POD活性的影响Fig.3 Effects of CaCl2 on POD activity in leaves and roots of Sour jujube seedlings under NaCl stress
2.2.3 CaCl2钙对NaCl胁迫下酸枣幼苗CAT活性影响
结果见图4,由图4可见:
随着时间的延长,酸枣幼苗叶片(图4a)各处理CAT活性均呈先升高后降低趋势,且在第8天达到最大值。在处理后第2-6天,各处理间并无明显差异,第8天各处理达到最大值且有显著性差异,Na处理比 CK低 66.8%,Na+Ca处理比 Na处理高56.8%,第10天Na处理急速下降至最低。
在酸枣根系(图4b)中,各处理整体呈现上升趋势,第6天后,Ca处理与CK间再无显著性差异,Na+Ca处理开始显著高于Na处理,第8天Na+Ca比Na处理高1.49倍,第10天Na处理比CK高79.1%。此时根系所得结果与叶片相反,可能是根系对盐环境耐受能力强,所以仍然具有调节能力。
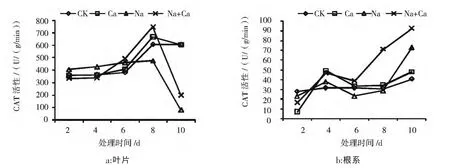
图4 CaCl2对NaCl胁迫下酸枣幼苗叶片和根系CAT活性的影响Fig.4 Effects of CaCl2 on CAT activity in leaves and roots of Sour jujube seedlings under NaCl stress
2.3 CaCl2对盐胁迫下酸枣幼苗MDA含量的影响
结果如图5所示,由图5可见:
酸枣叶片的MDA含量随着胁迫时间的延长而增加,Na处理始终处于最高水平且显著高于其它3组处理,在第10天比CK高2.1倍,加入外源Ca2+后MDA含量显著降低,且在第8天Na+Ca处理与Na处理差异显著,第 2、4、6、8、10 天的降幅分别是25%、40.8%、44.9%、54.7%、29%。
在酸枣根系中,Na处理MDA含量始终处于最高水平并在第6天比CK高1.3倍,Na+Ca处理的MDA 含量始终低于 NaCl处理,第 2、4、6、8、10 天的降幅分别是 4%、13.7%、21.2%、43.2%、23.8%, 且在后3次达到显著性水平,差异最明显发生在第8天,为76.2%。
上述分析说明:加入外源CaCl2可有效降低酸枣幼苗由于膜脂过氧化而造成的MDA积累。
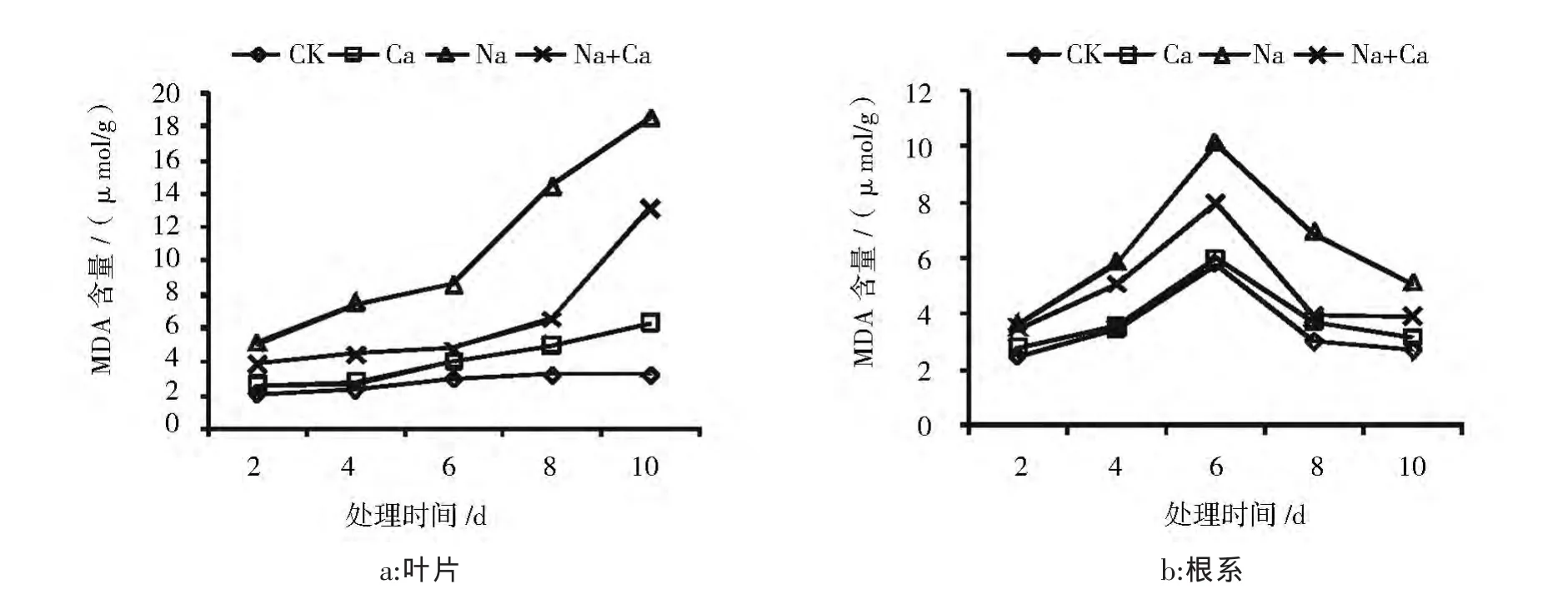
图5 CaCl2对NaCl胁迫下酸枣幼苗叶片和根系MDA含量的影响Fig.5 Effects of CaCl2 on MDA contents in leaves and roots of Sour jujube seedlings under NaCl stress
3 讨论
细胞膜是盐胁迫对植物伤害的原初部位,若植物在盐胁迫下仍能保持膜系统的完整性,则可以维持对离子的选择性吸收和其它功能。MDA是膜脂过氧化的末端产物,其含量高低是判断膜脂过氧化程度的重要指标[18-19],电解质渗漏率是反映细胞膜受伤害程度的直接指标。本实验结果表明,CaCl2处理对正常生长酸枣幼苗电导率无明显影响,但明显降低了盐胁迫下酸枣叶片和根系的电解质渗漏率和MDA含量。其原因可能是钙将膜表面的磷酸盐和磷酸脂以及蛋白质的羟基桥连起来,从而维持了盐胁迫下细胞质膜、叶绿体膜和液泡膜的稳定性[9,20]。
酶促防御系统是植物对膜脂过氧化的重要防御系统,包括SOD、CAT、POD。本实验结果表明,随着NaCl胁迫的进行,叶片酶活性都呈现先升后降的变化趋势,说明胁迫初期,幼苗可通过自身的调节机制,提高SOD、POD和CAT的活性,以适应环境胁迫;随着NaCl胁迫时间的延长,内源抗氧化酶系统清除活性氧、防止膜脂过氧化作用能力的下降,使幼苗受到伤害。根系SOD和CAT不同于叶片,即使在胁迫后期酶活性仍高于对照,说明根系仍具自身的调节能力,这可能是酸枣根系比叶片有着更好的耐盐性。
植物在受到盐胁迫时,由SOD催化O2-·发生歧化反应进而解除其毒性伤害,而CAT、POD则使歧化反应过程中所产生的H2O2转变为活性较低的物质[21],使膜脂不致发生过氧化作用而得到保护,关军锋等[22]研究表明,苹果果实POD活性及其分泌可能受细胞内的Ca2+和CaM所调控,100 mmol/L Ca2+可明显提高POD活性和促进POD分泌。刘娥娥等[23]和宗会等[24]研究发现,Ca2+对植物的保护作用可能机理是Ca2+与CaM结合活化了SOD等保护酶的活性,使O2-·、OH-等自由基转变为活性较低的物质,降低或消除了其对膜脂的攻击能力,从而减轻膜脂过氧化对植物细胞的伤害。本实验中,加入外源CaCl2后,酸枣叶片中的3种酶及根系中的POD和CAT活性均得到了不同程度的提高,这说明适量的CaCl2较好地诱导了植物保护酶活性的上升。但施入外源CaCl2后,根系内POD和SOD活性在后期降低,这可能是因为经过长时间胁迫处理,酶活性已升至极限,外源钙的缓解能力已经完全发挥,不再继续活化保护酶,所以酶活反而降低。
4 结论
NaCl胁迫下酸枣幼苗酶促防御系统机能降低,膜脂过氧化产物MDA积累增加,细胞质膜的透性增加。施入外源CaCl2可以提高酶促防御系统的机能,降低MDA的含量及细胞质膜的渗透率。总体来说,外施CaCl2可以缓解因NaCl对酸枣幼苗造成的胁迫。
[1]王遵亲.中国盐碱土[M].北京:科学出版社,1993:400-515.
[2]刘孟军,汪民.中国枣种质资源[M].北京:中国林业出版社,2009:41-45.
[3]王依,鲁晓燕,牛建新,等,新疆枣不同品种果实和果核形状的比较[J].石河子大学学报:自然科学版,2013,31(1):24-29.
[4]鲁晓燕,张红宇,王禾,等,新疆枣树直播建园栽培管理技术[J].北方园艺,2011(8):71-72.
[5]戴高兴,彭克勤,皮灿辉.钙对植物耐盐性的影响[J].中国农学通报,2003,19(3):97-101.
[6]宗会,李明启.钙信使在植物适应非生物逆境中的作用[J].植物生理学讯,2001,37(4):330-335
[7]马淑英,赵明.钙对拟南芥耐盐性的调节[J].作物学报,2006,32(11):1706-1711.
[8]Xue Y F,Liu L,Liu Z P.Protective role of Ca against NaCl toxicity in Jerusalem artichoke by up-regulation of antioxidan tenzymes[J].Pedosphere,2008,18:766-7741.
[9]朱晓军,杨劲松,梁永超,等.盐胁迫下钙对水稻幼苗光合作用及相关生理特性的影响[J].中国农业科学,2004,37(10):1497-1503.
[10]杨凤军,李天来,臧忠婧,等.外源钙施用时期对缓解盐胁迫番茄幼苗伤害的作用[J].中国农业科学,2010,43(6):1181-1188.
[11]韩冰,孙锦,郭世荣,等.钙对盐胁迫下黄瓜幼苗抗氧化系统的影响[J].园艺学报,2010,37(12):1937-1943.
[12]梁国庆.孙静文,周卫,等.钙对苹果果实超氧化物歧化酶、过氧化氢酶活性及其基因表达的影响[J].植物营养与肥料学报2011,17(2):438-444.
[13]徐呈祥,徐锡增.硅对盐胁迫下金丝小枣叶绿素荧光参数和气体交换的影响[J].南京林业大学学报:自然科学版,2005,29(1):25-28.
[14]徐呈祥,徐锡增.Si对NaCl胁迫下金丝小枣叶片中矿质元素微域分布的影响[J].果树学报,2010,27(3):355-362.
[15]潘贤良,鲁晓燕,王策,等.Na2SO4胁迫对酸枣种子萌发及根系生长的影响 [J].石河子大学学报:自然科学版,2013,31(1):14-17.
[16]邹绮.植物生理学实验指导[M].北京:中国农业出版社,2000.
[17]李合生.植物生理生化原理和技术[M].武汉:华中农业大学出版社,2000.
[18]Liang Y C,Hu F,Yang M C,et al.Antioxidative defenses and water deficit induced oxidative damage in rice(Oryza sativa L.)growing on non-flooded paddy soils with ground mulching[J].Plant and Soil,2003,257:407~416
[19]陈华新,李卫军,安沙舟,等.钙对NaCl胁迫下杂交酸模幼苗叶片光抑制的减轻作用[M].植物生理与分子生物学学报,2003,29(5):449-454.
[20]韩广泉,李俊,宋曼曼,等.硒对盐胁迫下加工番茄种子萌发及抗氧化酶系统的影响[J].石河子大学学报:自然科学版,2012,28(4):422-426.
[21]陈华新,李卫军,安沙舟,等.钙对NaCl胁迫下杂交酸模幼苗叶片光抑制的减轻作用[J].植物生理与分子生物学学报,2003,29(5):449-454.
[22]关军锋,李广敏,李滨,等.Ca2+对苹果果实过氧化物活性及其分泌的影响[J].华北农学报,2004,19(1):79-81
[23]刘娥娥,宗会,郭振飞,等.盐胁迫下LaCl3和CPZ对稻苗抗氧化酶类活性的影响[M].作物学报,2002,28(1):42-46.
[24]宗会,胡文玉.钙信使系统在苹果果肉圆片衰老中的作用[J].植物生理学通讯,2000,36(4):305-307.
