分枝杆菌噬菌体Leo的生物学和基因组学特征*
江莉莎, 邬亭亭, 刘 平, 郭述良△
1重庆医科大学附属第一医院呼吸与危重症医学科,重庆 400016
2成都市第三人民医院呼吸内科,成都 610031
3重庆市长寿区人民医院呼吸内科,重庆 401220
多重耐药结核分枝杆菌(MDR-TB)以及泛耐药结核分枝杆菌(XDR-TB)的增多,使探索结核病治疗的新方法变得尤为重要。早在二十世纪三十年代,噬菌体就开始应用于细菌感染的治疗,后因抗生素的使用而被逐步取代。噬菌体D29也已成功应用于结核病的诊断和治疗[1-2]。但是细菌对噬菌体快速耐药变异,使噬菌体疗法面临巨大挑战。单一噬菌体应用易使细菌对噬菌体产生抗性,而筛选多种噬菌体组成“鸡尾酒制剂”,能够一定程度上减少耐药变异的产生[3]。再者,由于抗生素与噬菌体的耐药机制不同,如果将两者同时应用,也会大大减少耐药突变株的产生[4]。因此,筛选能有效裂解结核分支杆菌的噬菌体,制成鸡尾酒制剂,并与抗生素联合应用将成为结核病治疗的新思路。本课题组对噬菌体Leo进行了初步研究,发现它能裂解敏感和耐药的结核分枝杆菌临床分离株,其噬菌斑透明清晰,呈裂解性噬菌体的特点。为进一步了解噬菌体Leo的遗传背景,明确其能否应用于鸡尾酒疗法,遂对其进行基因测序及生物信息学分析。
1 材料与方法
1.1 菌株和噬菌体
耻 垢 分 枝 杆 菌 (Mycobacterium smegmatis,MS)mc2155(CMCC 93202)由中国药品生物制品检定所王国治教授馈赠。结核分枝杆菌标准株H37Rv(CMCC 93004)购自重庆市肺科医院,结核分枝杆菌临床分离株由本院结核患者痰中分离并保存,采用罗氏药敏培养液(珠海贝索公司)进行菌种和药敏检测,噬菌体Leo由加拿大拉瓦尔大学 Félix d’Hérelle噬菌体中心提供。
1.2 噬菌体Leo制备
取10μL Leo噬菌体液与100μL耻垢分枝杆菌混合,静置15min后加入3mL 7H9半固体培养基(BD,美国)混匀后倾倒于已制备的7H10固体培养基(BD,美国)平皿上,37℃倒置培养[5]。次日观察噬菌斑形态及透明度。
1.3 电镜观察
取20μL噬菌体液滴于铜网上,待噬菌体自然沉降15min后,加入20μL 2%磷钨酸于铜网上,染色10min,滤纸吸取多余染液,自然干燥后电镜观察噬菌体形态。
1.4 噬菌体Leo宿主谱
采用单斑法[6]测定噬菌体的宿主谱,宿主菌为分支杆菌临床分离株32株、结核分枝杆菌标准株H37Rv,步骤如下。将稀释的各宿主菌分别制成均匀的菌苔。将噬菌体样液(滴度:1×109pfu/mL)10 μL滴加到菌苔上,待完全晾干后放入37℃孵箱培养,连续6周观察结果。以耻垢分枝杆菌为阳性对照,出现噬菌斑者为阳性,6周以后还未出现噬菌斑者判为阴性。
1.5 噬菌体Leo全基因组序列测定
采用λ噬菌体提取试剂盒(北京艾比根公司)提取噬菌体Leo的DNA,参照说明书操作。噬菌体Leo测序按鸟枪法原理在北京六合华大基因科技股份有 限 公 司 完 成,DNA 序 列 用 Phred/PhraD/Consedh软件包组装,拼接重叠群,PCR扩增连接重叠群缺口。GenBank登录号KC787110。
1.6 噬菌体Leo基因组成分分析
采用DNAStar软件包的EditSeq软件分析基因组大小、GC含量,TRF软件预测DNA序列中的串联重复序列,运用tRNAscan-SE软件对噬菌体Leo基因组中tRNA基因进行搜索。同时采用Promoter prediction/Prokaryotic程 序 (http://www.fruitfly.org/seq_tools/promoter.html)预测启动子区。
1.7 噬菌体Leo基因功能预测分析
采用Glimmer3.0基因预测软件对组装结果进行基因de novo 预测,使用 Blastall 2.2.21结合各个数据库(nr,swissport,tremble,cog),对推定基因进行同源比对,进行功能注释。
1.8 共线性分析
将噬菌体Leo基因与公共数据库基因进行blast m8比对,然后用perl语言,生成svg的共线性图。
1.9 构建系统进化树
参照文献[7]中的方法,运用Blastn2.2.29+,在核酸数据库中检索所有已知的与Leo基因组相似的噬菌体基因组,构建系统进化树。
2 结果
2.1 噬菌体Leo噬菌斑形态及颗粒形态
噬菌体Leo噬菌斑圆形透明,边缘清晰,呈裂解性噬菌体的特点。电镜观察发现,噬菌体Leo由头部和尾部构成,头部为对称的多面体结构,直径(70.0±3.0)nm,尾部可弯曲,长(211.0±31.7)nm(图1)。

图1 电镜观察噬菌体LeoFig.1 Electron micrograph of the phage Leo
2.2 噬菌体Leo宿主谱
噬菌体Leo宿主谱广,能裂解全部的结核分枝杆菌标准株及结核分枝杆菌临床敏感菌株,并能裂解大部分的结核分枝杆菌临床耐药菌株。噬菌体Leo对耐药牛结核分枝杆菌及非结核分枝杆菌也有一定的裂解作用,见表1。

表1 噬菌体Leo宿主谱Table 1 Host range of the phage Leo
2.3 基因组组成成分分析
噬菌体Leo基因组全长39 981bp,其中A占18.7%,C占33.5%,G占33.4%,T占14.4%,GC含量为66.86%。用tRNA scan-SE软件未检索到噬菌体Leo含tRNA区域,通过TRF软件检索噬菌体Leo串联重复序列,未检索到重复序列。
2.4 启动子预测分析
采用 Promoter prediction/Prokaryotic程序对噬菌体Leo的启动子区进行预测,发现4个区域具有与启动子序列结构相似的特征,对比基因的位置以及启动子位于结构基因的上游,推测Leo噬菌体基因组有3个可能的启动子区,见表2。

表2 噬菌体Leo可能的启动子区Table 2 Possible promoter sequence of the phage Leo
2.5 基因组功能预测分析
噬菌体Leo基因组经glimmer 3.0基因预测,发现有59个推定基因,起始密码子多使用ATG,少数为GTG。Leo基因组中前一基因的终止密码子与后一基因的起始密码子重叠现象较少见。大多数基因位于正链上,向右转录,最长基因为基因16(1 337bp),最短为基因50(44bp),其中有20个基因有推测功能,见表3。Leo含9个结构基因,基因32位于负链上,编码整合酶,但基因组中未发现编码阻遏蛋白的基因,因此噬菌体Leo为裂解性分枝杆菌噬菌体。同时对各个编码基因进行分析,未发现致病基因和毒力基因,符合安全性要求[8]。
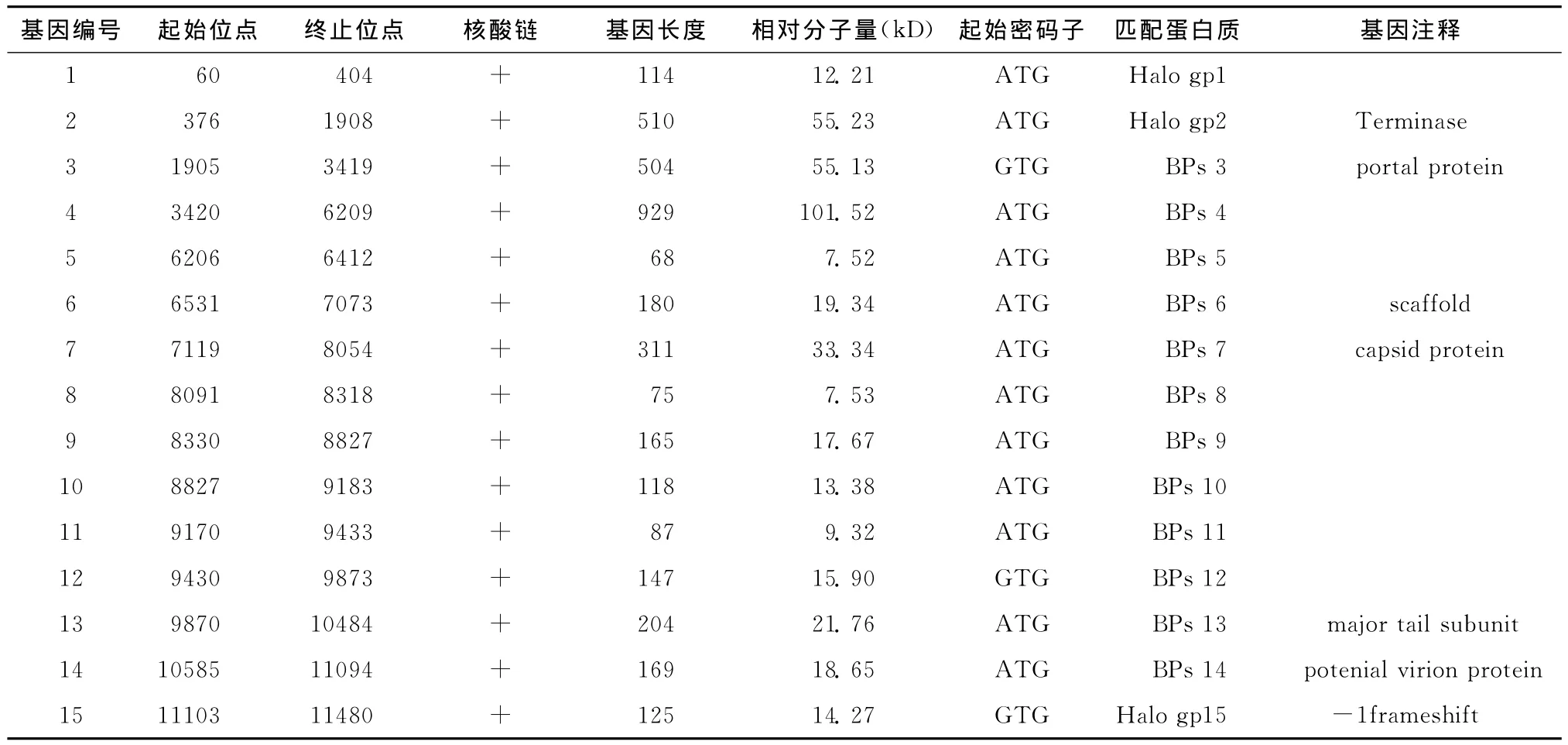
表3 噬菌体Leo基因注释Table 3 Gene annotation of the phage Leo

续表
2.6 共线性分析
噬菌体Leo 59个基因中有55个基因与BPs和Angel有高度的同源性(图2),相似度为93.22%,共线性清晰,可归为G簇分枝杆菌噬菌体。
2.7 构建系统进化树
系统进化树结果显示,噬菌体Leo与7株已完成测序的噬菌体亲缘关系较近,分别是BO4,DNAⅢ,Liefie,BPs,Halo,Hope,Angel。其中关系最近的是BO4和DNAⅢ,这2株噬菌体均由本课题组完成测序,证实为G簇噬菌体[9-10]。且噬菌体BPs,Halo,Hope,Angel均为G簇噬菌体,表明噬菌体Leo为G簇噬菌体。

图2 噬菌体Leo基因共线性分析Fig.2 Colinearity analysis of the genes of the phage Leo

图3 噬菌体Leo系统进化树Fig.3 Phylogenetic tree of the phage Leo
3 讨论
Leo基因组全长39 981bp,是目前已知的最小的噬菌体基因组之一[11]。Leo基因组含相对长的左臂(gene1-31)和相对短的右臂(gene33-59)。Leo gene32与噬菌体Halo编码整合酶的基因(gene32)相似度极高(95.96%),推定为编码整合酶的基因。但Leo基因组中未找到编码阻遏蛋白的基因。一般认为溶源性噬菌体必须含有整合酶和有活性的阻遏蛋白,才能确保其溶源性[12]。因此Leo为裂解性噬菌体。
分析显示,大部分结构基因位于左臂上,与噬菌体Halo或BPs的结构基因相似性极高。其中噬菌体Leo编码次要微丝蛋白的基因(gene22)与BPs gene22和Halo gene22相似。有研究通过噬菌斑筛选,得到对结核分枝杆菌高效能感染的G簇噬菌体突变株。经基因测序发现,在噬菌体Halo及BPs突变株中,编码次要微丝蛋白的基因(gene22)在604位点(A604E)或306位点(A306V)及其附近发生氨基酸突变。同时,对噬菌体Halo gene22上述2位点附近进行氨基酸突变后,得到了高效感染结核菌的噬菌体[13]。因此,推测若对噬菌体Leo gene22的604位点或306位点附近进行相应的氨基酸突变,能够得到对结核分枝杆菌高感染效能的突变株,提高其对结核分枝杆菌的裂解能力。
分枝杆菌噬菌体在结核病的诊断和治疗方面有一定的优势[14]。但是某些分枝杆菌噬菌体基因组中包含一些非自身编码的外来基因,其中一些基因可能编码致病因子,导致人类疾病[8-9]。同时,分枝杆菌噬菌体对结核分枝杆菌的感染能力与其所属族群有密切的关系。某些分枝杆菌噬菌体不能感染结核分枝杆菌,如K族、A2/A3亚族。因此必须筛选出能感染结核分枝杆菌且不含致病基因的裂解性噬菌体用于噬菌体疗法。
共线性分析显示,噬菌体Leo基因组与噬菌体BPs及Angel基因组最相似。且系统进化树结果显示,噬菌体Leo与噬菌体BO4及DNAⅢ亲缘关系最近,这4株噬菌体均为G簇噬菌体,故考虑Leo为G簇噬菌体。再者,Leo的GC含量66.86%,接近G簇噬菌体的GC含量(66.6%~66.8%),符合不同簇噬菌体之间GC含量差异大,同簇噬菌体的GC含量基本一致的原则,侧面印证Leo为G簇噬菌体[13]。G族噬菌体具有既能感染耻垢分枝杆菌,也能感染结核分枝杆菌形成噬菌斑的特点[13]。本实验通过测定噬菌体Leo的宿主谱也证实,Leo能在不同的结核分枝杆菌临床分离株上形成噬菌斑,它不仅能感染结核分枝杆菌敏感株、结核分枝杆菌耐药株,还能感染非结核分枝杆菌。对Leo的编码基因进行逐个分析,未发现致病基因及毒力基因,则其满足噬菌体疗法对噬菌体的安全要求。同时,由于Leo编码次要微丝蛋白的基因(gene22)与Halo gene22相似,可通过相应的点突变,提高其对结核分枝杆菌的感染能力。噬菌体Halo或BPs的突变株对结核分支杆菌的感染能力虽强,但这2株噬菌体均为溶源性噬菌体,不能用于结核病的噬菌体疗法。因此,噬菌体Leo是一株极具抗结核潜力且不含不利基因的裂解性噬菌体。能否通过Leo gene22 604位点或306位点的氨基酸突变,来提高噬菌体感染结核分枝杆菌的能力尚需进一步实验验证。
因此,噬菌体Leo满足噬菌体疗法对噬菌体的裂解性及安全性的各项要求,能够作为“鸡尾酒制剂”的候选噬菌体。
[1] Chauca J A,Paiomino J C,Guerra H.Evaluation of rifampicin and isoniazid susceptibilitytesting of Mycobacterium tuberculosis by a mycobacteriophage D29-based assay[J].J Med Microbiol,2007,56(Pt 3):360-364.
[2] 彭丽,陈保文,罗永艾,等.噬菌体D29对耐药结核病豚鼠的治疗作用[J].第四军医大学学报,2009,30(17):1576-1579.
[3] Goodridge L D.Designing phage therapeutics[J].Curr Pharm Biotechnol,2010,11(1):15-27.
[4] Kutateladze M,Adanda R.Bacteriophages as potential new therapeutics to replace or supplement antibiotics[J].Trends Biotechnol,2010,28(12):591-595.
[5] Hatfull G F.Phagehunting program[M].Pittaburgh:University of Pittshurgh,2006:23-24.
[6] Rybniker J,Kramme S,Small P L.Host range of 14mycobacteriophages in Mycobacterium ulcerans and seven other mycobacteria including Mycobacterium tuberculosis:Application for identification and susceptibility testing[J].J Med Microbiol,2006,55(Pt 1):37-42.
[7] Zhang Z,Schwartz S,Wagner L.A greedy algorithm for aligning DNA sequences[J].J Comput Biol,2000,7(1/2):203-214.
[8] Pedulla M L,Ford M B,Houts J M,et al.Origins of highly mosaic mycobacteriophage genomes[J].Cell,2003,113(2):171-182.
[9] 甘易玲,刘平,邬亭亭,等.分枝杆菌噬菌体DNAⅢ的遗传学信息及抗结核潜力初步研究[J].上海交通大学学报:医学版,2013,33(10):1323-1327.
[10] Gan Y,Wu T,Liu P.Characterization and classification of Bo4 as a cluster G mycobacteriophage that can infect and lyse M.tuberculosis[J].Arch Microbiol,2014,196(3):209-218.
[11] Sampaon T,Broussard G M,Marinel B L J,et al.Mycobacteriophages BPs,Angel and Halo:comparative genomics reveals a novel class of ultra-small mobile genetic elements[J].Microbiology,2009,155(9):2962-2977.
[12] Broussard G W,Oldfield L M,Hatfull G F,et al.Integrationdependent bacteriophage immunity provides insights into the evolution of genetic switches[J].Molecular Cell,2013,49(2):237-248.
[13] Jacobs-seca D,Marinelli L J,Bowman C,et al.On the nature of mycobacteriophage diversity and host preference[J].Virology,2012,434(2):187-201.
[14] Guo S,Ao Z.Phage in the diagnosis and treatment of tuberculosis[J].Front Bioaci(Landmark Ed),2012,17:2691-2697.

