持续干旱条件下红椿无性系幼苗的生理响应
陈彩霞 ,王瑞辉 ,吴际友 ,程 勇 ,刘 球 ,李 艳
(1.中南林业科技大学,湖南 长沙 410004;2. 湖南省林业科学院,湖南 长沙 410004)
持续干旱条件下红椿无性系幼苗的生理响应
陈彩霞1,2,王瑞辉1,吴际友2,程 勇2,刘 球2,李 艳1
(1.中南林业科技大学,湖南 长沙 410004;2. 湖南省林业科学院,湖南 长沙 410004)
以5个1年生的红椿幼苗无性系为实验材料进行水分胁迫,探讨其在持续干旱条件下的生理响应。结果表明:随着水分胁迫的加剧,叶绿素含量减少,但不同的品种有差异;丙二醛(MDA)含量逐渐增加;抗氧化酶(包括超氧化物歧化酶SOD和过氧化物酶POD)活性先增加后减少;5个无性系中,17和18号的抗氧化酶活性高于16、19和20号;渗透物质脯氨酸(Pro)的含量逐渐增加,17和18号比16、19和20号增加的值高;17和18号比16 、19和20号抗旱性好。
红椿无性系幼苗;干旱条件;水分胁迫;生理响应
红椿Toona ciliata Roem别名红楝子,楝科香椿属,半常绿乔木, 国家Ⅱ级重点保护野生植物,是我国热带、亚热带地区的珍贵速生用材树种。其木材为上等家具用材,素有“中国桃花心木”之称[1]。由于环境变化、过度开发以及天然更新较慢,其数量不断减少[2]。因红椿具有很高的经济价值,近年来红椿的育苗已经达到一定规模。
水分是植物生长的重要因子之一,能影响植物形态、生理生化代谢[3]。水分胁迫是各种胁迫环境中最常见、最普遍的逆境因子。在水分胁迫下,植物通过自身生理生化过程的调节,形成一定的抗性机理,表现为一些相关指标如超氧化物岐化酶(SOD)活性、脯氨酸含量等发生变化[4]。陈歆等[5]以槟榔幼苗为实验材料进行土壤水分胁迫试验,结果表明,槟榔幼苗叶片的丙二醛 MDA含量和脯氨酸Pro含量呈现上升趋势,过氧化物酶POD 活性和超氧化物歧化酶SOD 活性呈先升高后下降趋势。陈亚飞等[6]以普陀樟2年生实生苗为试验材料进行水分胁迫,结果表明,叶绿素含量都降低,植物叶片脯氨酸、丙二醛含量显著升高,超氧化物歧化酶SOD和过氧化物酶POD活性随着胁迫时间的延长表现出先升高后降低的趋势。红椿分布的地区多为亚热带,常出现伏旱天气,气温高,降水少,对红椿的生长尤其是幼苗具有严重影响。目前对红椿无性系嫩枝扦插的研究有较快的进展[2],但对红椿无性系幼苗的环境胁迫研究比较少。本研究以红椿无性系幼苗为实验材料,分析其在水分胁迫下的生理生化指标,筛选出抗旱性较好的无性系,以期为红椿科学育苗提供技术支撑。
1 材料与方法
1.1 实验材料及处理方式
实验材料为5个1年生红椿无性系幼苗,于2012年3月中旬移栽入带孔花盘中,每个无性系10盆,保证其生根和正常生长。试验从6月底开始到7月底结束,试验前对盆栽苗木进行充分浇水,然后放入透明的遮雨棚中,不再浇水,每间隔5 d采样,即在第1、6、11、16、21、26天采样,第1天的样品为对照,每次采样设3次重复。
1.2 测定指标及方法
(1)叶绿素测定采用浸提法。
(2)测定超氧化物歧化酶(SOD)、过氧化物酶(POD)和丙二醛(MDA)的酶液是取新鲜叶片0.2 g,用pH 值7.8的磷酸缓冲液7 mL进行冰浴研磨,用脱脂棉过滤于10 mL的离心管中,在10 000转的速率下离心15 min,提取上清液为酶液,这与卢少云等[7]的提取方法一致,超氧化物歧化酶活性采用氮蓝四锉法[8],丙二醛采用硫代巴比妥酸法[8],过氧化物酶的活性参照陈建勋等[8]的方法测定。
(3)脯氨酸(Pro)含量采用酸性茚三酮法[8]。
1.3 数据处理
数据使用Excel进行整理计算,用SPSS17.0进行方差分析。
2 结果与分析
2.1 持续干旱对红椿无性系幼苗叶绿素含量的影响
图1为5个红椿无性系幼苗的叶绿素含量在干旱胁迫条件下的变化。由图1可以看出,随着干旱胁迫的加重,叶绿素含量呈持续减少的趋势;第1天16、17、18、19和20号无性系叶绿素含量分别为2.7、3.3、3.0、2.4和2.5 mg/g,第16天分别为 1.3、2.0、2.0、0.8和 1.3 mg/g,第 16天分别是第1天的0.5倍、0.6倍、0.7倍、0.5倍、0.4倍和0.5倍;第16天后,16号和19号无性系叶片枯黄,植物体死亡;在第21天时,20号无性系叶绿素含量为0.8 mg/g,幼苗死亡;在第26天时, 17和18号无性系叶绿素含量仅为1.18 mg/g和 0.99 mg/g,叶片枯黄,植物体死亡。

图1 水分胁迫对红椿叶绿素含量的影响Fig.1 Effects of water stress on leaf chlorophyll content
方差分析表明,5个红椿无性系幼苗的叶绿素含量在不同的品系和不同的干旱胁迫时间之间有显著差异。
高等植物的光合色素包括叶绿素和类胡萝卜素,叶绿素是一种复杂的有机酸,存在于叶绿体中,绿色植物通过叶绿素利用光能进行光合作用,把二氧化碳和水转化为有机物,释放氧气。郑敏娜等[9]对水分胁迫下 6 种禾草叶绿体、 线粒体超微结构的研究结果表明,6种供试材料的叶肉细胞对水分胁迫最敏感的细胞器都是叶绿体,其次是线粒体;在水分胁迫下,叶绿体的超微结构发生变化,影响叶绿素的产生,导致叶绿素含量的降低。因此,植物在干旱胁迫下叶绿素含量的变化在一定程度上反映植物受害程度。
2.2 持续干旱对红椿无性系幼苗MDA含量的影响
图2为红椿无性系幼苗的MDA含量随干旱胁迫加深而变化的趋势。从图2可以看出:5个红椿无性系幼苗MDA含量随着水分胁迫的加深而上升。5个无性系在正常浇水情况下MDA的含量较小,16、17、18、19和20号无性系分别是10.95、12.47、11.76、10.34 和 9.07 μmol/g。干旱胁迫到第16天,MDA的含量是对照的2.9、2.3、2.3、2.1和2.9倍,16和19号无性系死亡。干旱胁迫中后期,17和18号无性系的MDA含量增幅大,达到 73.64 μmol/g 和 50.72 μmol/g,是对照的6.0倍和4.3倍。
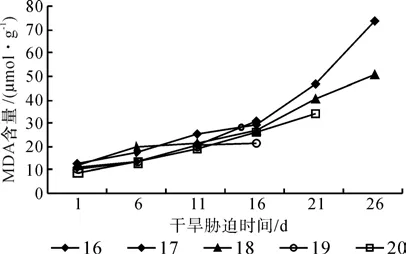
图2 干旱胁迫下红椿幼苗MDA含量的变化Fig.2 Changes of T. ciliata seedlings MDA contents under drought stress
方差分析表明:5个红椿无性系幼苗的MDA含量在不同的品系和干旱胁迫时间之间差异不显著。
当植物受到水分胁迫时,引发膜脂过氧化作用,丙二醛(MDA)是这一作用的产物之一,它的产生还能加剧膜的损伤,因此,丙二醛的含量能够代表膜脂过氧化的程度,也可间接反映植物组织的抗氧化能力的强弱,表明植物受干旱胁迫的程度[10]。
2.3 持续干旱对红椿无性系幼苗SOD和POD活性的影响
图3、4为5个红椿无性系幼苗SOD和POD活性在干旱胁迫条件下的变化。从图3、4可以看出,随着干旱胁迫的加重,SOD和POD活性呈先增加后减少的趋势。SOD活性达到峰值的时间为:16号在干旱胁迫第6天,为412.10 U/g,是对照的3.2倍;17和18号在干旱胁迫第16天,分别为694.63和685.06 U/g ,是对照的8.9倍和7.2倍;19和20号在干旱胁迫第11天,为499.84和476.55 U/g ,是对照的5.6倍和5.01倍。POD活性达到峰值的时间为:16和19号在干旱胁迫第11天,为 1 341.38和 1 208.24 U/(g·min),是对照的4.17倍和4.25倍;17、18和20号在干旱胁迫第16天,分别为1 776.67、1 167.52和762.27 U/(g·min),是对照的3.01倍、1.53倍和1.67倍。SOD活性和POD活性达到峰值的时间差异说明5个红椿无性系幼苗抵抗干旱胁迫的能力不同,17和18号抵抗能力较强,持续时间较长,16、19和20号抵抗能力较弱。
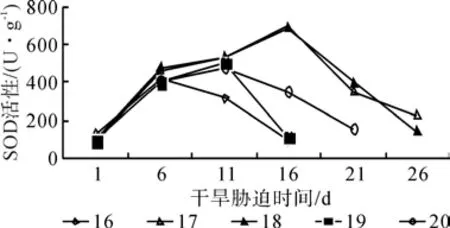
图3 干旱胁迫下红椿幼苗叶片SOD活性的变化Fig. 3 Changes of T. ciliata seedlings leaves SOD activity under drought stress
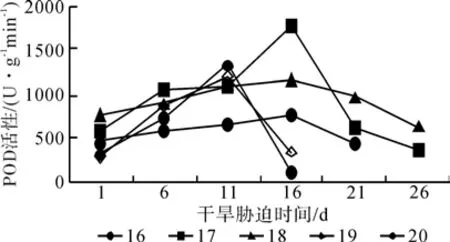
图4 干旱胁迫下红椿幼苗叶片POD活性的变化Fig. 4 Changes of T. ciliata seedlings leaves POD activity under drought stress
方差分析表明,5个红椿无性系幼苗的SOD活性和POD活性在不同的品系和不同的干旱胁迫时间之间有显著差异。
在干旱胁迫条件下,细胞内自由基产生和清除的平衡遭到破坏,此时积累的自由基对植物细胞造成伤害,SOD是机体内天然存在的超氧自由基清除因子,它通过一系列反应把对植物体有害的超氧自由基转化为过氧化氢,再通过植物体内的过氧化物酶POD和过氧化氢酶CAT将其分解为完全无害的水。这样,SOD、POD和CAT便组成了一个完整的防氧化链条,但随着干旱胁迫的加重,植物体的机体遭到破坏,这3种抗氧化酶的活性也会随之降低。这与李少锋等[11]的研究结果相同。
2.4 持续干旱对红椿无性系幼苗脯氨酸含量的影响
图5为5个红椿无性系幼苗的脯氨酸含量在干旱胁迫条件下的变化。由图5可以看出,随着干旱胁迫的加重,脯氨酸含量呈持续上升的趋势;在开始试验后的前6 d,脯氨酸含量增长缓慢。16、17、18、19和20号第6天的脯氨酸含量分别是第1天含量的3.0倍、2.0倍、2.3倍、1.3倍和3.0倍;在6~11 d,脯氨酸的含量迅速增加,是对照的11.0倍、20.5倍、11.7倍、9.0倍和8.3倍;在干旱胁迫第16天,脯氨酸的含量增长速度变慢,是第11天的1.1倍、1.2倍、1.3倍、1.5倍和1.8倍;第16天之后,增长得就更加缓慢;第21天之后,17和18号的脯氨酸含量都是21 d的1.1倍。在5个红椿无性系幼苗中,17和18号的脯氨酸含量增长速度快,持续时间长,抗干旱能力较强。
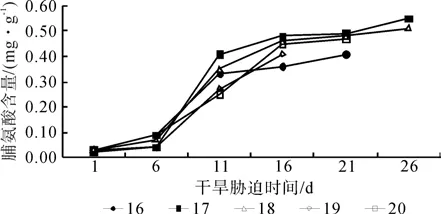
图5 干旱胁迫下红椿幼苗叶片脯氨酸含量的变化Fig.5 Changes of T. ciliata seedlings leaves proline contents under drought stress
方差分析表明:5个红椿无性系幼苗的脯氨酸含量在不同的品系和不同的干旱胁迫时间之间有显著差异。
脯氨酸是植物细胞内重要的渗透调节物质,植物在遭受轻微干旱胁迫时,能通过脯氨酸等渗透物质调节细胞的含水量和膨压势,从而维持细胞正常的生理功能。当干旱胁迫加重时,脯氨酸在细胞质内大量积累,降低细胞水势,加强细胞或组织吸水,同时,脯氨酸还能保护细胞生物大分子的活性结构,增加可溶性蛋白质的沉淀,从而对植物进行正常生理活动起到重要的保护作用,提高抗旱能力[12-17]。
3 结论和讨论
持续干旱条件下,5个红椿无性系幼苗叶绿素的含量逐渐降低,MDA含量呈持续增加的趋势,2种抗氧化酶超氧化物歧化酶SOD和过氧化物酶POD活性呈现先增加后降低的趋势,脯氨酸的含量呈慢—快—慢的变化趋势。上述生化物质的生理意义和变化趋势都表明17、18号红椿无性系幼苗比16、19、20号具有较强的抗旱能力。
实验材料为1年生无性系扦插苗,扦插试验在湖南省林业科学研究院杜家村林场进行。扦插苗枝条采自湖南石门红椿优质幼苗,该批幼苗是采用经过筛选的优良红椿种子繁殖的。在持续干旱情况下,5个红椿无性系幼苗的叶绿素含量、超氧化物歧化酶SOD和过氧化物酶POD活性、脯氨酸含量有显著差异,说明5个无性系之间产生差异是由树种本身的遗传因素引起的,其中17和18号无性系幼苗的抗旱能力较强。扦插实验结果表明,在夏、秋季节进行扦插,扦插枝条保留3~4个半叶片,17和18号扦插苗的成活率、生根率和1年生苗木的生长量较其它无性系较高,因此可以选择17和18号无性系在生产中进行推广。
[1] 中国树木志编委会. 中国主要树种造林技术[M]. 北京: 中国林业出版社, 1981.
[2] 吴际友, 程 勇, 王旭军, 等. 红椿无性系嫩枝扦插繁殖试验[J]. 湖南林业科技, 2011, 38(4): 5-7.
[3] 李 明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J]. 生态学报, 2002, 22(4): 503-507.
[4] 蒋 理, 丁彦芬, 孟国忠. 水分胁迫下 5 种地被植物的抗旱生理生化指标变化[J]. 江苏林业科技, 2009, 36(5): 6-10.
[5] 周兆德, 杨福孙. 土壤水分胁迫对槟榔幼苗叶片生理的响应[J]. 热带作物学报, 2010, 31(3): 387-392.
[6] 陈亚飞, 杜国坚, 岳春雷, 等. 水分胁迫对普陀樟幼苗生长及生理特性的影响[J]. 浙江林业科技, 2009, 29(3): 24-29.
[7] 卢少云, 郭振湘, 彭新湘, 等. 干旱条件下水稻幼苗的保护酶活性及其与耐旱性关系[J]. 华南农业大学学报, 1997, 18(4):21-25.
[8] 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2006.
[9] 郑敏娜, 李向林, 万理强, 等. 水分胁迫对 6 种禾草叶绿体、线粒体超微结构及光合作用的影响[J]. 草地学报, 2009,17(5): 643-649.
[10] 童方平, 方 伟, 马履一, 等. 湿地松优良半同胞家系保护酶活性及脂质过氧化作用对水分胁迫的生理响应[J]. 中国农学通报, 2007, 23(8): 102-107.
[11] 李少锋, 李志辉, 刘友全, 等. 水分胁迫对椿叶花椒抗氧化酶活性等指标的影响[J]. 中南林业科技大学学报, 2008, 28(2):29-34.
[12] 汤章城. 逆境条件下植物脯氨酸的累积及其可能的意义[J].植物生理学通讯,1984,1:15-21.
[13] 赵 坤, 吴际友, 陈 瑞, 等. 毛红椿光合及水分生理生态特性[J]. 中南林业科技大学学报, 2011, 31(5): 87-91.
[14] 徐兴友,杜金友,龙 茹,等.干旱胁迫下6种野生耐旱花卉苗木蒸腾耗水与耐旱性的关系[J].经济林研究,2010,28(1):9-13.
[15] 包 卓,孟祥英,张晓松,等.干旱胁迫对5种园林绿化植物生理生化的影响[J].经济林研究,2010,28(1):46-48.
[16] 周长东.枣树的抗旱性及节水栽培技术探讨[J].经济林研究,2000, 18(1):52-53.
[17] 谷文众,刘 杨,谷振军.干旱胁迫对金盏菊膜脂过氧化及保护酶活性的影响[J].经济林研究,2009,27(3):79-81.
Physiological responses of Toona ciliata clone seedlings under continuous drought conditions
CHEN Cai-xia1,2, WANG Rui-hui1, WU Ji-you2, CHENG Yong2, LIU Qiu2, LI Yan1
(1.Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Hunan Academy of Forestry, Changsha 410004, Hunan, China)
Based on five annual Toona ciliata clonal seedlings which have been drought stressed, the change of the physiological responses of the T. ciliata clonal seedlings were investigated under the persistent drought conditions. As the water stress intensified, the contents of chlorophyll would decreased, but there were differences in chlorophyll content, the contents of malondialdehyde (MDA)would increased, and the contents of SOD and POD would climbed up and then declined; among the five seedlings, the antioxidant enzyme activity of 17th and 18th T. ciliata clonal seedlings were higher than that of 16th, 19th and 20th; the contents of osmotic substances proline would increased and the added values of 17th and 18th T. ciliata clonal seedlings were higher than that of 16th,19th and 20th; the 17th and 18th T. ciliata clonal seedlings’ drought resistance was better than that of 16th, 19th and 20th.
Toona ciliata clonal seedlings; drought condition; water stress; physiological response
S718.43
A
1673-923X(2013)08-0046-04
2012-10-16
湖南省林业科技创新项目:珍贵用材树种红椿等良种选育研究(2012-07)
陈彩霞(1986-),女,河北迁安人,硕士研究生,从事城市林业与湿地保护理论与技术研究
王瑞辉(1962-),男,湖南湘乡人,教授,博士,主要从事植物水分生理生态研究;E-mail:wang626389 @163.com
[本文编校:谢荣秀]

