黄河口盐地碱蓬湿地土壤-植物系统重金属污染评价
王耀平,白军红,肖 蓉,高海峰,黄来斌,黄 辰
(北京师范大学环境学院 水环境模拟国家重点实验室,北京 100875)
黄河三角州河口湿地是中国及至世界暖温带唯一一块保存最完整,最典型,最年轻的湿地生态系统;该湿地具有丰富的植物资源,同时也是多种珍稀濒危鸟类的栖息地,因此,黄河三角洲湿地保护和管理一直受到国内外学者的高度关注[1]。近几十年来,大规模石油开发和农业开垦等高强度人类干扰和气候变化的综合作用已经导致黄河三角洲湿地生态系统出现了一定程度的退化,而重金属污染则是该区湿地退化的一个重要驱动因素[2]。在河口环境中,污染源排放的重金属可能吸附在悬浮颗粒物上并发生沉积,另一方面,河口区咸淡水混合导致pH值和盐份等变化时,水体中的重金属也会通过混凝、絮凝、共沉淀等途径进入沉积物或湿地土壤[3],湿地土壤/沉积物中累积的部分重金属可被植物根系吸收富集或转移到植物地上部分[4],从而改变重金属在湿地沉积物中的含量和分布特征并对湿地生产力和生物栖息生境产生不利影响。因此,重金属在湿地土壤-植物系统的迁移转化能够直接影响湿地生态系统的健康及其稳定性。
已有研究表明重金属的迁移转化过程受土壤理化性质[5]、水文条件[6]、海水和河水的混合过程等[7]多种因素的制约。国内学者对黄河三角洲湿地沉积物重金属污染特征进行了系列研究[8-9],但很少研究涉及河口区沼泽湿地土壤和植物系统中的重金属污染的综合研究,尤其缺乏考虑不同湿地水文条件下湿地土壤-植物系统重金属污染特征方面的研究。本研究对黄河三角洲盐地碱蓬湿地的重金属污染程度进行了评价,对比研究了不同水文条件下(淹水和不淹水)湿地表层土壤中的重金属污染水平及其在土壤-植物系统中的迁移特征,该研究有利于深入剖析重金属在河口区沼泽湿地重金属的生物地球化学过程,可为河口湿地土壤重金属污染防治和退化湿地恢复提供科学依据。
1 材料与方法
1.1 研究区域概况
黄河三角洲国家级自然保护区地处北纬37°40′—38°10′,东经118°41′—119°16′,位于我国山东省东营市黄河入海口,总面积15.3 万 hm2,主要分为故道保护区和现行流路保护区两部分。该区属暖温带季风性气候区,具有明显的大陆性季风气候特点,四季分明,冷热干湿界限极明显。研究区年平均气温12.1 ℃,无霜期196 d,年均降水量551.6 mm,年均蒸发量为1962 mm。区域内地势平坦,生态格局时空变异大,形成的湿地类型多样。黄河三角洲湿地土壤形成时间相对较短,机械组成以粉砂为主,土壤质地以轻壤土和中壤土为主,土壤类型以潮土和盐土为主。研究区地下水位较浅,水质矿化度高[10]。该区天然湿地植被以草本为主,主要植物群落有芦苇(Phragmitesaustralis)、盐地碱蓬(Suaedasalsa)、荻(Triarrhenasacchariflora)和穗状狐尾藻(Myriophyllumspicatum)等;普遍存在的灌木为柽柳(Tamarixchinensis);天然乔木为旱柳 (Salixmatsudana),仅在黄河河道两岸少量分布[11]。
1.2 样品采集与分析
于2007年8月在黄河三角洲自然保护区内部的入海口附近区域 (北纬37°52′— 38°11′,东经118°41′ —119°10′),根据淹水条件不同选择两个典型盐地碱蓬群落分布区:样区1(非淹水区,主要受较浅的地下水补给)和样区2(淹水区,受海水潮汐补给),在每个分布区内根据淹水条件划分为3个典型样地,样区1包括1-1(干)、1-2(湿)、1-3(过湿);样地2主要包括2-1(淹水1—2 cm)、2-2(淹水5—6 cm)和2-3(淹水8—9 cm)。在每个样地按0—10 cm和10—20 cm两个层次采集土壤样品,每个土层采集3个重复样品并混合为一个混合样,同时利用环刀采集土壤样品用于测定土壤容重和含水量;所有土壤样品带回实验室后,放置阴凉处风干2—3周,去除植物残体和石块,磨碎后过0.149 mm的土样筛后装袋备用。在采集土壤样品时同步采集盐地碱蓬植物样品,3次重复,洗净后分地上和地下两部分,在105 ℃烘箱内杀青30分钟后再在60 ℃温度下烘至恒重,磨碎装袋待测备用。
植物和土壤样品在聚四氟乙烯罐内经HClO4-HNO3-HF高温消解定容后采用原子吸收(法国,JY-ULTMA)进行测定total phosphorous (TP)、As、Cd、Cu、Cr、Pb和Zn含量;土壤pH值和盐分分别采用pH计和电导率仪测定(土∶水=1∶5);土壤含水量在105 ℃烘箱内烘24小时至恒重;土壤可溶性盐含量采用重量法测定;总氮 (Total nitrogen,TN)采用碳氮自动分析仪;土壤有机质(Soil organic matter,SOM)使用重铬酸钾热容量法[12]。实验土壤基本理化性质如表 1。

表1 样地土壤基本理化性质
1.3 数据统计与分析
通过计算Pearson相关系数来分析土壤基本理化性质参数间的相关性;运用单因素ANOVA分析不同样地或不同土层土壤重金属含量差异的显著性;采用采用SPSS12.0和Excel 2010对数据进行数据处理、分析和绘图。
2 结果与讨论
2.1 黄河口盐地碱蓬湿地土壤重金属污染评价
表2表明了黄河口盐地碱蓬湿地两个样区内土壤重金属含量测定值和不同地区的土壤/沉积物质量标准值。由表2可知,非淹水区湿地土壤Cr(P<0.05)和Zn(P<0.01)含量显著高于淹水湿地土壤,Cu含量则显著低于淹水湿地土壤(P<0.01);而两样区间其它重金属含量差异不显著(P>0.05)
根据国家土壤质量标准,黄河口非淹水区盐地碱蓬湿地土壤样品中As和Cd含量超过三级标准的分别占83%和67%,而Cu、Cr、Pb和Zn含量平均值均低于国家土壤质量一级标准,整体低于二级标准,表明非淹水湿地土壤As和Cd污染严重,而未受到Cu、Cr、Pb和Zn污染;这与Bai 等[2]研究黄河三角洲潮沟湿地土壤重金属污染时所得结论一致。对淹水区湿地而言,土壤样品的As含量超过或接近国家土壤质量三级标准,土壤Cd含量全部超过国家土壤质量二级标准但均低于三级标准,Cu含量基本都超过国家土壤质量一级质量标准但低于二级标准,而Cr、Pb、Zn基本都低于国家土壤质量一级标准,表明淹水区湿地土壤As和Cd污染较为严重,Cu次之,而Cr、Pb和Zn等未达到污染水平。
基于安大略湖沉积物标准,淹水和非淹水区湿地中50%以上的土壤样品超过了As的严重效应水平,而Cd、Cr、Cu均超过最低效应水平但未超过严重效应水平,Zn则未超过最低效应水平。对于Pb而言,非淹水区湿地土壤Pb含量未超过最低效应水平,而淹水区湿地土壤Pb含量则超过最低效应水平但低于严重效应水平。这表明黄河口盐地碱蓬湿地土壤As污染严重,Pb、Cd、Cr和Cu也呈现一定程度的污染,而Zn含量则未达到污染水平。根据加拿大沉积物质量标准,非淹水区和淹水区湿地中均有50%以上土壤样品 超过As的阈值效应水平,甚至有个别样地As含量超过了可能效应水平。淹水和非淹水区湿地土壤Cd、Cr、Cu和Pb含量均介于阈值效应水平与可能效应水平之间,而Zn含量则都低于阈值效应水平。根据香港沉积物分类标准,淹水和非淹水区湿地土壤As含量均处于化学物质低浓度值和化学物质高浓度值之间或是高于化学物质高浓度值,除非淹水区湿地中67%的土壤样品Cr含量超过化学物质低浓度值外,研究区湿地土壤所有样品的Cd、Cu、Pb和Zn含量均未超过,表明该区湿地土壤受到一定程度的As污染,且非淹水区湿地出现一定程度的Cr累积。通过与不同地区的沉积物质量标准进行对比分析发现,非淹水区湿地土壤已经遭受严重的As污染和一定程度的Cd和Cr污染;而淹水区湿地土壤As和Cd污染严重,并呈现一定程度的Cu和Pb污染。
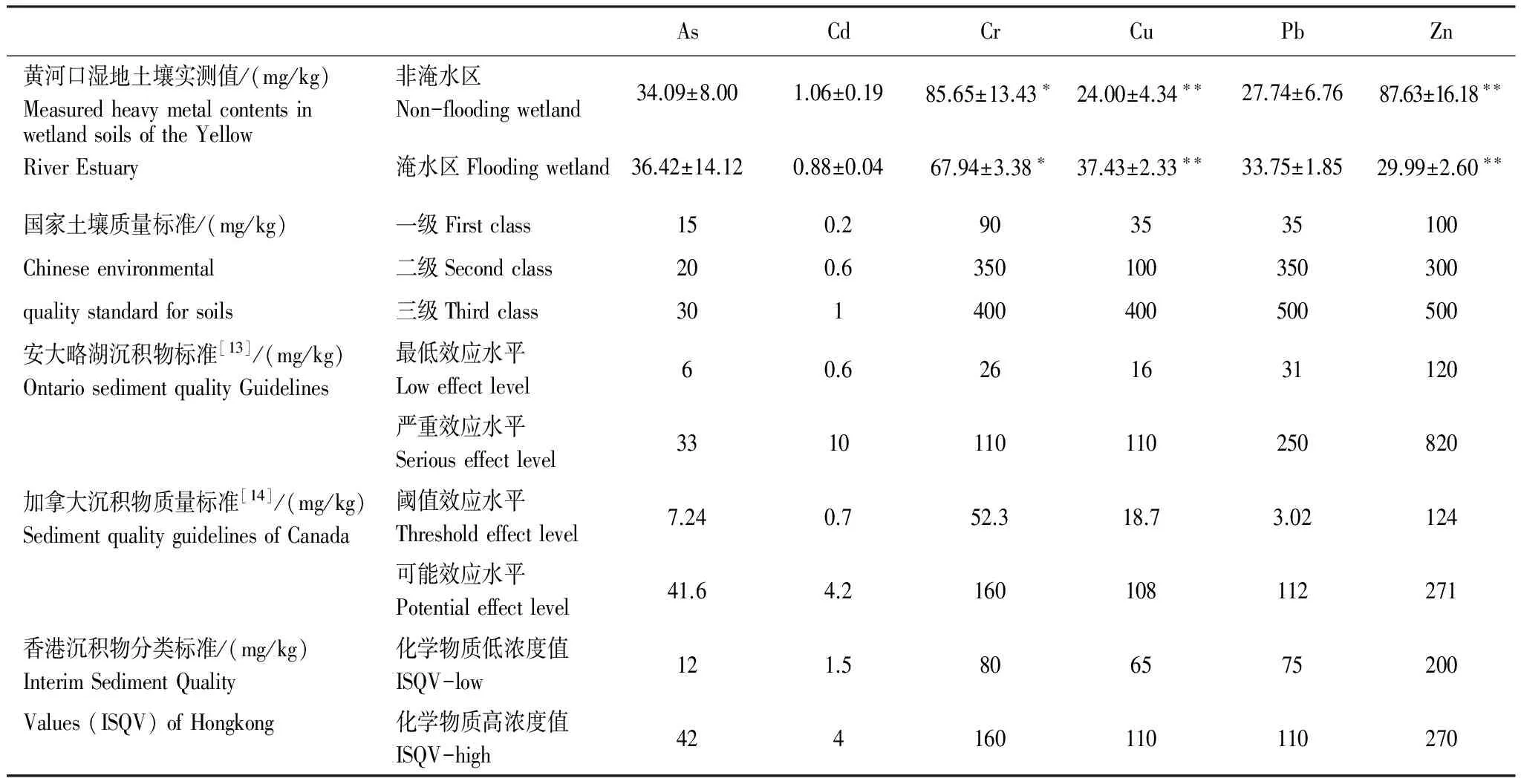
表2 实测重金属含量与标准值对比
*显著性差异(P< 0.05);** 极显著性差异(P< 0.01)
2.2 淹水和非淹水区湿地不同积水深度对重金属含量的影响
图1显示了黄河口淹水和非淹水区盐地碱蓬湿地土壤重金属含量随积水深度的变化特征。在非淹水区湿地中,除As外,较湿的样地1-2和1-3的土壤重金属含量高于较干的样地1-1,表明该区积水可能导致重金属在土壤表层发生积累。该区土壤As、Cd和Cr含量呈表层(0—10 cm)<亚表层(10—20 cm),而土壤Cu、Pb和Zn含量则呈表层>亚表层的趋势。淹水区湿地土壤As含量随积水深度增加而呈下降趋势,且样地2-1表层土壤As含量低于亚表层土壤,而积水相对较深的样地2-2和2-3表层土壤As含量高于亚表层土壤。但是3个样地间和各层土壤间Cd、Cr、Pb、Zn、Cu含量均变化不大,表明除As外,淹水积水深度对湿地土壤重金属含量的影响不大。
湿地在淹水条件下形成还原状态,大多数重金属易形成硫化物沉淀,活动性小,从而更容易在表层累积,但是As的环境行为与其它重金属相反,不会形成硫沉淀,并且在强还原状态下,还可能被微生物活动转化为AsH3进入大气[15],因此积水较深时湿地土壤As含量较低。相反,淹水区湿地土壤pH值较高(8.76,高于非淹水区8.10),而pH值高于8时金属硫化物沉淀的稳定性减弱,因此氧化还原电位的影响减弱[16],并且淹水区的氧化还原电位会因为涨退潮而发生变化,不会出现永久的还原性条件[3]。此外,由于淹水区受到潮汐海水的影响,海水对表层沉积物的混合作用导致积水深度的影响不显著。
非淹水区和淹水区湿地土壤重金属含量存在差异(表2,图1),可能与湿地淹水状况密切相关。其中,As含量在各样地间变化较大,受淹水和非淹水条件影响不显著。淹水区湿地土壤中Cr,Cd和Zn含量显著低于非淹水区湿地(P<0.05),但非淹水区湿地土壤中的Cu、Pb含量较低。重金属可以与海水中的Cl-形成可溶性络合物,使其更容易发生迁移[17],同时海水中的Ca、Mg等离子也会与重金属竞争吸附位点导致解吸[18]。Balls等[19]和Gerringa等[20]对河口沉积物的研究均发现水体盐度增加时Cd会从沉积物和CdS沉淀中释放出来。尽管非淹水区湿地土壤盐分含量较高(表1),但其水分补给主要来自浅层地下水,且地表无积水,限制了金属离子的迁移。因此海水中的离子和潮汐冲蚀可能是导致淹水区湿地土壤Cd、Cr和Zn含量偏低的原因。
海水中重金属可以被沉积物中的粘土矿物或有机质吸附并富集,或是生成硫化物、碳酸盐化合物等通过沉淀作用进入土壤[15]。以往研究表明,Pb、Cu与Cd、Zn相比具有更强的有机质的络合能力[21-22],同时高pH值时,由于有机质呈现更强的电负性,也有利于有机质与金属离子结合。本研究中,非淹水区湿地土壤pH值和有机质分别为8.10和5.73 g/kg,均低于淹水区湿地(8.76和6.52 g/kg)(表1)。因此,较高的有机质和pH值可能是导致淹水区湿地土壤中Pb、Cu含量偏高的原因。
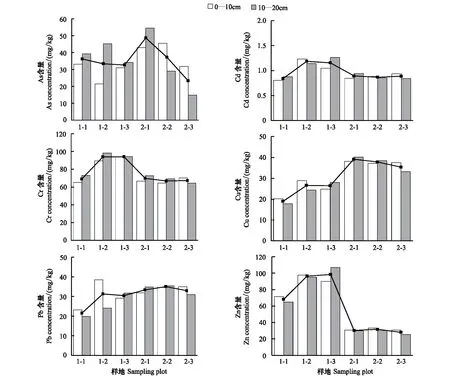
图1 黄河口非淹水区(样地1-1,1-2,1-3)和淹水区(样地2-1,2-2,2-3)盐地碱蓬湿地土壤重金属剖面分布(连线表示各样地0—20cm平均值)
2.3 黄河口盐地碱蓬湿地土壤重金属含量与土壤理化性质之间的关系
由表3可知,盐地碱蓬湿地土壤盐分和pH值呈极显著负相关(P<0.01),而TN和SOM呈极显著正相关(P<0.01),这与丁秋祎等[11]研究结论一致。Cr、Cd和Zn含量之间具有极显著的相关关系(P<0.01),说明三者来源和在土壤中的化学行为较为相似[23]。土壤Cr,Cd和Zn含量与土壤盐分含量呈极显著正相关关系(P<0.01),而与土壤pH值呈极显著负相关关系(P<0.01)。这主要是由于非淹水区湿地地表聚盐导致表层土壤盐分含量高于淹水区湿地土壤,且限制了重金属的迁移;而在淹水区受海水潮汐的影响,这3种重金属易形成Cl-络合物而发生迁移[15]。但是Lores等[24]发现盐度增加会显著降低沉积物有机质对Cd、Cr和Zn的吸附能力。这可能与淹水条件有关。而高pH值既可能导致金属迁移性降低,也可能由于强碱性条件下形成OH复合物而导致Cd、Cr和Zn等重金属的迁移性增加[25]。Seaman 等[26]发现碱性条件有利于使稳定的Cr(Ⅲ)氧化为易迁移的Cr(Ⅵ)。
除As外,有机质与其他重金属均呈正相关关系,但仅与Pb的相关性达到显著性水平(P<0.01),表明该区有机质对重金属的影响不显著。As与SOM呈现出弱的负相关性可能是由于As在非酸性土壤条件下,土壤有机质能够促使As(Ⅴ)转换为As(Ⅲ),导致As发生迁移和淋滤[25]。滕葳[15]报道了As不易被土壤有机质吸附,而主要吸附在粘土矿物上。Cu与土壤pH值呈显著的正相关关系(P<0.05),这是由于Cu在弱碱性土壤条件下不易发生迁移,其迁移性随pH值下降而增加[25]。Pb和Cu之间具有显著的正相关关系(P<0.05),表明二者之间也具有共同的来源和相似的化学行为,尤其是二者与有机质的相关性要明显高于其他重金属。
3.4 盐地碱蓬对湿地土壤重金属的富集和转移
通过植物体内茎叶部分重金属含量与土壤重金属含量之比,可以计算盐地碱蓬对各重金属的富集系数;根据植物地上部分与地下部分的重金属含量之比可计算出植物对重金属的转移系数[27]。图2表明了黄河口淹水区和非淹水区盐地碱蓬对重金属的富集系数和转移系数。研究得出的河口区盐地碱蓬对重金属的BCF与TF值均低于高云芳等[28]报道的黄河三角洲滨海湿地盐地碱蓬的富集系数和转移系数,同时与朱鸣鹤等[29]报道的辽河潮滩盐地碱蓬对Cu、Zn、Pb和Cd的富集系数也存在明显的不一致。这可能是由于同一种湿地植物的富集系数和转移系数受采样时间、采样地点等环境因素的影响。

图 2 淹水区和非淹水区盐地碱蓬对湿地土壤重金属的富集系数及转移系数
除非淹水区湿地中的Cr、Cu和淹水区湿地中Zn外,研究区盐地碱蓬对重金属的富集系数均小于1,说明重金属未在盐地碱蓬植物体内显著富集。盐地碱蓬对Cu、Zn的富集系数高于其它重金属可能是由于Cu和Zn为生物体必须元素,植物需要大量吸收和消耗这些元素[30]。
根据BCF的大小可以看出,淹水和非淹水区盐地碱蓬对Cu具有明显的富集作用,且非淹水区盐地碱蓬的富集作用更强(P<0.01),这与Gambrell[31]的研究结果一致,说明在淹水深度较浅的情况下,湿地植物对Cu的吸收可能会增强。淹水区盐地碱蓬对Zn的富集作用要强于非淹水区湿地(P<0.01),这可能与非淹水区湿地土壤Zn含量较高有关(约是淹水区湿地土壤的3倍,表1),因为植物对Zn的富集能力会受到土壤中Zn含量的影响[4]。
非淹水区盐地碱蓬对Cu,Cr和Pb的转移系数大于2,而对As,Cd和Zn的转移系数小于1,表明该区盐地碱蓬对Cu、Cr和Pb的转移能力较强,能够在植物地上部分发生累积,并可能通过残落物的形式归还土壤[4]。淹水区盐地碱蓬对As和Cu的转移系数较大,而对其他重金属的转移系数较小,表明该区盐地碱蓬对As和Cu具有较强的转移能力;而非淹水区盐地碱蓬对Cr和Pb的转移能力较强(P<0.05),但对As的转移能力较弱(P<0.01)。其原因在于植物对重金属的转移能力与植物种类、重金属种类和环境条件有关,有些植物在高盐分和低pH条件下对重金属的转移能力会增强[4]。与淹水区湿地相比,非淹水区湿地土壤盐分较高、土壤pH较低可能有利于这两种金属从盐地碱蓬地下部分向地上部分转移。与另一种湿地植物互花米草(Spartinaalterniflora)相比,盐地碱蓬对Pb、Cr、Cu和Zn重金属的转移系数均较高[32]。
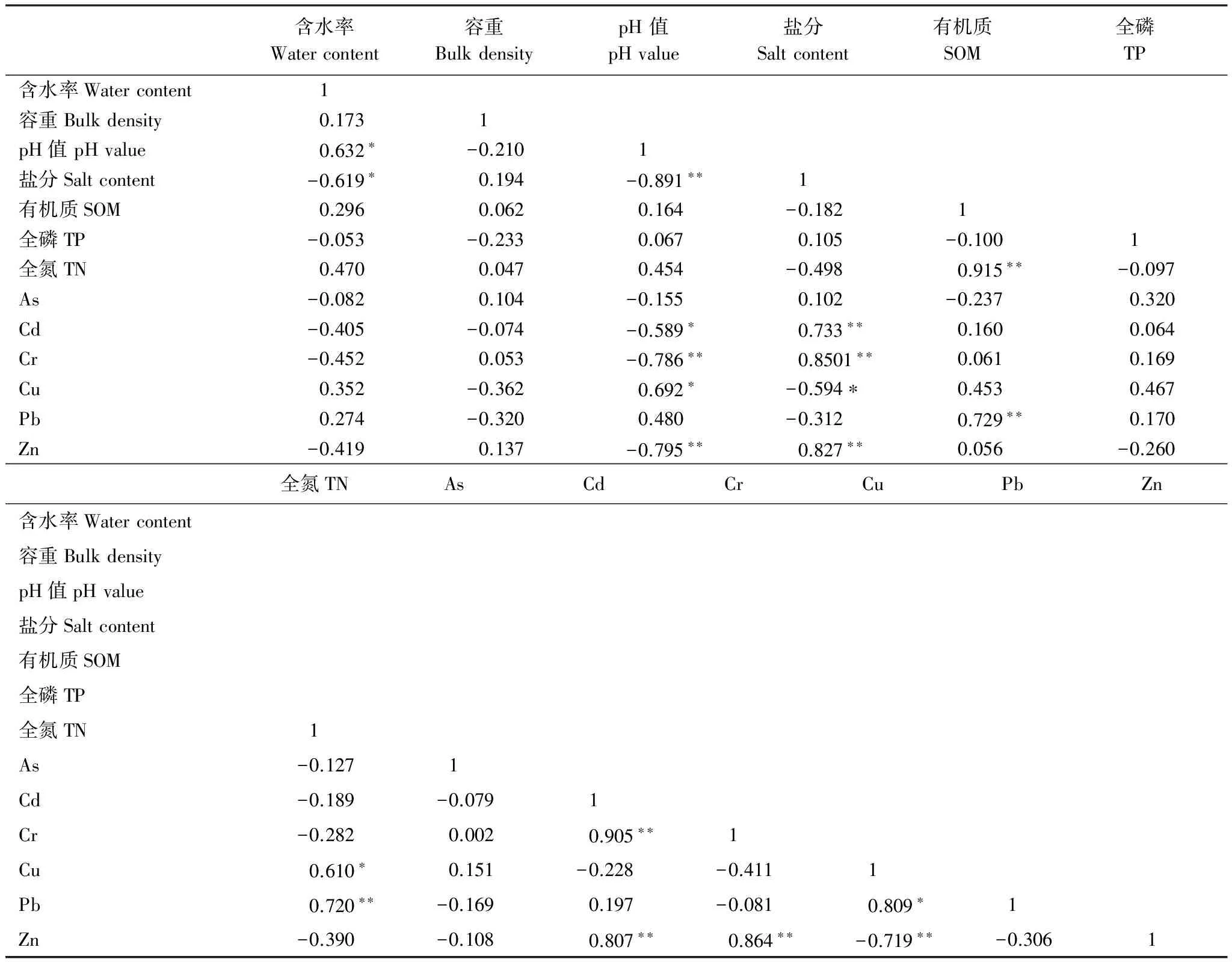
表3 黄河口盐地碱蓬湿地土壤重金属和土壤属性的相关性分析
显著相关(P< 0.05);**极显著相关(P< 0.01);n=12
3 结论
黄河口盐地碱蓬湿地土壤重金属整体污染程度较轻,其中As为主要污染物,Cd、Cr、Cu为次要污染物,Pb和Zn未达到污染水平。淹水区和非淹水区湿地的不同水文条件对土壤和植物中重金属含量有一定的影响。无论是在非淹水区还是淹水区湿地,As的行为都主要受水深影响,水深增加导致As含量下降。对于其它重金属(Cd、Cr、Cu、Pb和Zn)而言,在非淹水区土壤积水会导致重金属在土壤表层积累,而在淹水区淹水深度对土壤表层重金属含量影响不大。研究区域土壤表层Cr、Cu和Zn含量主要受土壤盐分和pH值的影响;除Pb外,重金属受有机质含量影响较弱;重金属Cr、Cu和Zn之间具有显著的相关关系,表明存在共同来源。
盐地碱蓬对重金属的富集和转移受到重金属种类、淹水条件以及土壤重金属含量和理化性质等因素影响。淹水区盐地碱蓬对Cu和Zn具有相对较强的富集能力,而非淹水区盐地碱蓬只对Cu具有最强的富集能力;非淹水区盐地碱蓬对Cu、Cr和Pb的转移能力较强,而淹水区盐地碱蓬对As和Cu 具有较强的转移能力。除Cr、Cu和Zn外,重金属在盐地碱蓬的根系内一般不存在显著富集,且绝大多数重金属都表现出地上部分的含量比根系高的现象。
[1]Xu X G,Lin H P,Fu Z Y,Bu R C.Regional ecological risk assessment of wetland in the Huanghe River Delta.Acta Scicentiarum Naturalum Universitis Pekinesis,2001,37(1): 111-120.
[2]Bai J H,Huang L B,Yan D H,Wang Q G,Gao H F,Xiao R,Huang C.Contamination characteristics of heavy metals in wetland soils along a tidal ditch of the Yellow River Estuary,China.Stochastic Environmental Research and Risk Assessment,2011,25(5): 671-676.
[3]Laing G D,Vandecasteele B,Grauwe P D,Moors W,Lesage E,Meers E,Tacka F M G,Verlooa M G.Factors affecting metal concentrations in the upper sediment layer of intertidal reedbeds along the river Scheldt.Journal of Environmental Monitoring,2007,9(5): 449-455.
[4]Weis J S,Weis P.Metal uptake,transport and release by wetland plants: implications for phytoremediation and restoration.Environment International,2004,30(5): 685-700.
[5]Laing G D,de Vos R,Vandecasteele B,Lesage E,Tack F M G,Verloo M G.Effect of salinity on heavy metal mobility and availability in intertidal sediments of the Scheldt estuary.Estuarine,Coastal and Shelf Science,2008,77(4): 589-602.
[6]van den Berg G A,Loch J P G,Winkels H J.Effect of fluctuating hydrological conditions on the mobility of heavy metals in soils of a freshwater estuary in the Netherlands.Water,Air,and Soil Pollution,1996,102(3/4): 377-388.
[7]Paucot H,Wollast R.Transport and transformation of trace metals in the Scheldt estuary.Marine Chemistry,1997,58(1/2): 229-244.
[8]Guo D Y.Analysis on heavy metals distribution in the Yellow River Delta.Journal of Environmental Management College of China,2007,17(1): 88-89.
[9]Ling M,Liu R H,Wang Y,Tang A K,Yu P,Luo X X.The spatial distribution of heavy metals in the soil ofTamarixchinensisforest farm in yellow river delta wetland and its ecological significance.Transactions of Oceanology and Limnology,2010,(4): 41-46.
[10]Ding Q Y,Bai J H,Gao H F,Xiao R,Cui B S.Soil nutrient contents in Yellow River delta wetlands with different plant communities.Journal of Agro-Environment Science,2009,28(10): 2092-2097.
[11]He Q,Cui B S,Zhao X S,Fu H L.Niches of plant species in wetlands of the Yellow River Delta under gradients of water table depth and soil salinity.Chinese Journal of Applied Ecology,2008,19(5): 969-976.
[12]Institute of Soil Science,Chinese Academy of Sciences,Nanjing.Soil Physical and Chemical Analysis.Shanghai: Shanghai Scientific and Technical Publishers,1987: 96-104,132-136.
[13]Ontario Ministry of Environment and Energy.Guidelines for the Protection and Management of Aquatic Sediment Quality in Ontario.(1993-8) [2011-9].http://www.ene.gov.on.ca/envision/gp/B1-3.pdf.
[14]MacDonald D D,Ingersoll C G,Berger T A.Development and evaluation of consensus-based sediment quality guidelines for freshwater ecosystems.Archives of Environmental Contamination and Toxicology,2000,39(1): 20-31.
[15]Teng W,Liu Q,Li Q,Liu Y B.Hazards and Risk Assessment of Heavy Metal Contamination for Agricultural Products.Beijing: Chemical Industry Press,2010: 261-297.
[16]Environmental Protection Agency.Framework for metals risk assessment,Chapter 3.(2007-3-8) [2012-5-31].http://www.epa.gov/raf/metalsframework/pdfs/chaper3.pdf.
[17]Hahne H C H,Kroontje W.Significance of the pH and chloride concentration on the behavior of heavy metal pollutants Hg(II),Cd(II),Zn(II),Pb(II).Journal of Environmental Quality,1973,2: 444-450.
[18]Tam N F Y,Wong Y S.Retention and distribution of heavy metals in mangrove soils receiving wastewater.Environmental Pollution,1996,94(3): 283-291.
[19]Balls P W,Laslett R E,Price N B.Nutrient and trace metal distributions over a complete semi-diurnal tidal cycle in the Forth estuary,Scotland.Netherlands Journal of Sea Research,1994,33(1): 1-17.
[20]Gerringa L J A,de Baar H J W,Nolting R F,Paucot H.The influence of salinity on the solubility of Zn and Cd sulphides in the Scheldt estuary.Journal of Sea Research,2001,46(3/4): 201-211.
[21]Baeyens W,Goeyens L,Monteny F,Elskens M.Effect of organic complexation on the behaviour of dissolved Cd,Cu and Zn in the Scheldt estuary.Hydrobiologia,1998,366: 81-90.
[22]Muller F L L.Interactions of copper,lead and cadmium with the dissolved,colloidal and particulate components of estuarine and coastal waters.Marine Chemistry,1996,52(3/4): 245-268.
[23]Callaway J C,Delaune R D,Patrick Jr W H.Heavy metal chronologies in selected coastal wetlands from Northern Europe.Marine Pollution Bulletin,1998,36(1): 82-96.
[24]Lores E M,Pennock J R.The effect of salinity on binding of Cd,Cr,Cu and Zn to dissolved organic matter.Chemosphere,1998,37(5): 861-874.
[25]Kumpiene J,Lagerkvist A,Maurice C.Stabilization of As,Cr,Cu,Pb and Zn in soil using amendments-a review.Waste Management,2008,28(1): 215-225.
[26]Seaman J C,Arey J S,Bertsch P M.Immobilization of nickel and other metals in contaminated sediments by hydroxyapatite addition.Journal of Environmental Quality,2001,30(2): 460-469.
[27]McGrath S P,Zhao F.Phytoextraction of metals and metalloids from contaminated soils.Current Opinion in Biotechnology,2003,14(3): 277-282.
[28]Gao Y F,Li X Q,Dong G C,Liu F,Wang Y N,Ke H.Purification of several salt marsh plants to the coastal wetlands in the estuary of Yellow River.Meteorological and Environmental Research,2010,1(10): 53-57.
[29]Zhu M H,Ding Y S,Zheng D C,Tao P,Ji Y X,Gong W M,Ding D.Accumulation and absorption mechanism about the familiar heavy metals ofSuaedasalsain the intertidal zone.Environmental Pollution and Control,2005,27(2): 84-87.
[30]Gambrell R P.Trace and toxic metals in wetlands-a review.Journal of Environmental Quality,1994,23(5): 883-891.
[31]Zhu D T,Li M H,Li X.Cycle and enrichment characteristics ofSpartinaalternifloracommunity on heavy metal elements.Journal of Anhui Agricultural Sciences,2010,38(3): 1203-1205.
[32]Yang H,Shen Z,Zhu S,Wang W.Heavy metals in wetland plants and soil of lake Taihu,China.Environmental Toxicology and Chemistry,2008,27(1): 38-42.
参考文献:
[1]许学工,林辉平,付在毅,布仁仓.黄河三角洲湿地区域生态风险评价.北京大学学报: 自然科学版,2001,37(1): 111-120.
[8]郭德英.黄河三角洲重金属分布状况及分析评价.中国环境管理干部学院学报,2007,17(1): 88-89.
[9]凌敏,刘汝海,王艳,汤爱坤,于萍,罗先香.黄河三角洲柽柳林场湿地土壤重金属空间分布特征及生态学意义.海洋湖沼通报,2010,(4): 41-46.
[10〗 丁秋祎,白军红,高海峰,肖蓉,崔保山.黄河三角洲湿地不同植被群落下土壤养分含量特征.农业环境科学学报,2009,28(10): 2092-2097.
[11]贺强,崔保山,赵欣胜,付华龄.水、盐梯度下黄河三角洲湿地植物种的生态位.应用生态学报,2008,19(5): 969-976.
[12]中国科学院南京土壤研究所.土壤理化分析.上海: 上海科学技术出版社,1987: 96-104,132-136.
[15]滕葳,柳琪,李倩,柳亦博.重金属污染对农产品的危害与风险评估.北京: 化学工业出版社,2010: 261-297.
[29]朱鸣鹤,丁永生,郑道昌,陶平,吉云秀,公维民,丁德文.潮滩盐沼植物翅碱蓬对常见重金属的累积吸收及其机制.环境污染与防治,2005,27(2): 84-87.
[31]朱丹婷,李铭红,李侠.互花米草群落对重金属元素的循环和富集特征.安徽农业科学,2010,38(3): 1203-1205.

