花蜜中酚类物质对群落中同花期植物传粉的影响
赵广印,李建军,高 洁
(1. 中国科学院西双版纳热带植物园, 昆明 650223; 2. 中国科学院研究生院,北京 100049)
花蜜是植物特定的蜜腺分泌的含糖液体,以奖励访花者为植物提供的传粉服务[1]。除了丰富的糖以外,许多植物分泌的花蜜中还含有与植物抗虫有关的次生代谢物质,如生物碱 (Alkaloids) 和酚类 (Phenolics) 物质[2-4]。据估计,超过30%的植物所分泌的花蜜中含有多酚,大约有10%的植物所产生的花蜜中含有生物碱[2]。在低海拔热带地区, 分泌含有次生代谢物质花蜜的植物更为常见[2]。植物花蜜化学成分常常与传粉昆虫的类群有密切关系[5-6],从而成为重要的传粉综合症[4]。例如,分泌的花蜜中氨基酸含量高的植物主要是通过蛾类来传粉[5]。含有次生代谢物质的花蜜通常阻止一些访花者,一般称这类花蜜为有毒花蜜 (Toxic nectar)[3]。但是一些传粉蜂类能够分泌葡萄糖氧化酶 (Glucose oxidase)[7],该酶可以灭活花蜜中的次生代谢物质[8],所以传粉蜂类对这类花蜜有较强的抗性[9]。尽管花蜜中高浓度的次生代谢物质能够阻止一些蜂类采集[10],但是大量的饲喂试验表明蜜蜂属 (Apis) 偏爱采集自然界中含有次生代谢物质的花蜜[11-12]。因此,自然界中一些分泌含有次生代谢物质花蜜的植物,如烟草属 (Nicotiana) 和柑橘属 (Citrus) 植物是完全依靠蜂类传粉的[13-14]。
花蜜中次生代谢物质通常改变传粉蜂类的生理状态。例如,蜜蜂 (Apiscerana) 取食含有酚类[12]或者生物碱[15]的花蜜后,其对花蜜中糖的敏感性明显提高。蜜蜂生理的变化引起其采集行为的很大改变。花蜜中生物碱能改变熊蜂 (Bombus) 和蜜蜂等的拜访行为,包括缩短访花时间和降低自交率[16]。饲喂试验表明, 如果给欧洲蜜蜂 (Apismellifera) 饲喂糖浆,其能够积极利用采集烟草等植物含有生物碱的花蜜,一旦停止饲喂糖浆,蜜蜂立即停止取食该有毒花蜜[6]。熊蜂在取食有毒花蜜时,也表现出这种所谓的“稀释中和”行为[17]。这种行为被认为是昆虫利用碳水化合物来“掩盖”花蜜中味苦的次生代谢物质[18-20]。因此,传粉蜂类在拜访自然群落中一些有毒花蜜的植物时,通常将其采集有毒花蜜的行为与拜访其它无毒花蜜的植物紧紧地联系在一起[17,21-22]。所以,自然群落中有毒花蜜与其它分泌无毒花蜜而花期相同的植物存在着密切联系[8,17]。但是,到目前为止,尚没有任何研究确定有毒花蜜是否有利于群落中其它同花期植物的传粉。
本研究主要探讨有毒花蜜对群落中其它同花期植物传粉的影响。由于自然生态系统开花植物种类繁多,花蜜的化学成分复杂,通过充足饲喂自然蜂群的方法,确定蜜蜂在取食含有丰富次生代谢物质花蜜后是如何选择拜访群落中同花期的植物。蜜蜂选择植物的种类是通过分析花蜜和采集蜂携带花粉团中花粉种类来确定的。本研究主要回答如下几个问题:1)取食含次生代谢物质花蜜的蜂群是否改变了拜访植物的种类?是否倾向采集含糖量高的花蜜?2)取食含次生代谢物质花蜜的蜜蜂是否加强了群落中同花期物质之间的相互作用?
1 研究地和研究方法
1.1 研究地点自然概况
本研究在中国科学院西双版纳热带植物园与西双版纳州自然保护区管理局共建的永久样地 (101°34′26″— 47″ E,21°36′42″—58″ N) 开展。该样地位于西双版纳傣族自治州勐腊县补蚌村南贡山东部斑马山脚,东距勐腊瑶区公路约500 m,北面翻越次生林的几个山脊之后可到达北沙河。样地面积为20 hm2,东西长500 m,南北长400 m,整个样地向西偏斜19°。样地内的海拔变幅较大,最低点海拔为709.27 m,最高点海拔为869.14 m。样地的土壤类型为砖红壤[23]。西双版纳气候属热带季风气候,雨季和旱季交替明显。年平均气温为21.8 ℃,年平均降雨量为1493 mm,每年5月到10月为雨季,降雨量占全年降雨量的84%,11月到翌年4月为旱季,降雨稀少。由于特殊的地形地貌,气候的立体分异相当大,其东、北、西三面高,在一定程度上阻挡了西北方来的冷气流,使得最冷月平均气温并不低,弥补了积温的不足。低山沟谷及地丘在冬季有浓雾,又弥补了降水的不足。因而在该地区的低山沟谷及低丘上,形成了热带湿润气候,具有热带雨林发育的条件[24-25]。样地内共含有胸径≥1 cm的乔木95834株,其中已经鉴定的有95498株,占总个体数的99.65%;有乔木种类468种,隶属于213个属和70个科[26]。
1.2 研究方法
1.2.1 开花植物调查
从2009年3月至5月,对其间大样地内开花植物进行调查,记录正在开花的植物的树牌编号,以备以后根据大样地基础资料,确定该开花植物的种类和名称.。同时, 采集开花植物新鲜的花朵 (带花药),置于装有FAA (福尔马林∶冰醋酸∶50%酒精混合液=5∶5∶90) 固定液的50 mL离心管中, 包装好后带回实验室, 以备以后制作花粉图谱用。
1.2.2 蜂种选择与饲喂方案
在大样地附近购买和野外自己捕获6群中华蜜蜂 (Apiscerana),将其转移到统一制作的中华蜜蜂蜂箱 (440 mm×370 mm×270 mm)(GB 3607—83)中,然后将蜂群搬运并安置在大样地边缘 (101°35′05″ E,21°35′59″ N) 进行饲喂试验。为了避免蜂群大小对试验结果的影响,在开展饲喂试验前,通过调整子脾方法,平衡各个试验蜂群中成年工蜂的数量和幼虫 (封盖蛹、幼虫) 的数量。
将6群蜜蜂分为两组,每组3群。其中一组饲喂重量浓度为30%的蔗糖糖浆 (普通食糖),另外一组饲喂相同糖浆但含有0.01%槲皮素 (quercetin, 纯度为95%以上)。该类黄酮是一些花蜜中常见的酚类物质。由于野外有许多植物在开花,其花蜜中化学成分可能削弱所饲喂的槲皮素的效果,所以饲喂试验中槲皮素的浓度大约为一般蜂蜜中的2倍[27]。
用所配制的纯糖浆和含有槲皮素的糖浆进行巢内饲喂,即将配制好的糖浆倒入蜂群内的饲喂器内。饲喂量为200 mL/d,这个量是一个由4—5脾蜜蜂组成蜂群维持正常生活每天所必需的量。为刺激蜜蜂采集花粉,以方便研究分析,在饲喂过程中,不给蜂群提供花粉,因为奖励饲喂能够刺激蜜蜂采集植物花粉。
由于供试蜂群的遗传背景不清楚,可能对实验的结果产生一定的影响。为此,对每个处理设置3个重复,用于估计蜂群不同所造成的实验误差。
1.2.3 蜜蜂拜访植物种类鉴定
自2009年3月开始对两组中蜂蜂群进行饲喂,试验自4月10日正式开始,每隔4 d取蜂蜜样品1次。在此期间同时在中锋活动的日高峰期(11:00—14:00)取两组采粉蜂携粉足上携带的花粉团。
通过比较饲喂纯糖浆和含有酚性物质糖浆蜂群拜访植物种类的差异,确定蜜蜂食物中酚性物质是否改变蜜蜂的采集选择行为。蜜蜂拜访植物的确定采用如下的方法和步骤:
(1) 参考花粉图谱的制作
取新鲜或干燥后的花朵或花药置于离心管中,加入2 mL冰乙酸 (掩盖花为止),摇匀静置2 h,3000 r/min离心10 min,倒去上清液。加入新配制的醋酸酐-浓硫酸 (9∶1)混合液2 mL,85 ℃下水浴5—10 min。光学显微镜10 × 40倍的视野下观察,从不同角度拍摄并制作花粉图谱。
(2) 采样与样品处理
精确称量蜜样10 g用20 mL蒸馏水溶解,移入离心管离心,3000 r/min离心10 min,弃去上清液;加入3 mL冰乙酸,摇匀静置2 h,3000 r/min离心10 min,倒去上清液。加入新配制的醋酸酐-浓硫酸 (9∶1)体积混合液1 mL,85 ℃下水浴5—10 min (以溶液变色为准),取出后冷却待检。
取干净载玻片,用胶头滴管滴上一滴取制做好的检液,盖上盖玻片 (避免气泡产生),将制好的玻片放在400倍的显微镜下观察,对照制好的蜜源植物花粉图片,鉴别蜂蜜中的花粉种类。
1.2.4 蜜蜂蜜囊中花蜜含糖量的测定
试验期间中,在中锋活动的日高峰时段将两组采集蜂蜜囊中的花蜜挤出,并用手持糖量计(WYT型)测定中蜂蜜囊中花蜜的含糖量,然后用SPSS 13.0做Mann-Whitney U Test检验,比较两种处理条件下中蜂选择采集的植物的花蜜含糖量是否存在差异。
1.3 数据处理
1.3.1 蜂蜜中孢粉种类比较
根据两种处理条件下中蜂蜂蜜样品中含有的植物花粉种类,分别计算饲喂纯糖浆组特有的植物花粉种类数占每次取样观测到的植物花粉种类数的百分比、饲喂含酚的糖浆组特有的植物花粉种类数占每次取样观测到的植物花粉种类数的百分比和两种处理条件下共同含有的植物花粉数占每次取样观测到的植物花粉种类数的百分比,并用sigma plot软件制作成饼图,用Fisher Exact Test检验,分别统计6次取样,两种饲喂条件下中蜂采集的植物种类有无明显差异,显著水平取α=0.05。
1.3.2 花粉团中1种以上植物花粉种类的采集蜂比例比较
在蜂箱巢门口守候,收取归巢采粉蜂携粉足花粉筐内的花粉团,按上面1.2.3的实验步骤,测定两种处理条件下,采粉蜂所携带的花粉团中含有的植物花粉种类。然后用 SPSS 13.0进行Fisher Exact Test检验,比较两种处理条件下中蜂采集1种以上花粉种类的采集蜂比例是否存在差异。显著水平取α=0.05。
2 结果与分析
2.1 两种处理条件下中蜂蜂群采集植物种类的差异
在试验期间,共从两组处理蜂群的蜂蜜中发现植物花粉种类96种,隶属46个科。就每次取样分别统计,两种试验处理条件下蜂蜜样品中植物花粉的种类数量上没有明显差异(X2< 5.552,df=2,P>0.062),但植物花粉种类却明显不同(图1)(饼图上面的数字代表在试验期间,从蜂蜜中检测到的植物花粉种数),将蜂蜜中鉴定的植物花粉种类分为两组蜂群蜂蜜中都含有的植物花粉种类、喂糖蜂群蜂蜜中特有的植物花粉种类和喂酚蜂群蜂蜜中特有的植物花粉种类三部分,两种饲喂条件下共同拜访的植物种类不到总拜访植物种数的30%。
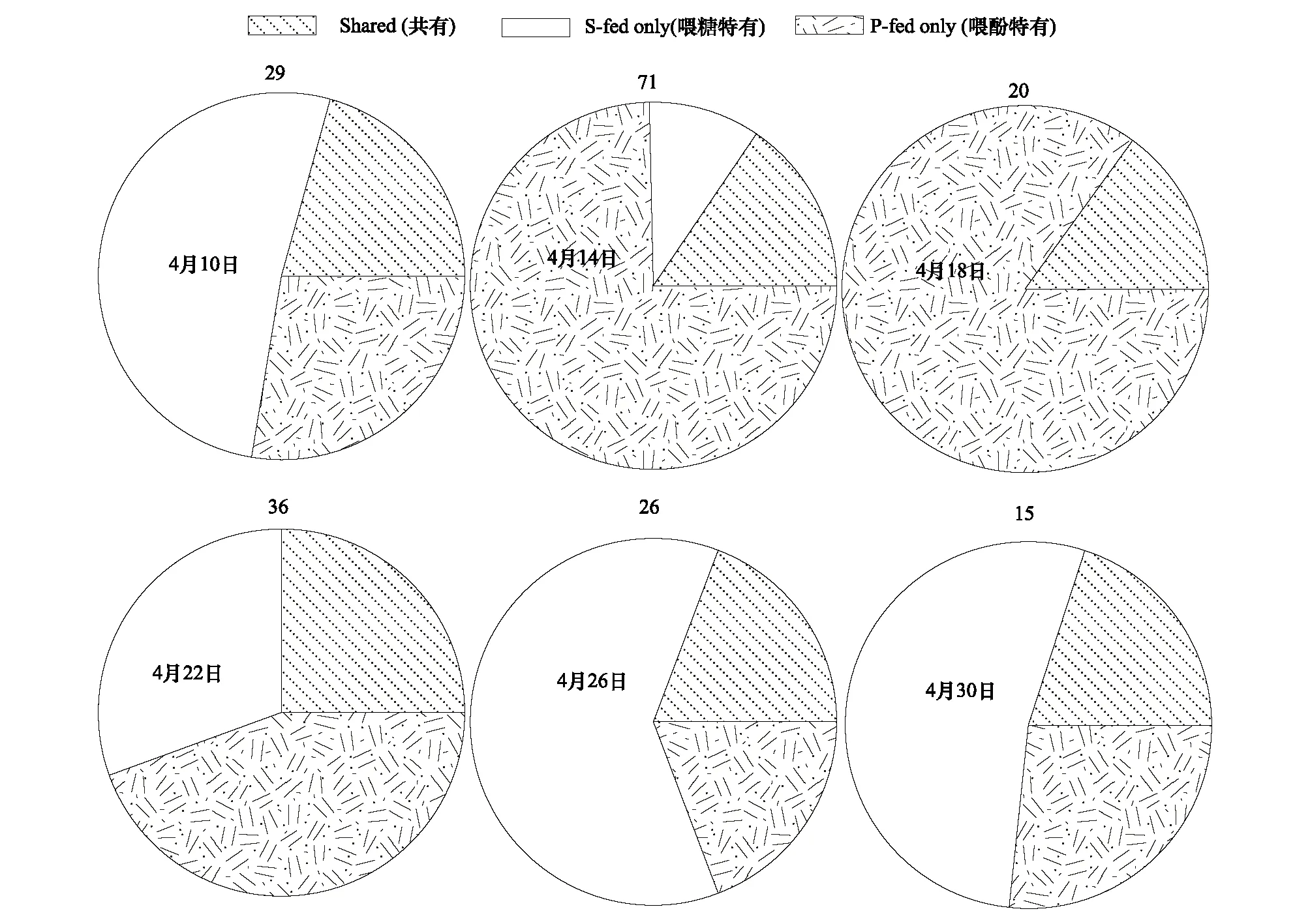
图1 两种饲喂条件下中蜂采集植物花粉种类

图2 花粉团中含1种以上植物花粉的采粉蜂比例(平均值±标准误)
2.2 两种饲喂条件下工蜂采集花粉团中花粉种类的差异
由于蜜蜂的采集工蜂具有采集的专一性,它们倾向于在一次出巢过程中只拜访一种植物,通过比较两种饲喂条件下采集工蜂花粉团中含有的植物花粉种类,发现喂糖组的单个工蜂在一次出巢采集过程中一般只拜访一种植物的花朵,而喂酚糖浆组的单个工蜂在一次出巢采集过程中倾向拜访多种植物的花朵,两组单个工蜂在一次出巢采集过程中拜访植物种数有显著差异(图2)。在6次取样过程中,喂酚糖浆组出巢工蜂在一次采集过程中拜访多种植物花朵的比例高于喂糖组 (对于4 月10 号、18 号、22 号、30 号:X2> 4.844, df=1,P<0.028),而另外两次取样的差异并不显著 (在4 月14 号:X2=2.761, df=1,P=0.097;在4 月26 号:X2=3.12, df=1,P=0.077)。
2.3 外界蜜源情况与蜜蜂选择采集多种植物花粉种类之间是否存在着关联
在本次试验期间的6次取样过程中,蜂蜜样品中观测到的植物种类数量范围为15—71种,定义30种以上为外界蜜源丰富,花粉团中含有的花粉种类也分为两级,只含有1种植物的花粉定义为一级,含有两种或两种以上定义为二级。分别对两种饲喂条件下蜜蜂采集的花粉团情况与外界蜜源情况作2×2列联表x2检验,分析蜜蜂采集花粉团的情况是否与外界蜜源情况存在着关联(表1)。
由于两组中总样本量﹥40,且所有的理论值都﹥5,所以选用Pearsonx2检验 (Pearson Chi-Square),说明在外界蜜源情况丰富的条件下有利于蜜蜂选择采集更多的植物种类,如果在外界蜜源情况不丰富的条件下,外界蜜源情况和蜜蜂拜访植物种类之间没有明显的关联。
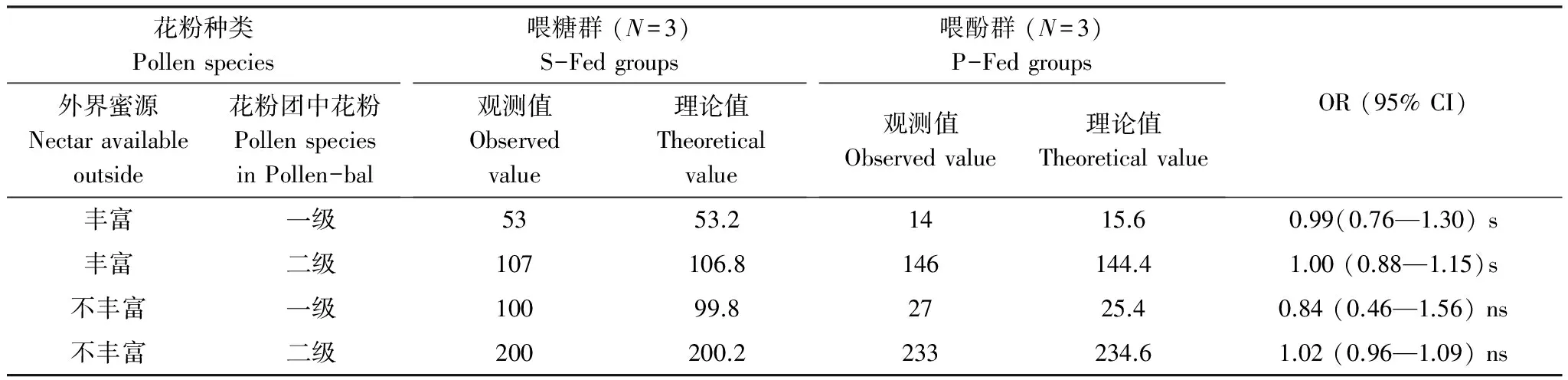
表1 外界蜜源情况与蜜蜂采集花粉团含有植物种类数的关系 2×2 列联表
OR: 比值比Odds ratio; CI: 置信区间Confidence interval, ns代表:P> 0.05, s代表:P﹤0.05
2.4 两种处理条件下中蜂蜜囊花蜜糖浓度的差异
两种饲喂条件下中蜂采集蜂蜜囊内的花蜜糖浓度存在显著差异,喂酚蜂群采集蜂蜜囊内的花蜜的含糖量(25.2195±0.70217)%明显高于喂糖蜂群采集蜂蜜囊内的花蜜的含糖量(20.09055±0.62871)%(P﹤0.01,df=104),见图3。
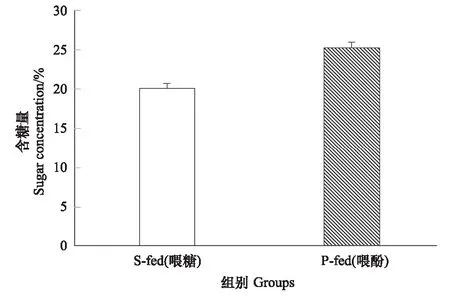
图3 喂纯糖浆组和喂酚糖浆组采集蜂蜜囊花蜜中的糖浓度 (平均值±标准误)
3 讨论
许多研究表明,随着全球温度的升高和大气CO2浓度的增加,植物体内的代谢物质也随之发生了变化[28-30]。例如,对春小麦灌浆期小麦粒化学成分的研究表明,在CO2浓度升高的情况下,麦粒中果糖、总蛋白减少,而游离氨基酸和可溶性蛋白有明显增加;另外,麦粒中葡萄糖、多糖、总糖分增加[30]。Coley等在巴拿马研究发现,CO2浓度升高在改变初级代谢产物的同时,也改变次生代谢物质的含量,尤其是酚类物质急剧增加47.6%[31]。
酚性物质是植物体内的重要次生代谢物质,具有趋避非传粉昆虫及盗蜜者以及抵御病原物入侵等重要生态功能。在长期的自然进化过程中,可能是植物-传粉昆虫之间的重要纽带。这些种类繁多的次生代谢产物,对昆虫选择食物的活动有很大的影响[32-33]。因此花粉和花蜜中次生代谢物质的变化可能会造成传粉昆虫的食性发生转移或偏好,引起蜜蜂采集植物种类的转移和食谱宽度的变化。从而导致自然状态下植物和传粉昆虫之间原有的关系错配。
Kleijn等人通过收集熊蜂身体上携带的花粉,比较了其在1950年以前与2004—2005年拜访植物的种类,发现熊蜂在两个时期拜访的植物种类有很大的差异[34]。但是,造成蜜蜂采集行为转移的机制尚不清楚。
通过对两种控制饲喂条件下的中蜂蜂蜜进行孢粉分析并同时比较两组处理条件下采集蜂携粉足上花粉团中含有的植物种类数及采集蜂蜜囊中花蜜的含糖量,发现尽管两组采集蜂采集的植物花粉种类的数量上没有明显差异,但却在选择采集的植物种类上有明显不同,除一小部分植物花粉种类在两组试验处理组的蜂蜜中都有发现外,在两组试验饲喂条件下的蜂蜜中还发现了特有的植物花粉种类(图1)。说明饲喂酚性物质以后蜜蜂在选择采集外界开花植物方面发生了转移或偏好,更倾向于采集含糖量较高的花蜜(含糖量:(25.2195±7.19506)%(图3),造成这种变化的原因可能是由于蜜蜂自身对酚性物质的调节机制。因为已经有一些研究发现蜜蜂体内的咽下腺蛋白能够对这些酚性物质进行降解,从而避免对自身的毒害作用,但是在降解过程中糖类物质是必需的[8]。另外蜜蜂能够感知巢内酚性物质含量的变化,从而调节自己的采集行为[35]。因此,蜜蜂食物中酚性物质含量的变化,可能就是造成蜜蜂选择采集的植物种类发生变化的原因,本研究为进一步研究过去几十年群落中传粉者-开花植物之间关系改变的原因提供了一个重要的线索。
蜜蜂对外界蜜源植物的利用具有很强的专一性,在一次出巢采集过程中倾向于拜访同一种开花植物,这不仅有利于蜜蜂采集花蜜和花粉效率的提高也有利于开花植物更好的完成授粉。尽管有一些研究表明,花蜜中的这些酚性物质能够减少传粉者的盗蜜活动,缩短访花时间,降低种内的的自交率[16,36]。但通过人工控制的饲喂试验发现喂酚组采集蜂相对于喂糖组在一次采集过程中明显更倾向于采集多种植物(图2),本次试验,根据外界蜜源的不同情况设计了2×2列联表并做了x2检验,发现在外界蜜源情况不是很丰富的情况下,蜜源情况与蜜蜂选择采集更多植物的花粉并不存在显著的关联,因此,蜜蜂食物中酚性物质含量的变化,可能是导致采集蜂采集专一性降低的原因。喂酚组工蜂对外界蜜源植物专一性降低,增加了同花期植物种间的花粉传播,这种不同物种的花粉即使落到雌蕊的柱头上也不能萌发,无法形成有效的授粉,从而有可能影响群落中同花期开花植物之间的传粉关系,造成群落中同花期开花植物传粉效率的降低。另外,喂酚组工蜂还倾向于采集花蜜中含糖量高的植物,这可能导致某些物种与传粉昆虫之间传粉适合度的降低。
因此,花蜜中的酚类物质含量的升高会导致蜜蜂选择采集植物种类的变化及对外界蜜源植物利用专一性的降低,进而影响群落中同花期植物之间的花粉传播,降低整个群落的传粉效率。
另外,已经有文献报道,在自然生态系统中,分泌含有次生代谢物质花蜜的植物通常需要依靠其他同花期的开花植物才能获得传粉的机会[37]。本研究表明,这些含有次生代谢物质的花蜜的确能够影响蜜蜂对植物的选择拜访行为,这些分泌含有次生代谢物质花蜜的植物与其他同花期的其他开花植物之间很可能存在着一种传粉共生的关系。
[1] Elias T S, Bentley B. The Biology of Nectaries. New York: Columbia University Press, 1983:126.
[2] Baker H G. Non-sugar chemical constituents of nectar. Apidologie, 1977, 8(4): 349-356.
[3] Adler L S. The ecological significance of toxic nectar. Oikos, 2000, 91(3): 409-420.
[4] Nicholson S W, Thornburg R. Nectsries and Nectar. Dordrecht: Springer-Verlag, 2007: 215-264.
[5] Baker H G, Baker I. Amino-acids in nectar and their evolutionary significance. Nature, 1973, 241(5391): 543-545.
[6] Faegri K, van der Pijl L. The Principles of Pollination Ecology. Oxford: Pergamon Press, 1979:67.
[7] Ohashi K, Natori S, Kubo T. Expression of amylase and glucose oxidase in the hypopharyngeal gland with an age-dependent role change of the worker honeybee (ApismelliferaL.). European Journal of Biochemistry, 1999, 265(1): 127-133.
[8] Liu F L, He J Z, Fu W J. Highly controlled nest homeostasis of honey bees helps deactivate phenolics in nectar. Naturwissenschaften, 2005, 92(6): 297-299.
[9] Baker H G, Baker I. Studies of nectar-constitution and pollinator-plant coevolution // Gilbert L E, Raven P H, eds. Coevolution of Animals and Plants. Austin: University of Texas Press, 1975: 100-140.
[10] Hagler J R, Buchmann S L. Honey bee (Hymenoptera: Apidae) foraging responses to phenolic-rich nectars. Journal of the Kansas Entomological Society, 1993, 66(2): 223-230.
[11] Singaravelan N, Nee′man G, Inbar M, Izhaki I. Feeding responses of free-flying honeybees to secondary compounds mimicking floral nectars. Journal of Chemical Ecology, 2005, 31(12): 2791-2804.
[12] Liu F, Chen J, Chai J, Zhang X, Bai X, He D, Roubik D W. Adaptive functions of defensive plant phenolics and a non-linear bee response to nectar components. Functional Ecology, 2007, 21(1): 96-100.
[13] Kretschmar J A, Baumann T W. Caffeine inCitrusflowers. Phytochemistry, 1999, 52(1): 19-23.
[14] London-Shafir I, Shafir S, Eisikowitch D. Amygdalin in almond nectar and pollen-facts and possible roles. Plant Systematics and Evolution, 2003, 238(1/4): 87-95.
[15] Tan K, Guo Y H, Nicolson S W, Radloff S E, Song Q S, Hepburn H R. Honeybee (Apiscerana) foraging responses to the toxic honey ofTripterygiumhypoglaucum(Celastraceae): changing threshold of nectar acceptability. Journal of Chemical Ecology, 2007, 33(12): 2209-2217.
[16] Irwin R E, Adler L S. Nectar secondary compounds affect self-pollen transfer: implications for female and male reproduction. Ecology, 2008, 89(8): 2207-2217.
[17] Gegear R J, Manson J S, Thomson J D. Ecological context influences pollinator deterrence by alkaloids in floral nectar. Ecology Letters, 2007, 10(5): 375-382.
[18] Mitchell B K, Sutcliffe J F. Sensory inhibition as a mechanism of feeding deterrence: effects of three alkaloids on leaf beetle feeding. Physiological Entomology, 1984, 9(1): 57-64.
[19] Dethier V G, Bowdan E. The effect of alkaloids on sugar receptors and the feeding behaviour of the blowfly. Physiological Entomology, 1989, 14(2): 127-136.
[20] Glendinning J I. How do herbivorous insects cope with noxious secondary plant compounds in their diet? Entomologia Experimentalis et Applicata, 2002, 104(1): 15-25.
[21] Ish-Am G, Eisikowitch D. The behaviour of honey bees (Apis mellifera) visiting avocado (Persea americana) flowers and their contribution to its pollination. Journal of Apicultural Research, 1993, 32(3/4): 175-186.
[22] Ish-Am G, Eisikowitch D. Low attractiveness of avocado (PerseaamericanaMill.) flowers to honeybees (ApismelliferaL.) limits fruit set in Israel. Journal of Horticultural Science and Biotechnology, 1998, 73(2): 195-204.
[23] Xue J Y, Tang J W, Sha L Q, Meng Y. Soil nutrient contents and their characteristics of seasonal changes undershoreachinensisforest in Xishuangbanna. Acta Phytoecologica Sinica, 2003, 27(3): 373-379.
[24] Cao M, Zou X M, Warren M, Zhu H. Tropical forests of Xishuangbanna, China. Biotropica, 2006, 38(3): 306-309.
[25] Zhu H. Forest vegetation of Xishuangbanna, south China. Forestry Studies in China, 2006, 8(2): 1-58.
[26] Lan G Y, Hu Y H, Cao M, Zhu H, Wang H, Zhou S S, Deng X B, Cui J Y, Huang J G, Liu L Y, Xu H L, Song J P, He Y C. Establishment of xishuangbanna tropical forest dynamics plot: species compositions and spatial distribution patterns. Journal of Plant Ecology, 2008, 32(2): 287-298.
[27] Yao L H, Jiang Y M, Singanusong R, Datta N, Raymont K. Phenolic acids in AustralianMelaleuca,Guioa,Lophostemon,BanksiaandHelianthushoneys and their potential for floral authentication. Food Research International, 2005, 38(6): 651-658.
[29] Rossi A M, Stiling P, Moon D C, Cattell M V, Drake B G. Induced defensive response of myrtle oak to foliar insect herbivory in ambient and elevated CO2. Journal of Chemical Ecology, 2004, 30(6): 1143-1152.
[30] Chen F J, Wu G, Ge F, Parajulee M N, Shrestha R B. Effects of elevated CO2and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis et Applicata, 2005, 115(2): 341-350.
[31] Coley P D, Massa M, Lovelock C E, Winter K. Effects of elevated CO2on foliar chemistry of saplings of nine species of tropical tree. Oecologia, 2002, 133(1): 62-69.
[32] Qin J D, Wang C Z. The relation of interaction between insects and plants to evolution. Acta Entomologica Sinica, 2001, 44(3): 360-365.
[33] Potts S G, Vulliamy B, Dafni A, Ne′eman G, Willmer P. Linking bees and flowers: How do floral communities structure pollinator communities? Ecology, 2003, 84(10): 2628-2642.
[34] Kleijn D, Raemakers I. A retrospective analysis of pollen host plant use by stable and declining bumble bee species. Ecology, 2008, 89(7): 1811-1823.
[35] Liu F L, Zhang X W, Chai J P, Yang D R. Pollen phenolics and regulation of pollen foraging in honeybee colony. Behavioral Ecology and Sociobiology, 2006, 59(4): 582-588.
[36] Kessler D, Gase K, Baldwin I T. Field experiments with transformed plants reveal the sense of floral scents. Science, 2008, 321(5893): 1200-1202.
[37] Rhoades D F, Bergdahl J C. Adaptive significance of toxic nectar. The American Naturalist, 1981, 117(5): 798-803.
参考文献:
[23] 薛敬意, 唐建维, 沙丽清, 孟盈. 西双版纳望天树林土壤养分含量及其季节变化. 植物生态学报, 2003, 27(3): 373-379.
[26] 兰国玉, 胡跃华, 曹敏, 朱华, 王洪, 周仕顺, 邓晓保, 崔景云, 黄建国, 刘林云, 许海龙, 宋军平, 何有才. 西双版纳热带森林动态监测样地——树种组成与空间分布格局. 植物生态学报, 2008, 32(2): 287-298.
[32] 钦俊德, 王琛柱. 论昆虫与植物的相互作用和进化的关系. 昆虫学报, 2001, 44(3): 360-365.

