老年Ⅰ期非小细胞肺癌立体定向放疗疗效观察
张胜,曹远东,孙新臣,刘永彪,杨焱,唐心宇,李彩虹,李金凯,裴忠玲,王亭亭
(南京医科大学附属第一医院放疗中心,江苏南京 210029)
肺癌是国内发病率最高的恶性肿瘤,在城乡居民死因中居于首位[1-2]。迄今为止,手术仍是早期非小细胞肺癌(NSCLC)首选的治疗方法,但早期(Ⅰ期和部分Ⅱ期)确诊的NSCLC患者仅占所有NSCLC的30%[3],且这些患者中又有许多因年龄、医学原因不能或不愿接受手术治疗的,对于这部分患者放射治疗则成为重要的局部治疗手段[4-5]。常规分割放疗能够在一定程度上缓解症状,对于仅接受放疗者5年总生存率为13%,远低于手术治疗的31%~67%。近来发展起来的体部立体定向放疗(SBRT)表现出明显的量效关系,局部控制率明显改善,从而达到根治效果。现就采用SBRT治疗的老年Ⅰ期NSCLC患者的近期疗效进行回顾性分析,结果报道如下。
1 资料与方法
1.1 一般资料
2011年8月至2011年10月我院收治了5例行SBRT的老年Ⅰ期NSCLC患者(患者及家属拒绝手术治疗),详细资料见表1。其中1例患者年龄高达92岁,且患者合并高血压病、高脂血症,心血管疾病症状较明显,KPS评分50,患者及家属拒绝行纤支镜检查和经皮肺穿刺取病理,根据PET-CT影像学表现,右肺上叶类圆形结节影,有分叶及毛刺,SUV最大值5.7,邻近叶间裂牵拉、移位,动态CT检查提示结节逐渐增大,经放射科、胸外科、肿瘤内科、放疗科、介入科、综合内科等多科联合会诊临床诊断为肺癌Ⅰ期,经综合分析及患者家属知情同意后决定行SBRT。患者在治疗前、放疗结束后1、3个月均进行病史采集、体检以及尿常规、肝肾功能、心电图、腹部彩超、胸部CT检查。
1.2 治疗过程
1.2.1 模拟定位 首先患者仰卧在X线模拟机定位床上,双手上举握于固定手柄,根据患者相对舒适度感觉调整手柄高度,在X线透视下对好体中线,体膜固定,透视下通过等中心技术定位到肿瘤中心,在机架角0度及90度分别标出肿瘤范围,并于体表标记肿瘤范围及等中心标记,并记录下肿瘤上下及左右移动范围,随后在模拟CT下复位,在平静呼吸状态下行模拟CT扫描,CT层厚2 mm,层间距1 mm,扫描完成后通过局域网直接传入TPS。
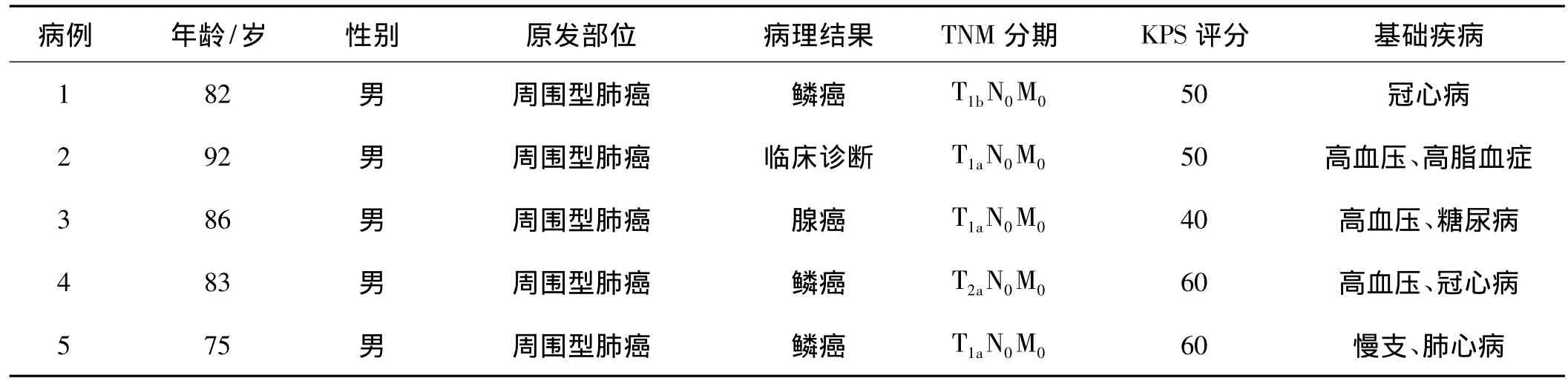
表1 患者详细资料
1.2.2 计划制定 在TPS中,由3名有经验的高年资主治以上放疗专科医师,其中至少1名副高以上职称参与靶区勾画。参考放疗前胸部CT或PET-CT结果,TPS中以肺窗影像学标准可见肿瘤病灶为GTV,GTV外放5~7 mm为CTV,根据透视下肿瘤移动范围确定ITV,同样对ITV给予外放3 mm形成 PTV50,PTV50外放3 mm为PTV28.4,根据解剖学因素作适当靶区调整。予6MV-X线,多野非共面适形放疗,治疗计划CTV 50 Gy/5 F,95%以上剂量线覆盖PTV50的靶区范围,靶区剂量分布满意后传入治疗系统,隔日放疗1次。
1.2.3 计划验证与执行 治疗计划传入X线模拟机控制系统中对患者进行复位,透视下观察照射野范围是否符合治疗计划要求,否则重新复位及制定计划;若计划满意,然后再在模拟CT上进行校位,测量肿瘤中心至前后左右体表距离是否跟TPS计划符合;复位和校位都满意的情况下再到加速器上进行验证,分别于0度和90度行EPID验证,完全符合临床要求且图像配对误差不超过1 mm时进行放疗,每次治疗前均按以上要求进行严格复位及位置验证。
1.3 疗效评价
放疗前后均做胸部CT等检查,评价疗效。肿瘤局部控制按照RECIST制定的疗效评定标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),以CR+PR计算有效率。分析胸部SBRT前、中、后患者的KPS体力状况评分变化。急性放射损伤按肿瘤治疗协作组(RTOG)的急性放射损伤分级标准评定。
2 结 果
2.1 近期疗效
放疗结束后1个月和3个月时分别行CT等检查评价疗效,结果见表2、3。
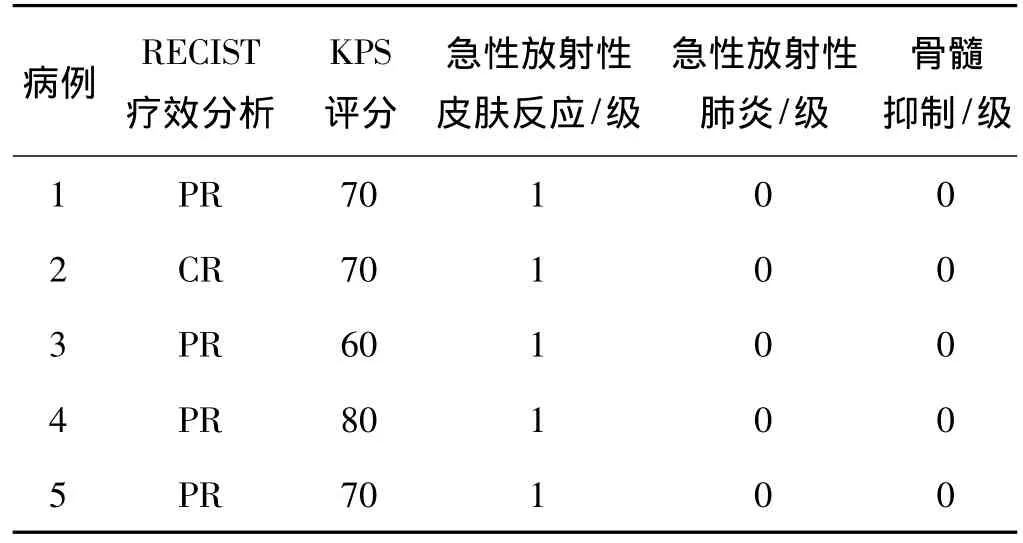
表2 放疗结束1个月时疗效及急性反应
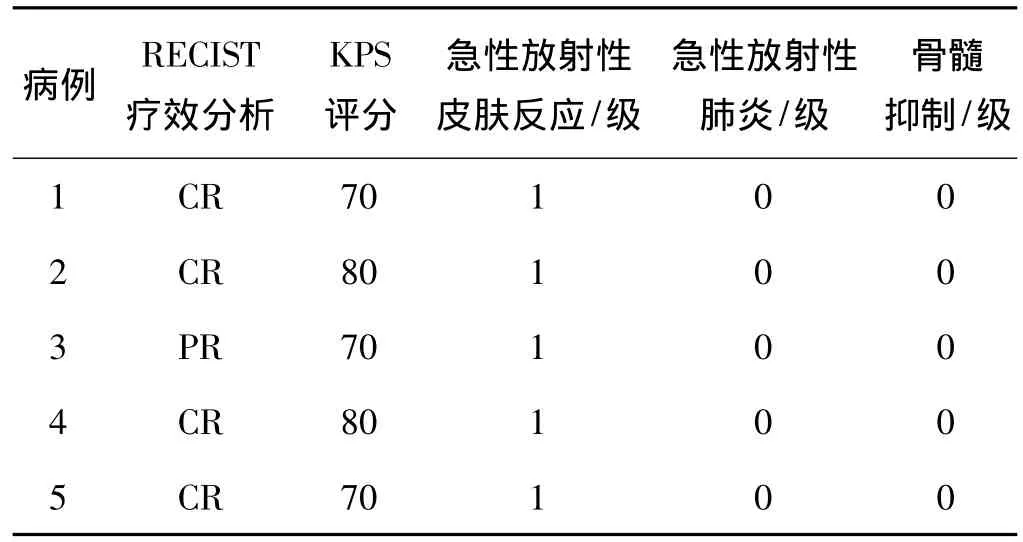
表3 放疗结束3个月时疗效及急性反应
2.2 放疗反应
胸部放疗反应多见为放射性肺炎、食管炎、皮肤反应及骨髓抑制等。本研究中没有发现可评价的急性放射性肺炎表现及骨髓抑制,5例患者中皮肤反应均为1 级(表2、3)。
3 讨 论
放射治疗是NSCLC重要的治疗手段,特别对于不适合手术或拒绝手术的病例,放疗尤为重要。随着老年早期肺癌患者的增多,因年龄因素不能或不愿接受手术治疗的患者也越来越多,但是,长期以来采用的常规放疗对于早期NSCLC的临床研究报道疗效均较差,多数5年生存率在30%以下,局部复发率较高,这显示了常规放疗技术在提高肿瘤局控率方面的局限性。放射生物学研究结果[6]表明,提高肿瘤剂量、减少正常组织受量可提高放疗疗效,但对于常规放疗技术已达到了一个瓶颈阶段,而影像技术、放射物理及计算机技术的发展,使得放疗在早期NSCLC中的应用日益引起关注,特别是近年来发展起来的SBRT技术,使得早期NSCLC的放疗效果可与手术相媲美,对于合并有较严重基础疾病或老年患者,SBRT在一定程度上优于手术治疗[7]。本回顾性分析结果令人鼓舞。
本回顾性分析发现,对于老年早期NSCLC,SBRT是一种有效、安全的治疗手段。老年患者多合并有慢性肺病、高血压、糖尿病等基础疾患,对于这些患者,即使不存在这些基础疾病,开胸手术对他们来讲都存在较大风险,何况在这些基础疾患的基础上手术风险更大,即使手术非常成功,但手术所带来的并发症多导致患者的生活质量严重下降,如心肺功能下降,甚至导致死亡[8]。常规放疗正常肺组织照射体积及受照剂量均较大,限制了肿瘤剂量的提高,导致治疗比低、生物学效应相应低下,直接导致疗效下降。目前临床上已经广泛使用的三维适形调强放疗技术使患者的体位可重复性、靶区的精确性均大大提高,肿瘤的治疗比有所提高,但常规分割仍不能达到理想的生物学效应。近年来发展的SBRT技术,在三维适形调强技术的基础上,结合放射物理及放射生物理论的最新进展,大分割低分次精确放疗对于不愿或不能手术的早期肿瘤成为首要选择,且表现出了明显优势[9]。本组病人中最小年龄在75岁以上,且均不同程度地合并有肺部慢性病、糖尿病、高血压等病变,手术风险大,且拒绝手术治疗,在签署放疗知情同意书的前提下予以SBRT治疗。结果发现,5例患者放疗后1个月复查CT发现原发病灶1例达CR,余4例为PR,3个月复查时则发现4例达CR,1例PR,有效率达100%,生活质量也明显改善,表明近期疗效显著。根据放射生物学中的线性二次方程进行生物有效剂量换算(α/β=10)可以发现,SBRT总剂量50 Gy/5 F,有效生物剂量为100 Gy,临床常规分割照射总剂量DT66 Gy/33 F,其有效生物剂量为79.2 Gy,因此SBRT高的有效率可以从放射生物学角度给以合理解释。再者,肿瘤复发绝大部分为局部复发,是死亡的重要原因[6],对于Ⅰ期肺癌,仅对原发部位及亚临床病灶给予高剂量放疗,符合临床要求。Rusthoven等[10]研究发现,SBRT治疗早期肺癌局部控制率好,而且区域淋巴结复发率也低,也支持SBRT应用于Ⅰ期NSCLC。本组疗效较文献报道有效率高,可能与病例数较少有关,但同样显示了较好的应用前景,有待扩大样本量进一步观察研究。
放疗副反应是影响放疗疗效和计划制定的直接因素,对于胸部放疗,放射性肺炎、放射性脊髓炎、放射性食管炎、放射性心脏病是计划制定过程中必须要考虑的。目前肺癌放疗采用的多为常规分割下的精确放疗技术,较既往常规放疗技术有了明显的进步,但周围重要器官仍受到较大剂量的照射[11]。本组患者中采用SBRT技术副反应较常规放疗技术明显低,尽管存在高龄、慢性肺病、心血管病,但均未出现可评价的放疗反应,原因分析如下:(1)5例患者均为周围性肺癌,且照射野尽可能避开脊髓、食管及心脏,纵隔几乎没有受量,因此其受量远低于其正常组织限量;(2)5例患者的原发病灶最大直径不超过5 cm,通过计划系统多野精确适形,靶区外几乎不存在大范围高剂量区,严格限制V20(V20≤20%),因此近期未观察到急性放射性肺炎发生;(3)由于照射范围小,胸壁受照剂量不高,对造血系统影响较小,未见有骨髓抑制发生。SBRT较γ刀有如下优点:加速器通过MLC对每个野进行适形,不仅可使肿瘤内达到处方剂量,肿瘤外正常组织低剂量,且SBRT剂量分布均匀度和适形度均较γ刀好,但SBRT靶区外剂量衰减梯度变化较为缓慢,50%等剂量线范围较大,虽经过多向给野及优化,正常组织低剂量体积仍较大,远期放疗反应可能会比较明显,这有待于扩大样本量及进一步的随访观察。
总之,SBRT治疗老年Ⅰ期NSCLC是一种安全、有效的治疗手段,其治疗时间短,放疗反应轻,对合并有基础疾病、老年、肺功能不佳的患者也能耐受,避免了反复摆位造成的患者依从性下降,提高了生活质量,并且在增加疗效的基础上节省了大量医疗资源,也大大降低了患者的经济负担,可能为将来发展的一个方向[12]。但限于本研究病例数少,观察时间短,SBRT治疗早期肺癌的最佳适应证、最佳时间剂量分割模式、远期疗效、放疗晚反应损伤等还有待进一步的前瞻性临床研究[13]。
[1]钱峰.肺癌成我国恶性肿瘤首位死因[J].中国社区医师:医学专业,2008,10(10):27-27.
[2]张欣贺,施雪峰,王志铭.CT检查联合VEGF-C表达检测在非小细胞肺癌淋巴结转移诊断中的价值[J].东南大学学报:医学版,2011,30(3):460-463.
[3]SPIRA A,ETTINGER D S.Multidisciplinary management of lung cancer[J].N Engl J Med,2004,350(4):379-392.
[4]叶宏勋,刘阳晨,高飞,等.立体定向适形放疗配合常规放疗治疗非小细胞肺癌的近期疗效观察[J].临床肿瘤学杂志,2004,9(6):655-656.
[5]成红艳,孙新臣,陈宝安,等.低剂量紫杉醇持续静脉滴注联合顺铂治疗晚期非小细胞肺癌疗效观察[J].东南大学学报:医学版,2010,29(4):410-413.
[6]殷蔚伯,谷铣之.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:222-223,578.
[7]ALTORKI N K.Stereotactic body radiation therapy versus wedge resection for medically inoperable stageⅠlung cancer:tailored therapy or one size fits all[J].JCO,2010,28(6):905-907.
[8]CHI A,TOME WA,FOWLER J,et al.Stereotactic body radiation therapy in non-small-cell lung cancer:linking radiobiological modeling and clinical outcome[J].Am J Clin Oncol,2011,34(4):432-441.
[9]JEPPESEN S,SCHYTTE T,JENSEN H R,et al.Stereotactic body radiationtherapy versus high-dose conventional radiationtherapy in early-stage NSCLC:a retrospective study on local failure and survival rates[J].J Clin Oncol(Meeting Abstracts),2011,29(15 Suppl):7049.
[10]RUSTHOVEN K E,PUGH T J.Stereotactic body radiation therapy for inoperable lung cancer[J].JAMA,2010,303(23):2354-2355.
[11]张金忠,戈伟,张园如,等.CT/CT图像融合用于非小细胞肺癌放射治疗对V20及放射性肺炎影响的临床研究[J].临床肿瘤学杂志,2011,16(2):154-157.
[12]HIRAOKA M,MATSUOY,TAKAYAMA K.Stereotactic body radiation therapy for lung cancer:achievements and perspectives[J].Japanese Journal of Clinical Oncology,2010,40(9):846-854.
[13]TIMMERMAN R,HEINZERLING J,ABDULRAHMAN R,et al.Stereotactic body radiation therapy for thoracic cancers:recommendations for patient selection,setup and therapy[J].Front Radiat Ther Oncol,2011,43:395-411.

