2010秋季东海今生颗石藻的空间分布
靳少非,孙 军 ,刘志亮
(1.中国科学院海洋研究所,青岛 266071;2.天津科技大学海洋科学与工程学院,天津 300457;3.中国水产科学院东海水产研究所,上海 200090;4.中国科学院研究生院,北京 100049)
东海作为西北太平洋中最大的边缘海,具有广阔的大陆架,既受到携带大量营养盐输入的长江径流影响,又有高盐的黑潮流经。复杂的生态环境、较大的渔业压力,使得东海成为全球变化研究典型性海域[1-3]。
今生颗石藻(living coccolithophore)是当今海洋中重要的一类单细胞、具有碳酸钙钙化外壳的浮游植物类群。其独特的碳酸盐反向泵机制对于研究某一特定海区生物碳通量具有决定意义[4],同时,今生颗石藻通过产生碳酸钙外壳——称之为颗石粒(coccolith)——沉降作为重要的海洋碳汇来源[5]。结合今生颗石藻群集样品镜检或自动化识别系统辨识,可由丰度转化计算今生颗石藻所产生的碳酸钙量[6-7]。
虽然Furuya[8-9]报道过东海PN断面垂直水层今生颗石藻,但由于所采取的观测手段,并不能完全真实地反映今生颗石藻丰度、分布等相关生态学信息,故东海今生颗石藻研究仍处于表层海水物种基本信息摸索阶段[3,10-12]。东海复杂的流系以及多变生物生存环境(长江冲淡水注入、赤潮多发等),使得仅通过表层海水研究远不能全面了解今生颗石藻生态学特性。
本研究目的在于了解不同断面(PN断面、沿岸流断面、黑潮区断面)、不同水层东海今生颗石藻空间分布特征,研究其生态动力学机制,并为下一步研究今生颗石藻生理生态及其元素地球化学循环等相关研究提供基础的生态学数据。
1 材料和方法
1.1 航次调查和样品采集
本次调查区域位于东海(120°—128°E,25°—32°N),调查时间为2010年11月27至12月5日,详细调查站位见图1,其中根据研究需要将调查海域划分为PN断面、沿岸流断面以及黑潮断面(图1)。今生颗石藻取样方法为:从CTD采水系统中按照不同采样层次采集300 mL—1 L体积不等的海水现场过滤至直径25 mm,0.22 μm 聚碳酸酯滤膜上,过滤压力 <300×133.322Pa。过滤后,将滤膜放入事先编好号码的培养皿中,风干或烘箱中40℃下烘干。干燥后,剪取一定面积滤膜,中性树胶将其固定至载玻片上并封片,烘箱中60℃下烘干或长时间将其阴干均可。所调查水层温度、盐度用SeaBird CTD现场测定。
1.2 今生颗石藻样品分析及丰度计算
实验室内,今生颗石藻镜检工作采用Motic偏光显微镜(BA300型)1000×放大倍率下进行。由于偏光显微镜的工作原理以及制片、观察过程中一些非人为的失误(如剪取的滤膜在载玻片上的位置、一次放入中性树胶的量、海雪粪球等在视野中出现等)都可能影响镜检工作,因此不可能记录所有的视野,所以镜检过程中要记录所观察的视野数。每次镜检视野数由所观察站位颗石球丰度决定,但每样品至少检测300个颗石粒或100个颗石球,关于镜检过程中其他注意事项参照Bollmann等[13]。样品镜检过程中,颗石粒、细胞分别计数,各自进行丰度计算。
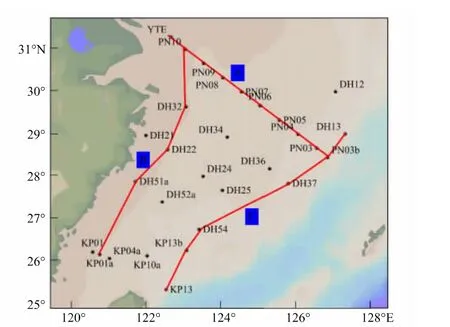
图1 2010年秋季东海今生颗石藻采样站位图Fig.1 Sampling stations of living coccolithophores in the East China Sea in autumn 2010
颗石粒/颗石球丰度计算公式参照孙军等[14]所给出的公式。
颗石粒/细胞优势度指数(Y)、相对丰度(P)计算公式分别为:

式中,Y为物种的优势度,N为采集样品中所有物种的总个体数,ni为第i种的总个体数,P为该种在样品中的颗石球丰度概率,fi则为该种在各样品中出现频率。
2 结果
2.1 调查区水文环境资料
本次调查区域内表层温度、盐度分布如图2A、B,调查区域水温介于16.9—25.8℃,盐度为25.3—34.7之间,表层温度由近岸至外海增加趋势明显,盐度近岸处变化较为剧烈;PN断面(图2C、D)温度与盐度变化显示调查时陆架区有强烈的垂直混合。
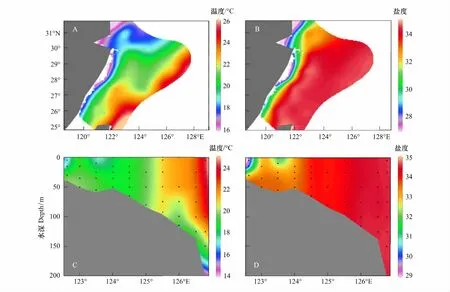
图2 调查区域表层温度、盐度以及PN断面温度、盐度剖面Fig.2 Distribution of temperature,salinity in the surface layer and PN Section
2.2 今生颗石藻物种组成
本调查航次共鉴定今生颗石藻26种(不包括未定种),常见物种为大洋桥石藻(Gephyrocapsa oceanica)、赫氏艾密里藻(Emiliania huxleyi)、卡特螺旋球藻(Helicosphaera carteri)、粗壮环翼球藻(Algirosphaera robusta)、希布格脐球藻(Umbilicosphaera sibogae)、细孔钙盘藻(Calcidiscus leptoporus)、条结藻属(Syracosphaera spp.)(见表1)。颗石粒与颗石球出现频率最高的两种均为大洋桥石藻(95.37%与87.04%)和赫氏艾密里藻(94.44%与80.56%),此两物种颗石粒及颗石球相对丰度之和分别可达96.0%和88.6%,在东海今生颗石藻中占据绝对优势。此外,卡特螺旋球藻和粗壮环翼球藻颗石粒与颗石球中也具有较高的出现频率(83.33%与25.00%和49.07%与32.41%),但其相对丰度较低(1.13%与3.89%和1.01%与1.01%)。

表1 2010年秋季东海今生颗石藻常见物种*Table 1 Common living coccolithophores of the East China Sea in autumn,2010
2.3 颗石球丰度分布
2.3.1 不同水层颗石粒以及颗石球丰度分布
本次调查中颗石粒总丰度介于0—4506.47个/mL,平均值为613.44个/mL,颗石球丰度介于0—76.562个/mL,平均值为18.641个/mL。不同水层颗石粒:赫氏艾密里藻丰度在0—2205.00个/mL之间,平均值为257.84个/mL,大洋桥石藻丰度介于0—2232.56个/mL,平均值为331.31个/mL,出现频率达83.3%的卡特螺旋球藻丰度介于0—49.13个/mL,平均为6.92个/mL。不同水层颗石球:赫氏艾密里藻丰度在0—19.17个/mL之间,平均值为5.33个/mL,大洋桥石藻丰度介于0—76.56个/mL,平均值为11.20个/mL,出现频率为32.4%的粗壮环翼球藻丰度介于0—6.06个/L,平均为0.74个/L。0 m水层颗石粒与颗石藻细胞呈现不均匀“斑块”状,卡特螺旋球藻颗石球高值区有两个分别出现在近岸处以及外海黑潮区,而中间陆架区丰度较低;粗壮环翼球颗石球高值区则只出现在外海黑潮区(图3);底层颗石粒与颗石球呈明显的两个“斑状”,卡特螺旋球藻颗石粒在东海陆架区存在高值区,但颗石球丰度最大值区集中于外海(DH3断面),粗壮环翼球藻细胞高值区依然处于外海黑潮区(图4)。水层整体而言,底层颗石粒丰度普遍高于表层水体颗石粒丰度,颗石球并无显著规律性变化,且两者绝对丰度由近岸向外海有减少的趋势,由南向北有增多的趋势。
2.4 不同剖面颗石粒以及颗石球丰度
将此次调查分为3个断面进行分析,分别是具有河口区、陆架区、外海综合特征的PN断面、生态环境复杂多变的沿岸流断面以及受高温高盐黑潮影响的黑潮断面。

图3 今生颗石藻0m水层水平分布图Fig.3 Distribution of living coccolithophores at 0m depth
2.4.1 PN断面今生颗石藻空间分布
PN断面中,今生颗石藻颗石粒丰度在169.97—4506.47个/mL,平均值为1042.94个/mL,颗石球丰度介于0—76.56个/mL之间,平均值为21.01个/mL。图5所示,颗石粒由表层至底层增加趋势明显;但颗石球丰度在水柱分布中变化趋势不明显,高值区主要集中于PN断面陆架区(PN09、PN08站位及其附近),且调查过程中此两站位发生柔弱角毛藻(Chaetoceros debilis)水华。赫氏艾密里藻的颗石粒丰度介于0—2205个/mL,平均值为420.42个/mL,颗石球丰度在0—16.21个/mL之间,平均值为4.00个/mL;大洋桥石藻颗石粒丰度介于22.05—2232.56个/mL,平均值为578.19个/mL,颗石球丰度为0—76.56个/mL,平均值为15.61个/mL。水华发生站,大洋桥石藻丰度明显增加形成高值区。颗石粒与颗石球丰度占据绝对优势的赫氏艾密里藻和大洋桥石藻由近岸至外海减少趋势明显。PN断面物种由近岸站位水层的3种上升至外海站位水层的13种,总体呈现由近岸到外海增加的趋势。
2.4.2 近岸剖面
选取沿岸流断面主要为了来探讨近岸多变的环境因素对以今生颗石藻分布的影响,该断面在东海沿岸流流以及北部与长江径流交汇区。
沿岸流断面水层中,今生颗石藻颗石粒丰度在0—1178.1个/mL,平均值为550.74个/mL,颗石球丰度为0—34.65个/mL,平均值为16.91个/mL。赫氏艾密里藻的颗石粒丰度介于0—407.70个/mL,平均值为240.25个/mL,颗石球丰度为0—17.15个/mL,平均值为7.03个/mL;大洋桥石藻颗石粒丰度介于0—771.75个/mL,平均值为299.50个/mL,颗石球丰度为0—28.35个/mL,平均值为9.02个/mL。图6显示,今生颗石藻颗石粒以及细胞在沿岸流系中分布相对PN断面较为均匀,但由表层至底层有轻微的增加趋势,两者均并没有显著的高值区。

图4 底层水今生颗石藻分布图Fig.4 Distribution of living coccolithophores at the bottom layer

图5 PN剖面今生颗石藻垂直分布图Fig.5 Distribution of living coccolithophores in the PN section

图6 沿岸流断面今生颗石藻垂直分布图(图例解释见图5)Fig.6 Distribution of living coccolithophores at the Coastal Current Section(see fig.5 for the label meaning)
2.4.3 黑潮区今生颗石藻分布特征
黑潮流经站位中,今生颗石藻颗石粒丰度为0—563.76个/mL,平均值为180.01个/mL,颗石球丰度介于0—36.10个/mL,平均值为16.57个/mL。赫氏艾密里藻的颗石粒丰度介于0—333.51个/mL,平均值为87.70个/mL,颗石球丰度介于0—10.48个/mL,平均值为5.07个/mL;大洋桥石藻颗石粒丰度介于0—294.92个/mL,平均值为78.74个/mL,颗石球丰度为0—19.80个/mL,平均值为7.60个/mL。图7所示,水深超过200 m及水深小于200 m(除底层)的水柱中颗石粒有轻微的增多趋势,底层丰度为其它层次丰度数倍;今生颗石藻细胞则主要分布在25—80 m水层内。纬度方向上,颗石粒与细胞水层内(除表层外)分布较为均匀,表层水(0—5 m)由南至北出现不均匀的高值区。水层物种分布上,物种丰富度相对于近岸站位增加不少,仅DH13站位表层中就发现了13物种(包括未定种),该区域今生颗石藻物种丰富度明显增多,但物种丰度却明显小于近岸处。
2.5 三断面综合比较
图8表示的为本文所选取3个断面颗石球、颗石粒以及颗石粒与颗石球比值。由图8可得,除赫氏艾密里藻颗石球丰度为沿岸流区>黑潮区>PN断面外,均为PN断面>沿岸流区>黑潮区。颗石球丰度中,沿岸流断面总平均丰度只是略高于黑潮区平均丰度,而赫氏艾密里藻、大洋桥石藻均明显高于黑潮区平均丰度。
3 讨论和结论
本次调查过程中,除两种绝对优势种与前人所做调查一致(表2)外,卡特螺旋球藻、粗壮环翼球藻、条结藻属等物种也具有较高的出现频率。此现象的出现表明东海今生颗石藻物种具有其独特的地域特征,这是因为:赫氏艾密里藻为世界性物种,具有广温性[16];大洋桥石藻为一热带性或暖水性物种[17];而粗壮环翼球藻为一生活在下真光层物种[18],卡特螺旋球藻为一具有复杂生活习性的广温性物种[19-20]。生活特性差异较大的几个物种较高的出现频率表明,东海较强的水体混合(图2)以及底层泥沙悬浮所导致的综合环境效应对此海区的今生颗石藻种类分布有直接的影响。

图7 黑潮流经断面今生颗石藻垂直分布图(图例解释见图5)Fig.7 Distribution of living coccolithophores at the Kuroshio section(see fig.5 for the label meaning)
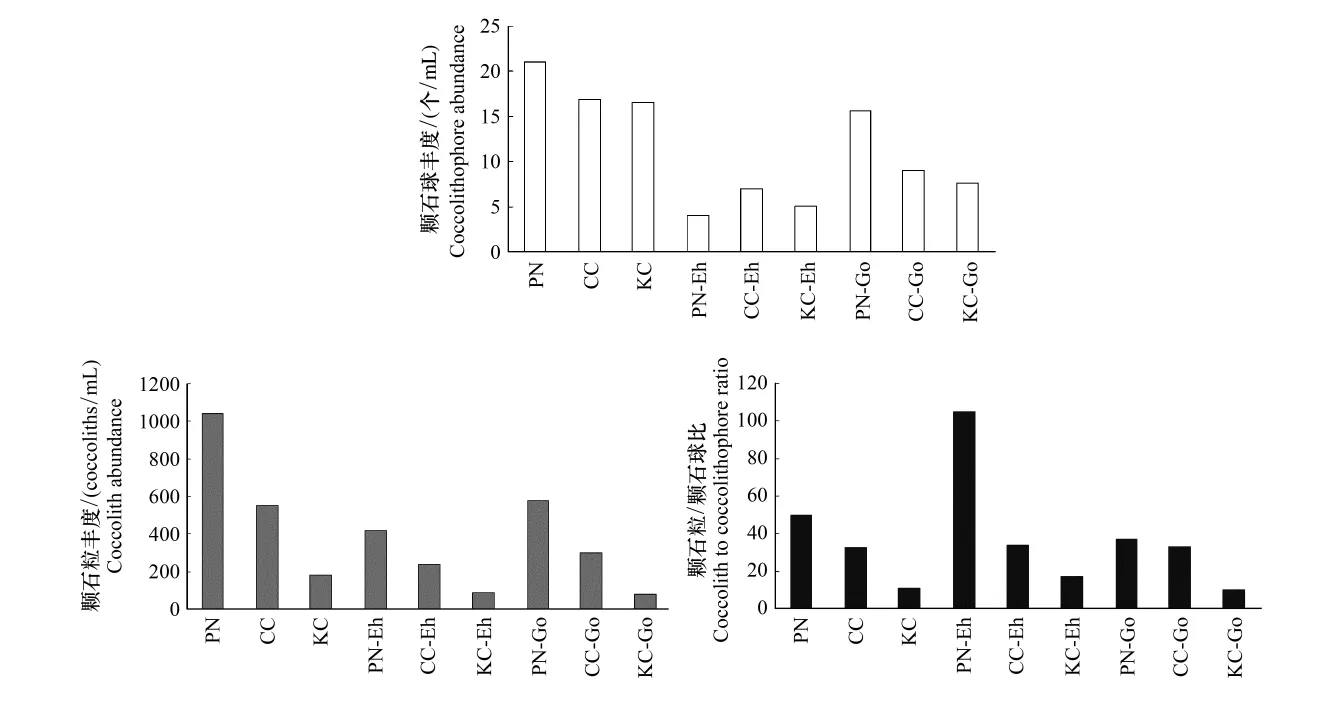
图8 三断面总颗石粒、细胞平均丰度、赫氏艾密里藻、大洋桥石藻颗石粒、细胞平均丰度比较Fig.8 Comparative among total coccoliths,total cells,coccoliths and cells between E.huxleyi and G.oceanica
汪品先[11]、Okada[10]、Furuya[8]在东海发现的今生颗石藻水体中样品物种丰富度均没有超过 4 种,Yang[3]于夏、冬季东海发现10种,Yang[12]在台湾东北部共发现41种。此次镜检共计26种,站位物种丰富度分布如图9所示,物种丰富度从海岸到外海有明显的增加趋势,这与东海表层沉积物分布相吻合[11],同时与Yang[3]在东海夏冬季表层水物种分布一致。东海近岸处今生颗石藻物种丰富度较少可能与调查区域较高的硝酸盐浓度有关[21-22]。

表2 水样中今生颗石藻历史资料对照*Table 2 Historical data of living coccolithophores assemblage in East China Sea
颗石藻与细胞在0 m水层的“斑状分布”以及底层“双斑状”分别与Yang[3]年夏季、冬季东海表层分布情形一致,表明颗石藻颗石粒及细胞在水层水平方向上分布存在极大的空间异质性。关于今生颗石藻的空间分布原因有不同的解释:Yang[3]推测温度、盐度是决定今生颗石藻不均匀分布的主要因素而非营养盐浓度;Okada[10]认为在东海表层水中仅两个站位发现颗石藻以及全部以畸形颗石粒存在可能是由于海水缺氮引起;Andruleit[23]在北部阿拉伯海调查时则认为决定颗石藻丰度的原因是混合层深度以及营养盐而不是温度盐度,同时硅藻的竞争也是制约今生颗石藻丰度的原因之一;Winter[24]在研究加勒比海研究发现今生颗石藻高值区分布在表层以及硝酸盐跃层上、DCM(叶绿素最大层)下方的下真光层区域;Mohan[22]研究南大洋45°E剖面时发现今生颗石藻丰度、物种丰富度与硅酸盐浓度呈反比。东海复杂的生态环境以及调查取样时环境区域特异性等不定因素,我们无法确切得到东海今生颗石藻分布与环境因子之间的相互关系,解释今生颗石藻分布空间差异性还需要结合更多的环境、生物参数以及长期调查分析。但是结合今生颗石藻的生活策略选择(富营养区域为r选择策略;寡营养区域为K选择策略)[25-26],可以结合调查时得到的颗石粒/颗石球丰度反演该区域环境因素,为此,推测今生颗石藻细胞出现“斑块状”现象可能原因为以下解释。近岸海域:营养盐较为丰富,有利于今生颗石藻细胞生长,伴随着与其他藻类竞争生存,加之生存环境多变,r生活策略的选择使得“斑块状”现象出现为一随机事件;外海区域:营养盐为其主要限制因素,今生颗石藻水层内变化较为平稳(25—80 m),K生活策略选择使得颗石藻有高的竞争力[26],从而出现水柱内细胞变化平稳的现象,不同物种高值区分布区域不同则可能由于不同生活史过程及其种间竞争所引起[20,27]。另外一个重要原因是取样的时间与地点,由于调查航次和分析难度等限制,获取和分析的样品量还较少,这会造成作图时空间和时间分布上不连续现象。
发生水华的两个站位中,颗石球丰度出现本次调查海域最大值(PN09-25 m水层为76.56个/mL)。尤其大洋桥石藻几乎占到全部水层细胞颗石球丰度的94%。此现象验证了营养盐丰富的环境有助于颗石藻细胞生长[26],但在外海营养盐浓度相对较低(尤其是磷酸盐浓度较低)的环境中,会有颗石藻丰度的绝对值低但在浮游植物群集中比例相对高的现象[8-9,21,26]。

图9 水柱物种丰富度分布图Fig.9 Water column integrated distribution of species richness
东海PN断面研究已经有大量浮游植物历史资料,但涉及今生颗石藻研究依然处于起步阶段[8-9,28]。Furuya等[8]利用倒置显微镜镜检得出颗石球丰度在PN断面相对丰度从岸边的20%上升至外海的60%,其绝对丰度由河口区、陆架区、海盆区逐渐下降,虽然Furuya等[9]通过HPLC得出与上述一致的趋势,但相对丰度值却有所不同,这可能与不同调查方法精度以及采样时间不同有直接的关系。由于没有其他物种的信息的支持,无法得到今生颗石藻细胞在本次PN断面浮游植物群集中所占的份额,但绝对丰度得到了与Furuya等相同的研究趋势(图5),且物种丰富度在具有大洋性质的外海有了明显增加与Yang[3]研究一致(图9)。
东海沿岸流系中,温度、盐度以及其他环境参数具有较高的复杂性,研究今生颗石藻在变化迅速、多样的环境下的分布特征对了解今生颗石藻的生理生态作用有重要的作用[29]。图6中显示,今生颗石藻颗石粒以及细胞在沿岸流系中分布较均匀,并没有显著的高值区,且丰度小于PN断面丰度。世界其他近岸区域亦有许多相关的研究,但结果却相差很大,下加利福尼亚(Baja California)西海岸发现不同季节、不同物理环境下今生颗石藻丰度有相当大的不同[30];东地中海的多个航次调查研究中发现了较高生物多样性的今生颗石藻群集[31],此外,利用遥感卫星监测,该区域今生颗石藻遥感图像有较大的差别[32-33],遥感卫星图像所显示的差别应该与所监测时间序列长度不同有直接的关系,由此可以推断本区域中今生颗石藻有着较大的时间序列变异性。另外,本次调查中,区域内26.5—28°N没有发现颗石藻,也没有发现颗石粒,出现这样的原因是由于采样季节、采样站位较少以及过多泥沙影响镜检而引起的偶然事件,本次调查中,由于泥沙的影响而无法进行进行镜检的还有:YTE-35m层、DH21、DH51全部水层,此3站位均为水深较浅站位(水深分别为39、16、19 m),过多的泥沙搅动干扰对于>150 mL水样体积的过滤会有很大的影响。因此对该区域的今生颗石藻研究应该在不同季节、不同环境下进行长时间连续观测,类似的观测在葡萄牙里斯本外上升流区已有报道[34-35]。
东海黑潮区是西太平区域今生颗石藻研究热点区域之一[3,10-12,17,36]。此次调查中,该剖面水深小于200 m的站位中,底层颗石粒突然增多的现象与孙军等[14]在南海水深<200 m所研究一致,源自于底部沉积颗石粒再悬浮以及颗石藻细胞死亡后沉降至底部颗石粒脱落而致。与之相反的是,整个黑潮区剖面中(除底层外),颗石粒与细胞在纬度方向上分布相对于PN断面比较均匀;推断这可能与黑潮影响水域中,营养盐下行控制起主导作用外,黑潮中段均匀流速以及相应发生的颗石粒/细胞侧向输送相互影响有一定的关联[2,21,26,37],但由于没有以往颗石粒以及细胞水柱分布的相关历史资料对比,无法确定导致大范围内颗石球丰度分布较为均匀的现象发生的必然性。Yang[12]在台湾东北区表层海水中利用SEM鉴定出41种今生颗石藻,此次利用偏光显微镜鉴定出15种(未包括未定种),相对于近岸处2—3种,黑潮流经区今生颗石藻物种多样性明显增多,今生颗石藻相对丰度增多[9],并且有数据显示非钙化定鞭金藻门(今生颗石藻为定鞭金藻门钙化浮游植物类群)物种在大洋中为生态优势种以及具有较高的生物多样性[38]。目前还没有关于定鞭金藻门钙化类群与非钙化类群之间相互转化关系确切的解释[27],因此该区域为研究今生颗石藻复杂生理生态作用提供良好的地理资源。
长江径流所带来营养盐的大量输入、高盐高温黑潮水流经以及此次调查过程中赤潮发生影响使得PN断面颗石粒、细胞分布相比于其他两断面具有独特的区域层次性。颗石粒分布中,陆架沿岸流剖面大于外海黑潮区剖面,这与沉积物记录结果较为一致[11,39],而这两个断面的颗石球丰度则相差无几,物种丰富度相差较大,出现这样的情形与两断面硝酸盐浓度不同以及今生颗石藻不同环境中不同生活策略的选择有一定的关系[21-22,26]。
通过调查研究初步分析了东海今生颗石藻独特的分布特征以及不同生境下今生颗石藻所表现出特异群集发生的原因,为以后东海今生颗石藻研究及其他相关学科研究提供了基础研究数据。基于基础分布特征,后续的研究应该集中于全面解决今生颗石藻“斑状”等分布特性产生原因、年际分布特征、不同环境下今生颗石藻形态学特征以及赤潮发生时今生颗石藻的相对响应等相关方向,继而为研究今生颗石藻面对全球变化响应及反馈提供基础资料。
[1] Ning X R,Liu Z L,Shi J X.Assessment of potential fishery production and primary productivity in Bohai,Huanghai and Donghai.Acta Oceanologica Sinica,1995,17(3):72-84.
[2] Zhang Y,Wu D X,Lin X P.Seasonal variation of the water mass distribution along the PN section in the East China Sea.Periodical of Ocean University of China,2009,39(3):369-374.
[3] Yang T N,Wei K Y,Chen M P,Ji S J,Gong G C,Lin F J,Lee T Q.Summer and winter distribution and malformation of coccolithophores in the East China Sea.Micropaleontology,2004,50(Suppl1):157-170.
[4] Sun J.Organic carbon pump and carbonate counter pump of living coccolithophorid.Advances in Earth Science,2007,22(12):1231-1239.
[5] Iglesias-Rodriguez M D,Halloran P R,Rickaby R E M,Hall I R,Colmenero-Hidalgo E,Gittins J R,Green D R H,Tyrrell T,Gibbs S J,von Dassow P,Rehm E,Armbrust E V,Boessenkool K P.Phytoplankton calcification in a high-CO2world.Science,2008,320(5874):336-340.
[6] Young J R,Ziveri P.Calculation of coccolith volume and it use in calibration of carbonate flux estimates.Deep-Sea Research PartⅡ-Topical Studies in Oceanography,2000,47(9/11):1679-1700.
[7] Beaufort L,Couapel M,Buchet N,Claustre H,Goyet C.Calcite production by coccolithophores in the south east Pacific Ocean.Biogeosciences,2008,5(4):1101-1117.
[8] Furuya K,Kurita K,Odate T.Distribution of phytoplankton in the East China Sea in the winter of 1993.Journal of Oceanography,1996,52(3):323-333.
[9] Furuya K,Hayashi M,Yabushita Y,Ishikawa A.Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures.Deep-Sea Research Part II:Topical Studies in Oceanography,2003,50(2):367-387.
[10] Okada H,Honjo S.Distribution of coccolithophores in marginal seas along the Western Pacific Ocean and in the Red Sea.Marine Biology,1975,31(3):271-285.
[11] Wang P X,Cheng X R.Distribution of calcareous nannoplankton in sediments of the East China Sea.Acta Oceanologica Sinica,1988,10(1):76-87.
[12] Yang T N,Wei K Y,Gong G C.Distribution of coccolithophorids and coccoliths in surface ocean off northeastern Taiwan.Botanical Bulletin of Academia Sinica,2001,42:287-302.
[13] Bollmann J,Cortés M Y,Haidar A T,Brabec B,Close A,Hofmann R,Palma S,Tupas L,Thierstein H R.Techniques for quantitative analyses of calcareous marine phytoplankton.Marine Micropaleontology,2002,44(3/4):163-185.
[14] Sun J,An B Z,Dai M H,Li T G.Living coccolithophores in the Western South China Sea in summer 2007.Oceanologia Et Limnologia Sinica,2011,42(2):170-178.
[15] Sun J,Jin S F.Species diversity of living coccolithophores in Chinese sea waters.Biodiversity Science,2011,19(6):787-797.
[16] Paasche E.A review of the coccolithophorid Emiliania huxleyi(Prymnesiophyceae),with particular reference to growth,coccolith formation,and calcification-photosynthesis interactions.Phycologia,2001,40(6):503-529.
[17] Okada H.Modern coccolithophoridae in the Pacific Ocean[D].Sapporo(Japan):Hokkaido University,1971.
[18] Probert I,Fresnel J,Billard C,Geisen M,Young J R.Light and electron microscope observations of Algirosphaera robusta(Prymnesiophyceae).Journal of Phycology,2007,43(2):319-332.
[19] Okada H,McIntyre A.Seasonal distribution of modern coccolithophores in the Western North-Atlantic Ocean.Marine Biology,1979,54(4):319-328.
[20] Cros L,Kleijne A,Zeltner A,Billard C,Young J R.New examples of holococcolith-heterococcolith combination coccospheres and their implications for coccolithophorid biology.Marine Micropaleontology,2000,39(1/4):1-34.
[21] Gao S Q,Lin Y A,Jin M M,Gao D W.Distribution features of nutrients and nutrient structure in the East China Sea and the Yellow Sea in spring and autumn.Donghai Marine Science,2004,22(4):38-50.
[22] Mohan R,Mergulhao L P,Guptha M V S,Rajakurnar A,Thamban M,AnilKurnar N,Sudhakar M,Ravindra R.Ecology of coccolithophores in the Indian sector of the Southern Ocean.Marine Micropaleontology,2008,67(1/2):30-45.
[23] Andruleit H,Stäger S,Rogalla U,Cˇepek P.Living coccolithophores in the northern Arabian Sea:ecological tolerances and environmental control.Marine Micropaleontology,2003,49(1/2):157-181.
[24] Winter A,Rost B,Hilbrecht H,Elbrächter M.Vertical and horizontal distribution of coccolithophores in the Caribbean Sea.Geo-Marine Letters,2002,22(3):150-161.
[25] Kinkel H,Baumann K H,Cˇepek M.Coccolithophores in the equatorial Atlantic Ocean:response to seasonal and Late Quaternary surface water variability.Marine Micropaleontology,2000,39(1/4):87-112.
[26] Baumann K H,Andruleit H A,Böckel B,Geisen M,Kinel H.The significance of extant coccolithophores as indicators of ocean water masses,surface temperature,and palaeoproductivity:a review.Paläontologische Zeitschrift,2005,79(1):93-112.
[27] de Vargas C,Aubry M P,Probert I,Young J.The origin and evolution of coccolithophores:form coastal hunters to oceanic farmers//Falkowski P G,Knoll A H,eds.Evolution of Primary Producers in the Sea.Amsterdam:Elsevier Academic,2007:251-286.
[28] Chen J X,Huang B Q,Liu Y,Cao Z R,Hong H S.Phytoplankton community structure in the transects across East China Sea and Northern South China Sea determined by analysis of HPLC photosynthetic pigment signatures.Advances in Earth Science,2006,21(7):738-746.
[29] Ramos J B E,Müller M N,Riebesell U.Short-term response of the coccolithophore Emiliania huxleyi to an abrupt change in seawater carbon dioxide concentrations.Biogeosciences,2010,7(1):177-186.
[30] Hernández-Becerril D U,Bravo-Sierra E,Aké-Castillo J A.Phytoplankton on the western coasts of Baja California in two different seasons in 1998.Scientia Marina,2007,71(4):735-743.
[31] Dimiza M D,Triantaphyllou M V,Dermitzakis M D.Seasonality and ecology of living coccolithophores in Eastern Mediterranean coastal environment(Andros Island,Middle Aegean Sea).Micropaleontology,2008,54(2):159-175.
[32] Brown C W,Yoder J A.Coccolithophorid blooms in the global ocean.Journal of Geophysical Research-Oceans,1994,99(C4):7467-7482.
[33] Iglesias-Rodríguez M D,Brown C W,Doney S C,Kleypas J,Kolber D,Kolber Z,Hayes P K,Falkowski P G.Representing key phytoplankton functional groups in ocean carbon cycle models:coccolithophorids.Global Biogeochemical Cycles,2002,16(4):1100, doi:10.1029/2001GB001454.
[34] Moita M T,Silva A,Palma S,Vilarinho M G.The coccolithophore summer-autumn assemblage in the upwelling waters of Portugal:patterns of mesoscale distribution(1985—2005).Estuarine Coastal and Shelf Science,2010,87(3):411-419.
[35] Silva A,Palma S,Moita M T.Coccolithophores in the upwelling waters of Portugal:four years of weekly distribution in Lisbon bay.Continental Shelf Research,2008,28(18):2601-2613.
[36] Hagino K,Okada H,Matsuoka H.Coccolithophore assemblages and morphotypes of Emiliania huxleyi in the boundary zone between the cold Oyashio and warm Kuroshio currents off the coast of Japan.Marine Micropaleontology,2005,55(1/2):19-47.
[37] Tanaka Y.Coccolith fluxes and species assemblages at the shelf edge and in the Okinawa Trough of the East China Sea.Deep-Sea Research Part Ii-Topical Studies in Oceanography,2003,50(2):503-511.
[38] Liu H,Probert I,Uitz J,Claustre H,Aris-Brosou S,Frada M,Not F,de Vargas C.Extreme diversity in noncalcifying haptophytes explains a major pigment paradox in open oceans.Proceedings of the National Academy of Sciences of the United States of America,2009,106(31):12803-12808.
[39] Zhang J J,Siesser W G.Calcareous nannoplankton in continental-shelf sediments,East China Sea.Micropaleontology,1986,32(3):271-281.
参考文献:
[1] 宁修仁,刘子琳,史君贤.渤、黄、东海初级生产力和潜在渔业生产量的评估.海洋学报,1995,17(3):72-84.
[2] 张媛,吴德星,林霄沛.东海PN断面水团分布的季节变化.中国海洋大学学报,2009,39(3):369-374.
[4] 孙军.今生颗石藻的有机碳泵和碳酸盐反向泵.地球科学进展,2007,22(12):1231-1239.
[11] 汪品先,成鑫荣.东海底质中钙质超徽化石的分布.海洋学报,1988,10(1):76-87.
[14] 孙军,安佰正,戴民汉,李铁刚.夏季南海西部今生颗石藻.海洋与湖沼,2011,42(2):170-178.
[15] 孙军,靳少非.中国近海今生颗石藻物种多样性初步研究.生物多样性,2011,19(6):787-797.
[21] 高生泉,林以安,金明明,高大伟.春、秋季东、黄海营养盐的分布变化特征及营养结构.东海海洋,2004,22(4):38-50.
[28] 陈纪新,黄邦钦,刘媛,曹振锐,洪华生.应用特征光合色素研究东海和南海北部浮游植物的群落结构.地球科学进展,2006,21(7):738-746.

