NO参与AM真菌与烟草共生过程
王 玮,赵方贵,侯丽霞,车永梅,刘 新
(青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,青岛 266109)
丛枝菌根真菌(arbuscular mycorrhiza,AM)是一种古老的营专性活体寄生的土壤微生物,可以与陆地上80%的高等植物共生,并形成菌根[1]。业已证明AM真菌可以促进植物对矿质元素(如氮、磷、钾等)的吸收[2-3],改善植物的根际微环境[4],提高植物的抗盐和抗旱等抵御逆境的能力[5],进而促进植物体的生长。在AM真菌与植物的共生过程中有一系列信号分子的传递,其中Ca2+是AM真菌共生体的早期信号物质[6],由AM真菌分泌产生的菌根形成因子(Myc因子)[7]经Ca2+信号的传递后,可诱导宿主合成和分泌诸多下游信号分子从而保证真菌随后侵染宿主并在宿主的根内延伸;宿主植物根部分泌类黄酮物质可以启动菌根-宿主植物共生体中的一些蛋白质的合成及一些其它化合物的分泌,刺激AM真菌孢子的萌发[8]。AM真菌与植物共生后还可以诱导植物根系中乙烯(ethylene,ETH)、水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)和过氧化氢(H2O2)等信号分子产生[9-10];Fester和 Hause[11]利用二氨基联苯胺(diaminobenzidine,DAB)等 3 种不同染色手段在被根内球囊霉(Glomus intraradices)侵染的玉米、烟草和苜蓿的根部和菌丝中均检测到H2O2。研究发现,AM真菌对由宿主根部所分泌的strigolactone(5-deoxy-strigol)能够做出快速强烈的反应[12],这说明在AM真菌与宿主植物根部之间存在有效的信号级联放大系统。目前虽已得知AM真菌可以诱导宿主植物分泌和产生多种信号分子,但是AM真菌与宿主之间的信号分子的种类及其信号转导机制还不甚很清楚。
一氧化氮(NO)是一种普遍存在于植物体内的内源性气体信号分子[13],参与了植物对气孔运动[14]、逆境应答[15]以及对植物生长发育的调控[16]等多种生理过程。植物中NO的主要来源于硝酸还原酶(NR)途径,植物中NR利用NAD(P)H作为电子供体,催化硝酸盐转变为亚硝酸盐,促进NO的生成[17]。有报道,NO专一性清除剂可以抑制萘乙酸对侧根生长的作用,说明NO可能作为信号分子参与生长素诱导的侧根生长过程[18]。AM真菌与宿主植物共生后能够促进宿主根系的延伸,吸收更多的营养物质,NO是否也作为信号分子参与共生过程,目前尚未见报道。
本实验以烟草为材料,苗期接种G.m,通过检测接种后烟草侧根中NO的含量、NR的活性以及nia-1基因的表达量,侧根和菌丝中NO的水平,以探究NO在AM真菌与烟草共生过程中的作用,为深入了解AM真菌与植物体共生的信号机制提供证据。
1 材料与方法
1.1 材料与试剂
供试烟草(Nicotiana tabacum,品种为CF90NF)由中国烟草公司青岛分公司提供。供试AM真菌为摩西球囊霉(Glomus mosseae,G.m)由青岛农业大学菌根技术实验室提供。AM真菌接种物为经三叶草扩繁后,含培养基质、孢子、菌丝和侵染根段的混合物。
NO供体硝普钠(sodium nitroprusside,SNP)、NO专一性荧光探针 DAF-2DA(4,5-diaminofluorescein diacetate,DAF-2 DA)、NO 清除剂 2-4,4,5,5-苯-四甲基咪唑-1-氧-3-氧化物(2-(4-carboxyphenyl)-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxidepotassium salt,cPTIO)、NR 抑制剂钨酸钠(sodium tungstate,Na2WO4)均购于Sigma公司(U.S.A);其余化学试剂均为国产分析纯。
1.2 材料处理
将烟草种子经10%NaClO灭菌15 min,无菌水冲洗5次后,点种于含草炭土∶土∶河沙=2∶2∶1的灭菌基质中,于25℃,16 h/8 h光周期,光强120—400μmol m-2s-1下培养。生长4周后取生长状态一致的烟草苗,移栽至含灭菌河沙的小盆中(直径×高=11.5 cm×8 cm),同时接种AM真菌G.m(接种量为菌种∶基质=1∶10)(对照为接种等量灭菌基质)。每两天喷施1/2Hoagland营养液。
在接种后的0、5、10、15、20和30d分别取烟草侧根,用蒸馏水将根部基质冲洗干净,用于测定内源的NO含量、NR活性、Nia-1基因表达量及侧根中NO的荧光强度。在接种后的20、25、30d用Tennant的方法[19]获得菌丝,用于NO的荧光检测。
在接种后5d开始向烟草根部基质中加入以下处理液:NO清除剂c-PTIO(2.0 mmol/L)、NO供体硝普钠SNP(1.0 mmol/L)、NR抑制剂钨酸钠(1 mmol/L),对照加入等量的1/2Hoagland营养液,分别在处理后10、15、20、25和30d取烟草侧根用于检测烟草侧根的侵染率,并在20d时分别取侧根和菌丝测定NO荧光强度。
1.3 方法
1.3.1 NO 含量和NR 活性的检测
用NO试剂盒(南京建成生物工程研究所)测定NO含量。取0.1 g烟草侧根加0.9%NaCl 0.9 mL,匀浆;12000×g离心10 min,取上清,沸水浴5 min;12000×g离心5 min,取上清,稀释10倍用于检测。在550 nm波长下,测定吸光度值,按照试剂盒说明,计算出组织中的NO水平。
用NR试剂盒(南京建成生物工程研究所)测定NR活性。取烟草侧根,洗净,用滤纸吸干后,放入诱导剂应用液中浸泡诱导2 h,取出用滤纸吸干,置于-20℃冷冻30 min后滤纸吸干并称取0.2 g,按重量体积比加入1.8 mL匀浆介质,冰浴研磨制成10%的匀浆液,4000 r/min离心10 min,取上清在550 nm波长下,测定吸光度值,按照试剂盒说明,计算出组织中的NR活力。
1.3.2 NO 的荧光检测
取不同处理的烟草侧根和菌丝,加入DAF-2DA(20μmol/L),25℃下避光孵育20 min,孵育完毕后用缓冲液冲洗,除去吸附的染料。将处理好的表皮条置于载玻片上,盖好盖片,用488 nm蓝光激发,经尼康(NikonTE2000)倒置荧光显微镜扫描获得根细胞和菌丝中NO的静态分布图。
1.3.3 Nia-1的荧光实时定量PCR检测
利用TriZol试剂盒提取烟草根系的总RNA,按照M-MLV反转录试剂盒说明书合成cDNA第1条链,作为模板,同时设立负对照。Real-time PCR的程序为:95℃ 5 min,95℃ 10 s,58℃ 10 s,72℃ 15 s,40个循环;Melt曲线从72℃至99℃,第1步维持45 s,以后每升高1℃ 维持5 s。Nia-1的正向和反向引物序列分别为5'-AATCAGGTGGATGGATGGCGAAG-3'和5'-TTCGCCATCCATCCACCT-3'。β-actin的正向和反向引物序列分别为5'-GATGAGTTGGGTGTTGCTCCT-3'和5'-GAAGTCCTCGTTGTTGCGTTG-3'。用熔解曲线法检测实时定量PCR产物的特异性,采用MyiQ software进行数据分析。
1.4 数据统计
所有结果都是3次重复的平均值±标准误差。测定结果用DPS数据处理系统进行方差分析。
2 结果与分析
2.1 AM真菌对烟草侧根和AM真菌NO的影响
2.1.1 AM真菌与烟草的共生过程烟草侧根NO含量的变化
利用分光光度法和NO的特异性荧光探针DAF-2DA分别检测了AM真菌与烟草共生过程中NO的变化。由图1可知,烟草侧根中含有一定水平的内源NO,接种AM真菌后烟草侧根中NO含量呈现先升高后降低的趋势,在苗期接种后10d达到最大值(P<0.05),同时烟草侧根中NO的荧光强度亦显著增强(图2A)。
cPTIO为NO清除剂,SNP为NO的供体,Na2WO4为的NO合成酶NR的抑制剂。为了进一步研究NO在AM真菌与烟草共生过程中的作用,在NO猝发时分别观测了NO清除剂、供体和合成酶抑制剂的作用。结果发现,cPTIO和Na2WO4可以显著降低NO的含量,而SNP使烟草侧根中NO含量增加了71.2%(图1)。由此推测,在AM真菌与烟草共生过程中的NO可能是由烟草侧根产生的,且NR是NO的主要来源。
2.1.2 AM真菌与烟草的共生过程AM菌丝NO水平的变化
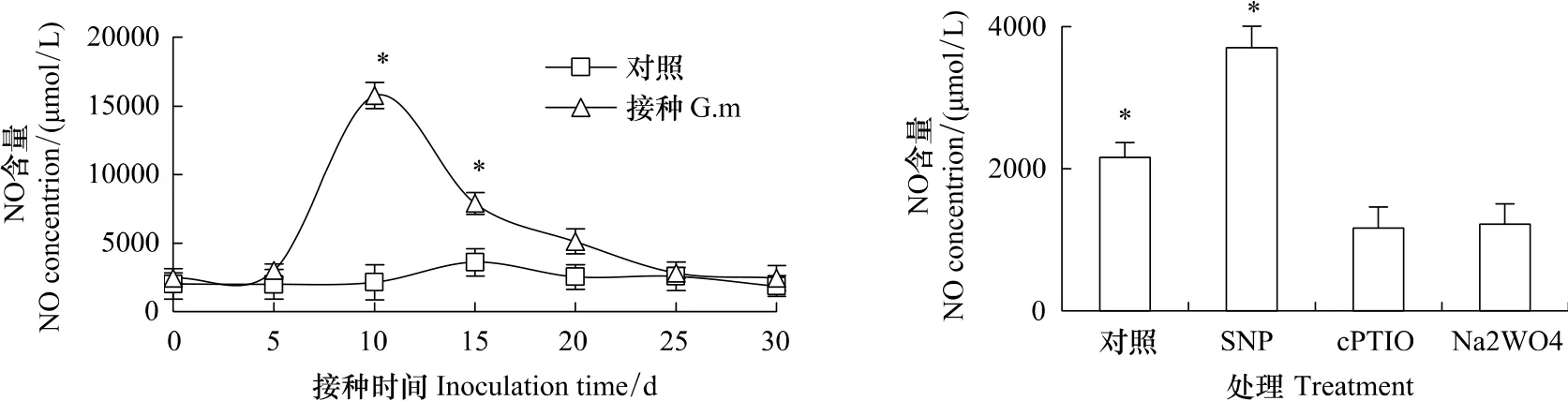
图1 NO清除剂和抑制剂对AM真菌与烟草共生过程中烟草侧根NO含量的影响Fig.1 The change in NO concentration in the lateral roots of tobacco symbiosis with Glomus mosseae after treatment with NO scavenger and inhibitor
为了进一步探明AM真菌与烟草的共生过程NO的来源,以DAF-2DA作为NO的特异性荧光探针,检测了菌丝中NO水平的变化。由图2B可以看出,在接种后20—30d时在菌丝中检测到绿色荧光,且随着接种时间的延长,菌丝中荧光强度稍微增强。菌丝中NO变化的时间要迟于烟草侧根NO的猝发(图2A),且NO的清除剂和抑制剂没有明显改变菌丝中的NO荧光强度,由此推测,AM真菌与烟草共生过程中NO主要由烟草侧根产生,菌丝中可能存在其他来源的NO。

图2 AM真菌与烟草共生过程中烟草侧根和G.m菌丝中NO的荧光变化(标尺=100μm)Fig.2 Localization of fluorescence due to nitric oxide in tobacco lateral roots and the hyphae of G.m after treatment with the NO-specific fluorophore DAF-2DA(Scale-bars=100μm)
2.2 AM真菌对烟草根系NR活性和基因表达的影响
图3结果显示,接种G.m后烟草侧根中NR活性和Nia-1的表达量均呈现先升高后降低的趋势,均于接种后10天活性达到最大值,该变化趋势与NO含量(图1)的变化趋势基本一致。由此推断,NR途径参与AM真菌诱导的烟草侧根中NO的合成。综合图1、图2和图3的结果,从生理和分子水平证明了来自NR途径的NO参与AM真菌与烟草的共生过程。

图3 AM真菌与烟草共生过程中烟草侧根NR活性和Nia-1基因表达的变化Fig.3 The change in NR activity and Nia-1 gene relative expression level in the lateral roots of tobacco symbiosis with Glomus mosseae
2.3 NO清除剂和NR抑制剂对烟草AM真菌侵染率的影响
为了进一步证明来自NR的NO参与AM真菌与烟草共生过程,观测了NO清除剂和合成抑制剂对烟草AM真菌侵染率的影响。结果表明,NO的清除剂和抑制剂可以显著降低AM真菌侵染率,在接种后30d时侵染率分别下降了38.4%和26.4%,而NO供体SNP却使AM侵染率增加了9.1%(图4)。同时,外施一定浓度的SNP能有效增加侧根中的孢子数和菌丝的分布,NO的清除剂c-PTIO和NR抑制剂Na2WO4处理后烟草侧根中孢子数和菌丝量有所减少(结果未显示)。说明NO是AM真菌与烟草的共生过程的重要组分。
3 讨论
植物与微生物共生是自然界中普遍存在的一种生物学现象,其中高等植物和丛枝菌根真菌共生形成的菌根与农业生产和生态系统的稳定性密切相关。AM真菌与植物之间的互利共生依赖于两者之间的信号传递,AM真菌通过特异的信号识别宿主,然后侵染宿主并与之共生。业已证明,宿主根系分泌的类黄酮、独脚金萌发素内酯以及菌根因子、Ca2+、SA和JA等信号分子均参与了该共生过程[8-10],但AM真菌与植物共生的信号转导机制的研究才刚起步。NO是一种普遍存在于植物体内的、具有生物活性和信号转导作用的内源性气体信号分子,它参与调节植物的许多生命活动,而且作为防御反应中的关键信使,参与了植物对外界环境胁迫的应答[20],但NO在植物与微生物互作过程中的作用鲜见报道。本实验综合利用分光光度法、荧光检测技术以及分子生物学等实验技术,结合药理学实验检测了AM真菌侵染烟草过程中NO水平的变化,发现接种G.m后烟草侧根中NO含量(图1)和NO荧光强度(图2A)均明显增加,NO的清除剂能显著降低侧根中NO的水平(图1)和荧光强度(图2C),但对菌丝中的荧光强度影响不显著(图2C);并且清除NO可以降低根系的侵染率(图4),表明NO在G.m与烟草共生的过程中发挥了重要作用,NO可能作为AM真菌与宿主互利共生的重要信号物质。
植物体中的NO的合成主要酶途径是NR,许多实验显示该途径产生的NO参与调控植物的生长发育[16];调节ABA诱导的拟南芥(Arabidopsis thaliana)气孔关闭[17,21];参与了马铃薯(Solanum tuberosum)对晚疫病菌(Phytophthora infestans)侵染的应答反应[22]、水分胁迫下玉米(Zea mays)叶片中NO的产生[15]以及其他非生物胁迫过程[23]。高等植物的 NR 由 nia 编码,至今已经在拟南芥[24]、菠菜(Spinacia oleracea)[25]、烟草[26]、番茄(Solanum lycopersicum)[27]等植物中克隆了nia或nia的cDNA。菜豆中存在两个nia基因位点,niaR-1在根中表达,niaR-2在叶片中表达[28]。烟草中编码NR的基因主要有Nia-1和Nia-2[29]。本实验发现(图3),接种G.m也可以诱导烟草根系NR基因Nia-1的表达;同时苗期接种G.m后,烟草侧根中的NR活性明显升高。且NR的抑制剂钨酸钠可以大大降低AM真菌与烟草共生过程中NO的产生(图1)、显著减弱烟草侧根中的NO荧光强度(图2C),但是对菌丝中的NO荧光变化没有明显影响;NR抑制剂也影响了AM真菌对烟草的侵染。由此推测,来自NR途径的NO参与了AM真菌与烟草共生过程,且NO主要由烟草侧根产生。
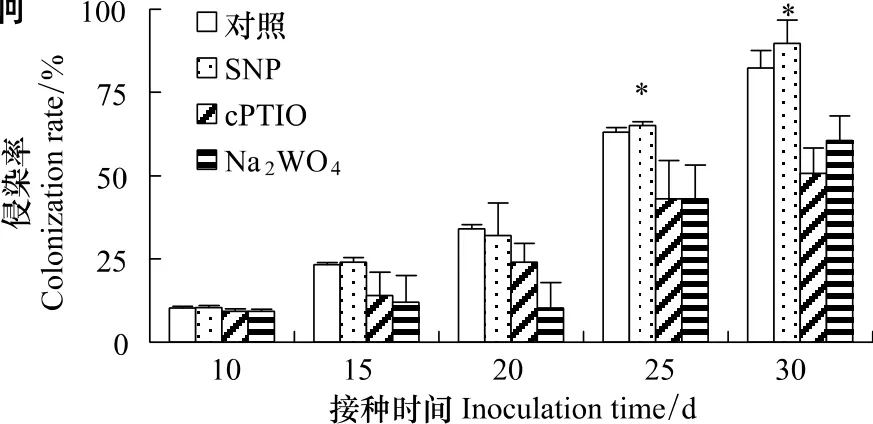
图4 NO清除剂和NR抑制剂对AM真菌侵染率的影响Fig.4 The change in the colonization rate of tobacco by G.m after treatment with NO scavenger and inhibitor
本文首次为信号分子NO参与AM真菌与烟草的共生过程提供了生理学、细胞学和分子生物学的实验证据。今后尚可以筛选或构建烟草NO过表达和缺失突变体为深入了解NO在AM真菌与植物共生过程中的作用提供遗传学的依据。植物与微生物共生的过程非常复杂,在日本百脉根中发现有9个基因(LjSYMRK、LjCASTOR、LjPOLLUX、LjSYM3、LjSYM6、LjSYM15、LjSYM24、LjNUP133 和 LjNUP85)与真菌侵染有关[30],而且已经明确了这些基因编码的蛋白质的类型。这些基因是否与AM真菌与植物的互作有关?Ca2+是AM真菌识别宿主的早期信号物质[6],Myc因子[7]经Ca2+信号的传递,可诱导宿主合成和分泌诸多信号分子;AM真菌与植物共生过程中是否还存在其他信号物质,这些信号物质与NO、Ca2+,H2O2的关系怎样,它们之间是如何相互作用的,还有待进一步研究。只有了解共生双方的识别信号及共生体结构的形成信号,才能解开AM真菌与宿主植物共生的谜团。
[1]Parniske M.Arbuscular mycorrhiza:the mother of plant root endosymbioses.Nature Reviews Microbiology,2008,6(10):763-775.
[2]Sally E,Smith and F.Andrew Smith.Roles of arbuscular mycorrhizas in plant nutrition and growth:new paradigms from cellular to ecosystem scales.Annual Review of Plant Biology,2011,62(1):227-250.
[3]Yang SY,Paszkowski U.Phosphate import at the arbuscule:just a nutrient?.Molecular Plant-Microbe Interact,2011,24(11):1296-1299.
[4]Bonfante P,Anca IA.Plants,mycorrhizal fungi,and bacteria:a network of interactions.Annual Review of Microbiology,2009,63(1):363-383.
[5]He X L,Gao L,Zhao L L.Effects of AM fungi on the growth and drought resistance of Seriphidium minchünense under water stress.Acta Ecologica Sinica,2011,31(4):1029-1037.
[6]Navazio L,Mariani P.Calcium opens the dialogue between plants and arbuscular mycorrhizal fungi.Plant Signaling and Behavior,2008,3(4):229-230.
[7]Kosuta S,Chabaud M,Lougnon G,Gough C,DénariéJ,Barker D G,Bécard G.A diffusible factor from arbuscular mycorrhizal fungi induces symbiosis-specific MtENOD11 expression in roots of Medicago truncatula.Plant Physiology,2003,131(3):952-962.
[8]Akiyama K,Matsuoka H,Hayashi H.Isolation and identification of a phosphate deficiency-induced C-glycosylflavonoid that stimulates arbuscular mycorrhiza formation in melon roots.Molecular Plant-Microbe Interact,2002,15(4):334-340.
[9]Yang R H,Yuan Y B,Liu R J.The roles of salicylic acid in plant disease-resistance induced by AM fungi.Mycosystema,2005,24(4):606-611.
[10]Wang B,Li H,Xu L J,Li M,Liu R J.Induction of tomato signal substances by arbuscular mycorrhizal fungi.Mycosystema,2010,29(4):561-568.
[11]Fester T,Hause G.Accumulation of reactive oxygen species in arbuscular mycorrhizal roots.Mycorrhiza,2005,15(5):373-379.
[12]Bouwmeester H J,Roux C,Lopez-Raez J A,Bécard G.Rhizosphere communication of plants,parasitic plants and AM fungi.Trends in Plants Science,2007,12(5):224-230.
[13]Besson-bard A,Pugin A,Wendehenne D.New insights into nitric oxide signaling in plants.Annual Review of Plant Biology,2008,59(1):21-39.
[14]Kolbert Z,Bartha B,Erdei L.Exogenous auxin-induced NO synthesis is nitrate reductase-associated in Arabidopsis thaliana root primordia.Journal of Plant Physiology,2008,165(9):967-975.
[15]Sang JR,Jiang M Y,Lin F,Xu SC,Zhang A Y,Tan M P.Nitric oxide reduces hydrogen peroxide accumulation involved in water stress-induced subcellular anti-oxidant defense in maize plants.Journal of Integrative Plant Biology,2008,50(2):231-243.
[16]Seligman K,Saviani E E,Oliveira H C,Pinto-Maglio C A F,Salgado I.Floral transition and nitric oxide emission during flower development in Arabidopsis thaliana is affected in nitrate reductase-deficient plants.Plant and Cell Physiology,2008,49(7):1112-1121.
[17]Desikan R,Griffiths R,Hancock J,Neill S.A new role for an old enzyme:nitrate reductase-mediated nitric oxide generation is required for abscisic acid-induced stomatal closure in Arabidopsisthaliana.Proceedings of the National Academy of Sciences of the United States of America,2002,99(25):16314-16318.
[18]Correa-Aragunde N,Graziano M,Lamattina L.Nitric oxide plays a central role in determining lateral root development in tomato.Planta,2004,218(6):900-905.
[19]Tennant D.A test of a modified line intersect method of estimating root length.The Journal of Ecology,1975,63(3):995-1001.
[20]Neill S,Barros R,Bright J,Desikan R,Hancock J,Harrison J,Morris P,Ribeiro D,Wilson I.Nitric oxide,stomatal closure,and abiotic stress.Journal of Experimental Botany,2008,59(2):165-176.
[21]Bright J,Desikan R,Hancock JT,Weir I S,Neill SJ.ABA-induced NO generation and stomatal closure in Arabidopsis are dependent on H2O2synthesis.The Plant Journal,2006,45(1):113-122.
[22]Yamamoto-Katou A,Katou S,Yoshioka H,Doke N,Kawakita K.Nitrate reductase is responsible for elicitin-induced nitric oxide production in Nicotiana benthamian a.Plant and Cell Physiology,2006,47(6):726-735.
[23]Srivastava N,Gonugunta V K,Puli M R,Raghavendra A S.Nitric oxide production occurs downstream of reactive oxygen species in guard cells during stomatal closure induced by chitosan in abaxial epidermis of Pisum sativum.Planta,2009,229(4):757-765.
[24]Wilkinson JQ,Crawford NM.Identification and characterization of a chlorate-resistant mutant of Arabidopsisthaliana with mutations in both nitrate reductase structural genes NIA1 and NIA2.Molecular and General Genetics MGG,1993,239(1/2):289-297.
[25]Kubo Y,Ogura N,Nakagawa H.Limited proteolysis of the nitrate reductase from spinach leaves.The Journal of Biological Chemistry,1988,263(36):19684-19689.
[26]Chérel I,Gonneau M,Meyer C,Pelsy F,Caboche M.Biochemical and immunological characterization of nitrate reductase deficient nia Mutants of Nicotiana plumbaginifolia.Plant Physiology,1990,92(3):659-665.
[27]Daniel-Vedele F,Dorbe M F,Caboche M,RouzéP.Cloning and analysis of the tomato nitrate reductase-encoding gene:protein domain structure and amino acid homologies in higher plants.Gene,1989,85(2):371-380.
[28]Jensen P E,Hoff T,Stummann B M,Henningsen K W.Functional analysis of two bean nitrate reductase promoters in transgenic tobacco.Physiologia Plantarum,1996,96(3):357-358.
[29]Vaucheret H,Vincentz M,Kronenberger J,Caboche M,RouzéP.Molecular cloning and characterisation of the two homeologous genes coding for nitrate reductase in tobacco.Molecular and General Genetics MGG,1989,216(1):10-15.
[30]Kistner C,Winzer T,Pitzschke A,Mulder L,Sato S,Kaneko T,Tabata S,Sandal N,Stougaard J,Webb K J,Szczyglowski K,Parniske M.Seven Lotus japonicus genes required for transcriptional reprogramming of the root during fungal and bacterial symbiosis.The Plant Cell,2005,17(8):2217-2229.
参考文献:
[5]贺学礼,高露,赵丽莉.水分胁迫下丛枝菌根AM真菌对民勤绢蒿生长与抗旱性的影响.生态学报,2011,31(4):1029-1037.
[9]杨瑞红,原永兵,刘润进.水杨酸在AM真菌侵染和诱导植物抗病性中的作用.菌物学报,2005,24(4):606-611.
[10]王彬,李辉,徐丽娟,李敏,刘润进.丛枝菌根真菌对番茄信号物质的诱导效应.菌物学报,2010,29(4):561-568.

