高通量人乳头瘤病毒分型检测方法与序列分析和杂交捕获法的性能比较研究
上海铭源数康生物芯片有限公司(上海,201403)港龙生物技术(深圳)有限公司( 深圳, 518057)
人乳头瘤病毒(HPV)是一类感染人类上皮细胞DNA病毒,目前已经发现了130多种HPV型,有40多种可感生殖腔[1]。HPV可以引起人全身各部位的皮肤或者粘膜感染,导致多种上皮组织疾病,例如皮肤寻常疣,扁平疣,外生殖器的尖锐湿疣等。宫颈上皮组织长期感染的某些型别的HPV可能引起基因突变,导致宫颈上皮内增生(CIN)[2-3]和宫颈癌[4-5]。没有HPV感染不可能导致宫颈癌,而有HPV感染不一定会导致疾病和宫颈癌。根据其导致宫颈癌风险的高低将这些HPV分为高危型和低危型。高危型HPV可能引发妇女发生宫颈癌,主要包括HPV 16、18、31、33、35、39、45、51、52、56、58、59、68、26、53、66、67、69、73、82等型别;低危型HPV主要引起尖锐湿疣,包括HPV6、11、40、42、43、44、54、55、57、61、71、81、83等型别。
以抗体捕获、核酸杂交和化学发光信号放大技术为基础的第二代杂交捕获法(HCII,美国Qiagen公司产品)是最早获得美国FDA批准的临床检测HPV的方法[6],能检测13种高危型(包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68), 但是不具体分型。本研究采用的方法以PCR为基础结合基因芯片(DNA微阵列)和反向点杂交技术对HPV进行高通量分型检测。基因芯片是生物芯片的一个种类,以阵列方式设定在平面基质载体上形成能够并行处理生物样本中多个基因信息的微处理单元,它具有微型化和并行处理的特征,点阵排布点直径在500 μm以内,相邻两个点的中心点间距在1 000 μm以内,点阵列用于检测基因分子。利用微量点样技术,将29种HPV型特异性探针点样于基因芯片基质上,制成基因芯片;经过对样本中的DNA进行PCR扩增、杂交和显色,检测生殖道脱落细胞(如宫颈口、尿道口等部位脱落细胞)中的人乳头瘤病毒(HPV)DNA,可分型检测29种HPV型(包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68、6、11、26、40、42、43、44、53、54、55、57、66、67、69、73、82)。适用于临床HPV感染患者及可疑HPV感染人群辅助诊断。利用基因芯片技术可以实现多指标大样本平行进行高通量分析。本研究通过宫颈细胞样本的检测,与HCII试剂的检测结果进行对比,对样本感染HPV型别进行序列分析验证,评价高通量人乳头瘤病毒基因芯片的性能和临床应用价值。
1 材料和方法
1.1 材料
1.1.1 检测试剂 人乳头瘤病毒分型检测试剂盒(基因芯片法)由港龙生物技术深圳有限公司提供,HCII HPV检测试剂购自Qiagen公司。
1.1.2 序列分析试剂 HotStar Taq Plus 购自Qiagen 公司,按照设计的型别特异性PCR引物扩增特定型别PCR产物,委托英潍捷基(上海)贸易有限公司进行序列分析服务。
1.1.3 仪器 ABI 9700 型PCR仪(Life Technologies),人乳头瘤病毒基因分型检测阅读系统(港龙生物技术(深圳)有限公司)。
1.2 样本处理和HPV检测
宫颈脱落细胞样本2 mL,均分为2份,其中一份样本按照港龙生物技术(深圳)有限公司人乳头瘤病毒核酸检测试剂盒(基因芯片法)的方法进行处理。取出待处理标本,振荡混匀;置离心机中以13 000 rpm离心5 min;弃上清,保留沉淀物。DNA提取时,准备2个离心管,分别加入阴性对照和阳性对照各5 μL。分别向上述对照品管及标本管加入50 μL HPV DNA提取液,振荡混匀;然后沸水浴(或干浴)10 min。将样本管置离心机中,13 000 rpm离心10 min,保留上清液(DNA样品)。 提取的DNA样品3 μL直接加样进行PCR。另一份样本按照HCII试剂的方法进行处理和检测。
1.3 HPV型特异性序列分析方法
在HPV 的L1区设计特异性引物(序列见表1),用特异性引物对29种HPV型别对相应型别进行PCR扩增,用型特异性的正向或反向引物对PCR产物进行序列分析:对所有HPV分型检测阳性样本,包括HPV分型和HCII都为高危型阳性一致的样本,用特异性引物扩增,用其产物和特异性PCR引物测序;对于HCII阳性,而HPV分型结果为阴性的样本,分别用29种型别的特异性引物进行扩增,对产生的足够PCR产物的样本进行序列分析。
特异性引物扩增HPV DNA的反应液20 μL体系的PCR反应液组成为:1 PCR buffer Qiagen、0.4 mM 的dATP、dGTP、dCTP和dTTP(Takara),正向引物和反向引物的浓度分别为2 pmol,0.1 μLHotStar Taq Plus (Qiagen), 样本DNA加样量为2 μL。特异性引物扩增程序为:95℃ 5 min,94℃ 30 s、 56℃ 30 s、72℃ 30 s共45个循环,然后72℃ 延伸反应5 min。HPV型特异性序列分析方法的灵敏度最低可以达到10拷贝/ L样本。
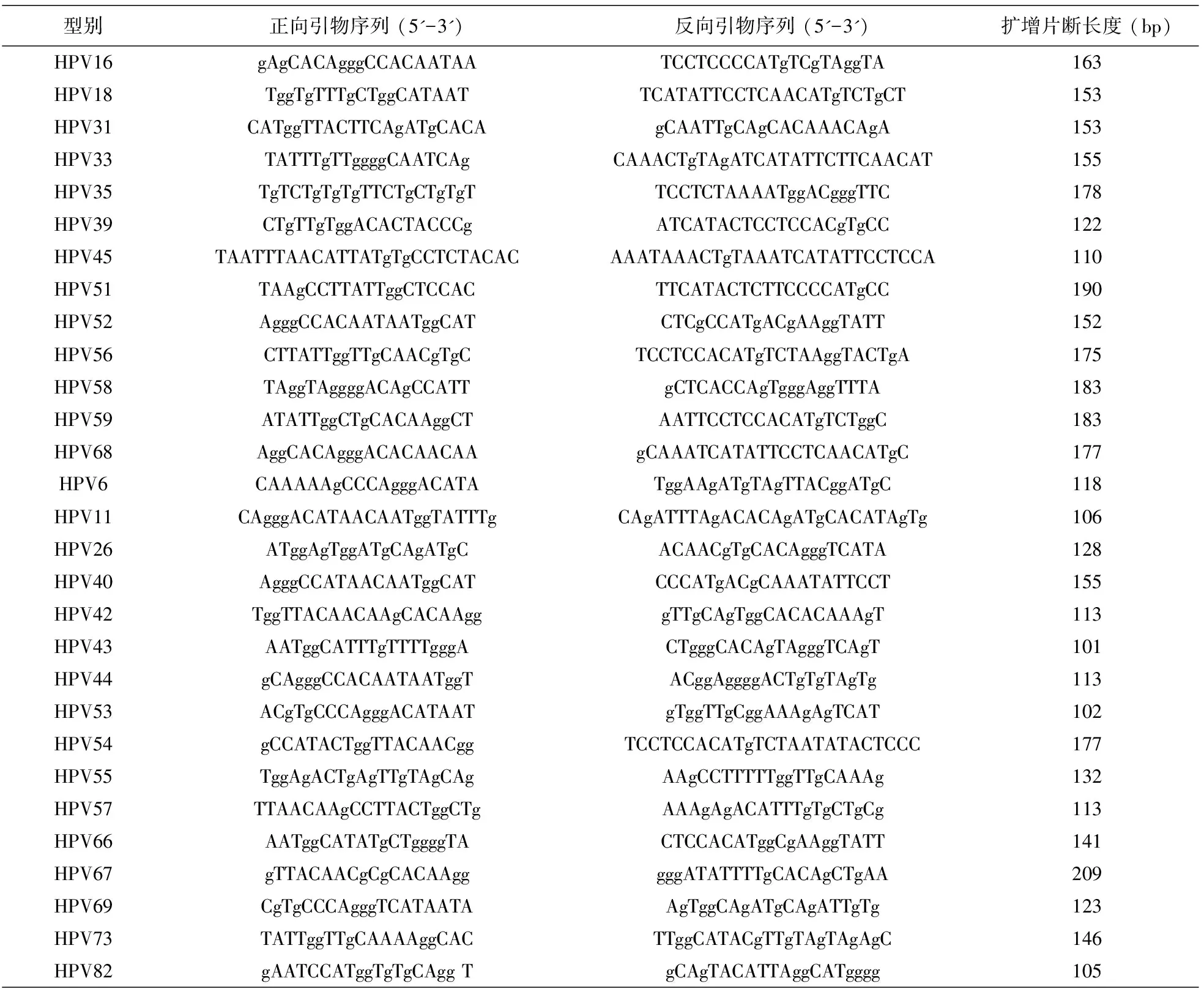
表1 29种型别HPV L1区特异性扩增引物序列Tab.1 The type-specific primers for PCR amplification of the segments in L1 gene among twenty-nine HPV genotypes
2 结果和讨论
2.1 样本的选择
随机选择临床门诊生殖道HPV感染患者或可疑HPV感染病例,同时进行高通量HPV分型检测,并与HCII检测结果进行对比。本文试验包括来自三家医院的500例样本,其中包括156例HCII阳性和344例HCII阴性。将HCII阳性样本设定为有病组,阴性样本设定为无病组,假设本方法的灵敏度为95%、特异度为95%,在允许误差δ为5%,显著性水平α为0.05时,具有统计学意义的最小样本量分别为:
N有病组= (1.96)2×(0.95)×(1HPV0.95)/(0.05)2=72.99 ≈ 73
N无病组= (1.96)2×(0.95)×(1HPV0.95)/(0.05)2=72.99 ≈ 73
有病组现有156例,无病组344例,大于上述计算要求,样本数符合具有统计学意义的最小样本量要求。
2.2 与HCII对比评价和分析
2.2.1与对比试剂的灵敏度和特异性评价
500例样本比较高通量HPV分型检测与HCII的检测结果,其中高通量HPV分型检测结果是指与HCII相同的13种高危型HPV检测结果(即高危型HPV的阴阳性判断),评价阳性符合率、阴性符合率及总符合率(表2)。156例HCII阳性样本中,高通量HPV分型检测阳性143例、阴性13例;高通量HPV分型检测的阳性符合率为91.7%;344例HCII阴性样本中,高通量HPV分型检测结果有阴性329例、阳性15例,高通量HPV分型检测的阳性符合率为90.5% (95%置信区间: 85.9% ~95.1%)、96.2% (95%置信区间: 94.2% ~98.2%)和94.4%(95%置信区间: 92.4% ~96.4%),Kappa值为0.870(95%置信区间: 0.782~ 0.958),说明高通量HPV分型检测与HCII一致性较好。

表2 高通量HPV分型检测与HCII产品符合率评价Tab.2 Comparison between the high-throughput HPV genotyping assay (HPG) and HCII for the detection of High-risk HPV genotypes
* 与HCII试剂检测范围相同的13种高危型HPV检测结果kappa=0.870(95%置信区间:0.782-0.958)
按照13种高危型HPV为标准判断阴性和阳性,与HCII检测不一致的样本共有28例(表2)。 在阳性一致的样本中,高通量HPV分型检测方法可以得出型别结果和多型感染。对所有阳性样本和多型感染样本进行序列分析,以DNA序列分析结果为标准评价高通量HPV分型检测方法的真实灵敏度和特异性,表3列出两种方法不一致样本的序列分析结果(HPV分型检测至少有一种13种高危型的结果,与HCII结果一致,序列分析结果未列出)。
HCII与高通量HPV分型检测结果不一致样本中,包含HCII阳性而高通量HPV分型检测阴性13例,经DNA测序验证,其中有6例样本含有低危型HPV感染、同时序列分析未检出13种高危型;有1例样本对13种高危型进行型特异性PCR及测序分析为阴性,说明上述7例均为不含13种高危型HPV感染(HCII假阳性),有3例样本经测序分析确认分别为HPV16、HPV58和HPV68感染,说明HCII结果正确,高通量HPV分型检测漏检。另外,3例样本DNA测序证实高通量HPV分型检测分别未检出HPV18、16、52高危型。以序列分析结果判断,HCII阳性样本中有6例含有13种高危型HPV(真阳性),有7例不含13种高危型HPV(假阳性),造成假阳性的样本主要包含HPV66(3例)、HPV6(2例)和HPV53(1例)。

表3 HCII与高通量HPV分型检测不一致样本序列分析Tab.3 The sequences analysis of the discordant samples between HCII and HPG
注: 序列分析结果13种高危型HPV用黑体字表示
5例HCII阴性而高通量HPV分型检测阳性样本中,10例样本经DNA测序分析证实其中分别含有相对应高危型存在,说明高通量HPV分型检测结果正确,HCII漏检(假阴性);另有5例样本高通量HPV分型检测均检出高危型,但测序未能确认,判断为高通量HPV分型检测假阳性。以序列分析结果判断,这15例HCII样本有5例为真阴性,10例为假阴性。
序列分析结果与高通量HPV分型检测方法和HCII对13种高危型HPV的检测结果对比(表4),以DNA测序分析结果判断,500例样本中,13种高危型阳性样本共有159例、13种高危型阴性341例。以序列分析结果评价两种方法的灵敏度和特异性(表5),高通量HPV分型检测的灵敏度和特异度分别达到96.2%(95%置信区间:93.3%~99.2%)和98.5%(95%置信区间:97.3%~99.8%),HCII的灵敏度和特异度分别为93.7%(95%置信区间:89.9%~97.5%)和97.4%(95%置信区间:96.4%~99.5%),说明高通量HPV分型检测产品对13种高危型HPV DNA检测的准确性很高,高通量HPV分型检测的灵敏度和特异度略高于HCII 。

表4 13种高危型的序列分析结果比较Tab.4 Comparison of the sequence analysis results with HPG and HCII
*与HCII试剂检测范围相同的13种高危型HPV检测结果

表5 检测的灵敏度和特异性比较Tab.5 Comparison of the sensitivity and specificity between HPG and HCII
注:括号内数字表示95%置信区间
2.3 高通量HPV分型检测分型准确率评价
以DNA测序结果为评价标准,评价本产品分型准确率。比较高通量HPV分型检测检测阳性样本的测序结果,对测序确认为多型感染的样本,至少有2个型与高通量HPV分型检测结果符合的判断为分型准确。如高通量HPV分型检测多个型别,但是DNA测序验证仅证实其中某一型,则判断为分型不准确。如样本DNA测序结果为阴性则不计入分型准确率统计。
累计有197例样本成功测序:其中分型准确185例,包括138例单型感染和47例多重感染;分型不准确样本数为12例(表6)。以序列分析结果评价高通量HPV分析检测方法的分型准确率为93.9%(185/(197)。

表6 分型不准确的样本序列分析结果Tab.6 Comparison of the discordant samples between HPG and sequence analysis
注:(-)表示HPV阴性
2.4 HPV型别分布
根据DNA测序结果,29种HPV型在HPV阳性样本中的分布(表7)。高通量HPV分型检测优异的分析性能,能够检测29种型别,灵敏度高,分型的准确率高,为HPV的临床分型检测提供了可靠的方法,同时它还具有检测通量高,检验成本低,操作方法简便等优点,能够极大的提高检验工作效率,同时其对HPV的分型分析为疾病治疗方案的选择和HPV疫苗的研制都有很好的指导作用,适合临床检验工作的需要。
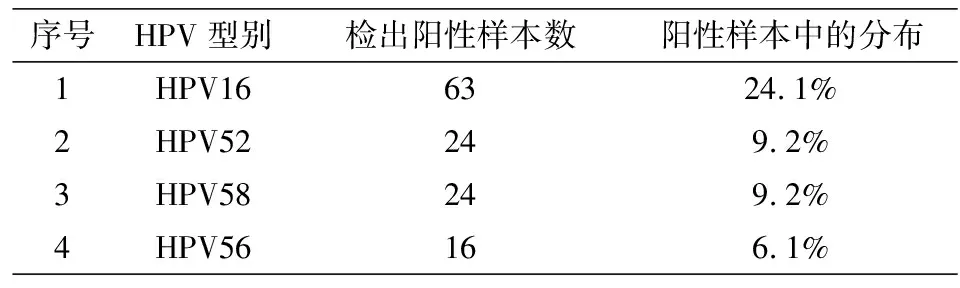
表7 29种型别在HPV阳性样本中出现的频率分布(高至低排列)Tab.7 The distribution of HPV genotypes in the study population with HPV-positive
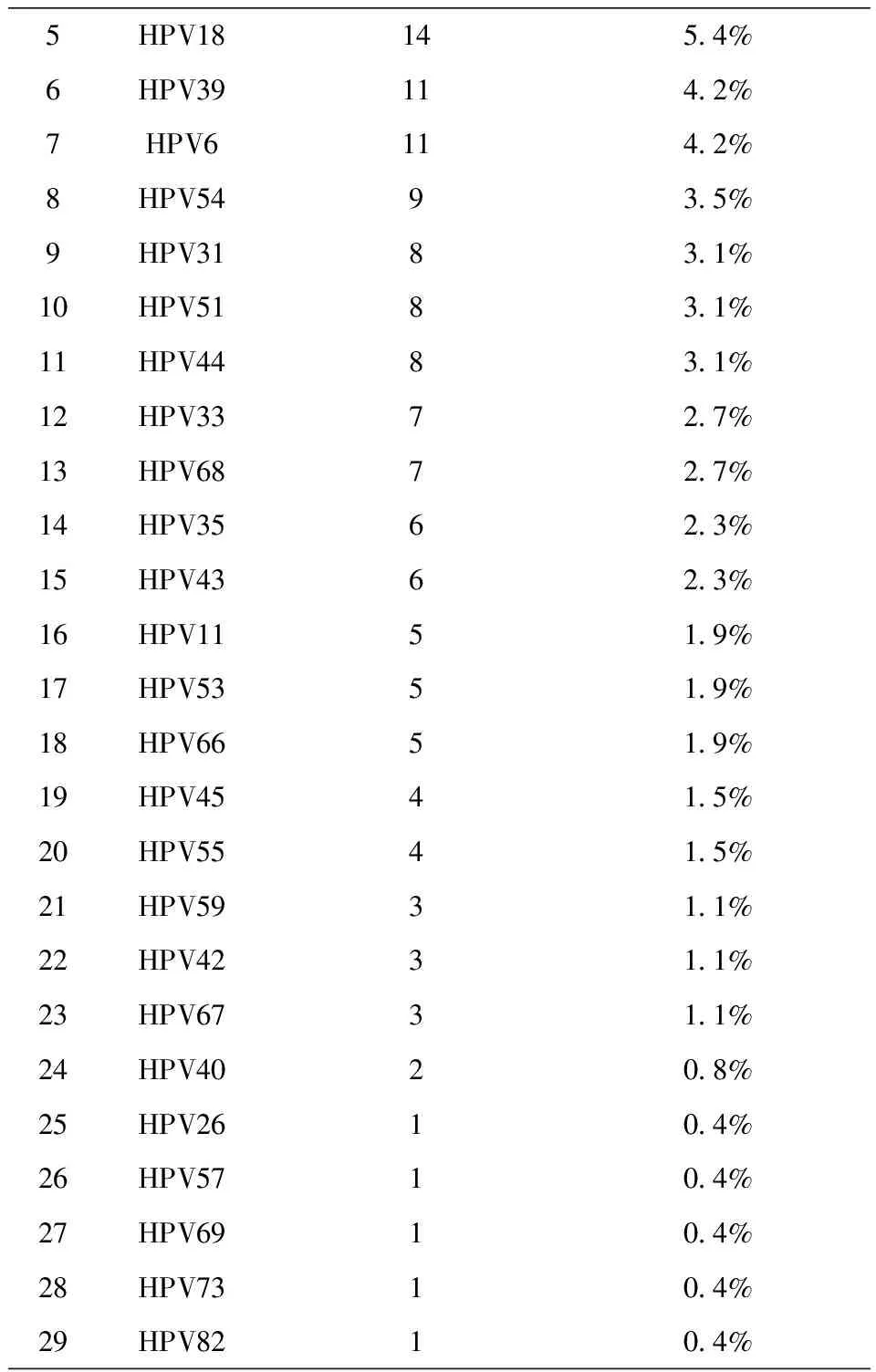
5HPV18145.4%6HPV39114.2%7HPV6114.2%8HPV5493.5%9HPV3183.1%10HPV5183.1%11HPV4483.1%12HPV3372.7%13HPV6872.7%14HPV3562.3%15HPV4362.3%16HPV1151.9%17HPV5351.9%18HPV6651.9%19HPV4541.5%20HPV5541.5%21HPV5931.1%22HPV4231.1%23HPV6731.1%24HPV4020.8%25HPV2610.4%26HPV5710.4%27HPV6910.4%28HPV7310.4%29HPV8210.4%
[1] EM de Villiers, C Fauquet, TR Broker, et al.缺题目, Virology, 2004,324(1): 17-27.
[2] Schiffman M H, H M Bauer, R N Hoover, et al. Epidemiologic evidence showing that human papillomavirus infection causes most cervical intraepithelial neoplasia[J]. J Natl Cancer Inst,1993,85: 958-964.
[3] Kjaer, S. K., A. J. van den Brule, J. E. Bock, et al. Human papillomavirus: the most significant risk determinant of cervical intraepithelial neoplasia[J]. Int J Cancer ,1996,5: 601-606.
[4] Walboomers JMM, Jacobs MV, Manos MM, et al. Huma papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. J Pathol,1999, 189: 12-19.
[5] Zur Hausen H. Papillomaviruses causing cancer: evasion from host cell control in early events in carcinogenesis[J]. J Natl Cancer Inst ,2000,2: 690-698.
[6] Lorincz A.. Hybrid Capture method of detection of human papillomavirus DNA in clinical specimens[J]. Papillomavirus Rep,1996,7:1-5.
[7] 曹友洪. 一种新型基因芯片技术在人乳头瘤病毒( HPV)高通量基因分型检测的应用研究[J]. 生物医学工程学进展, 2013,34(3):157-164.

