乌腺金丝桃抗心律失常有效部位的化学成分研究
李冀,闫东,潘若凡,曹明明
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
1 实验材料与仪器
1.1 药材与药品
乌腺金丝桃:采于大兴安岭山区,经黑龙江中医药大学王振月教授鉴定为藤黄科金丝桃属植物[1-2];甲酸(色谱纯,美国迪马公司);甲醇(色谱纯 美国迪马公司);水为重蒸水;硅胶(青岛海洋化工厂,140~200目,200~300目);色谱层析用化学试剂为分析纯(天津试剂一厂);显色剂:10%的H2SO4乙醇溶液;试剂:NaCl、KCl、CaCl2、KH2PO4、MgSO4·2H2O、NaHCO3、CHCl3(哈尔滨市化学试剂公司)。
1.2 实验仪器
高效液相色谱仪(Waters 2695);数据工作站(Waters Empower软件);电子分析天平(日本岛津AUW220D);超声波清洗器(上海能信科学仪器有限公司CQ2500型);恒温水浴锅(常州国华电器有限公司);Medlab生物信号采集处理系统(南京美易科技有限公司);色谱柱(Diamonsil C18,250mm ×4.6mm,5μm);Langendorff灌流系统(成都泰盟仪器有限公司)。
2 实验方法
2.1 柱前处理
取正丁醇萃取物干粉60g,用适量甲醇溶解,拌入80目柱色谱硅胶90g,低温烘干得黄色粉末,待上层析柱用。
2.2 洗脱剂的选择
通过薄层色谱的方法寻找硅胶柱色谱的洗脱剂和用于流分检查时的色谱条件,取少量正丁醇萃取物用甲醇溶解,选用氯仿和甲醇的不同比例进行薄层层析,确定氯仿:甲醇=50∶1可以作为最初的起始溶剂,根据展开结果依次配置氯仿:甲醇=50∶1;30∶1;20∶1;10∶1;5∶1;3∶1;1∶1 及纯甲醇等洗脱剂。
2.3 装层析柱
选用(直径11cm,高150cm)玻璃柱,用氯仿泡硅胶(200~300目)3kg,加适量氯仿于空柱中,打开活塞,调整氯仿滴速约为4滴/s,在搅拌下快速将泡好的硅胶注入柱中(一次性注入,可以减少气泡的产生),反复利用氯仿冲洗硅胶柱,直到氯仿层不下降为止(大约需要2天),备用。
2.4 层析过程
待层析柱中硅胶沉降好后,打开活塞放氯仿至液面为2~3cm处,将准备好的样品加入柱顶,为了防止破坏柱顶硅胶平面,样品应沿柱壁慢慢加入,待样品全部平整的铺于柱顶,静置12h后,即可打开活塞进行不同梯度洗脱。
2.5 样品收集
按编号收集层析柱流分,每瓶接样500mL,回收洗脱剂,通过薄层色谱进行检识,合并薄层层析斑点一致的流分,共有8个流分(Fr.1~Fr.8)。减压浓缩至干。称重 Fr.1(0.34g),Fr.2(0.45g),Fr.3(0.57g),Fr.4(0.18g),Fr.5(0.26g),Fr.6(0.48g),Fr.7(0.54g),Fr.8(90.13g),将蒸干后的样品少许分别用少量二甲基亚砜溶解,再加入适量生理盐水进行稀释。
3 离体心脏灌流实验
3.1 实验材料
3.1.1 实验药物
受试药物:合并的 8 个流分(Fr.1 ~Fr.8)。
3.1.2 试剂
氯化钙(上海源叶生物技术公司,批号100105);乌头碱(上海源叶生物技术公司,批号200909)。
3.1.3 实验动物
SD大鼠54只,雌雄各半,体质量(200±20)g,由黑龙江中医药大学药物安全性评价中心提供,许可证号:SYXK黑2011001。
3.2 实验方法
3.2.1 实验分组
将54只大鼠按体质量随机分为9组,每组6只,包括合并的8个流分(Fr.1~Fr.8)组,模型组。流分组每组给药剂量0.03mg/ml、模型组给予等量注射用生理盐水。
3.2.2 造模方法
乌头碱、氯化钙诱发的大鼠离体心脏心律失常模型。用Langendorff灌注系统给大鼠心脏离体灌流,大鼠用乙醚麻醉,麻醉后迅速开胸取出心脏,置于预先准备好的(0~4℃)K-H液中,轻轻挤压心脏,排出心脏内剩余的血液,插管结扎固定,迅速移至Langendorff灌注系统,以配制的K-H氏液恒压灌注,灌注液充以VO2∶VCO2=95∶5混合气体充分饱和,压力负荷固定于70cm水柱高度,灌流量速度10ml/min左右,灌流系统及心脏周围温度,以恒温水浴维持在(37±0.5)℃。左心耳处剪一切口,插入前端带水囊的塑胶管,经左心房、二尖瓣插入左心室,由压力传感器连接Medlab生物信号采集处理系统,通过计算机自动采样分析记录,待心脏活动平衡稳定后,灌注乌头碱(生理盐水配制)溶液30μg/kg或0.1%的氯化钙溶液2mg/kg。
3.2.3 用Langendorff灌注系统给药
药物持续于心脏复跳稳定后的整个实验过程。整个实验过程中持续观测左心室最大心室内压(LVSP)、左心室内压最大变化速率(±dP/dt)max和心率(HR),检测其恢复时间和持续时间。
3.3 统计学处理
3.4 实验结果
实验结果如表1、2 所示,与模型组比较,Fr.3、Fr.6、Fr.7组均可延长氯化钙和乌头碱发大鼠快速型心律失常的出现时间,缩短心律失常的持续时间,差异具有统计学意义,P <0.01。
表1 各流分对乌头碱诱发离体心脏心律失常出现时间和持续时间影响(±s)

表1 各流分对乌头碱诱发离体心脏心律失常出现时间和持续时间影响(±s)
注:与模型组比较,**P <0.01。
组别 n出现时间(S)持续时间(min)6 2.21 ±0.63 51.69 ±9.35 Fr.1 组 6 2.68 ±0.52 43.27 ±7.52 Fr.2 组 6 2.42 ±0.41 44.35 ±8.89 Fr.3 组 6 3.98 ±1.13** 29.59 ±8.55**Fr.4 组 6 2.13 ±0.82 47.65 ±7.45 Fr.5 组 6 2.37 ±0.62 42.98 ±9.76 Fr.6 组 6 3.74 ±0.67** 32.75 ±6.34**Fr.7 组 6 3.58 ±0.94** 34.25 ±8.67**Fr.8 组模型组6 2.67 ±0.62 50.75 ±9.02
表2 各流分对氯化钙诱发离体心脏心律失常出现时间和持续时间影响(±s)
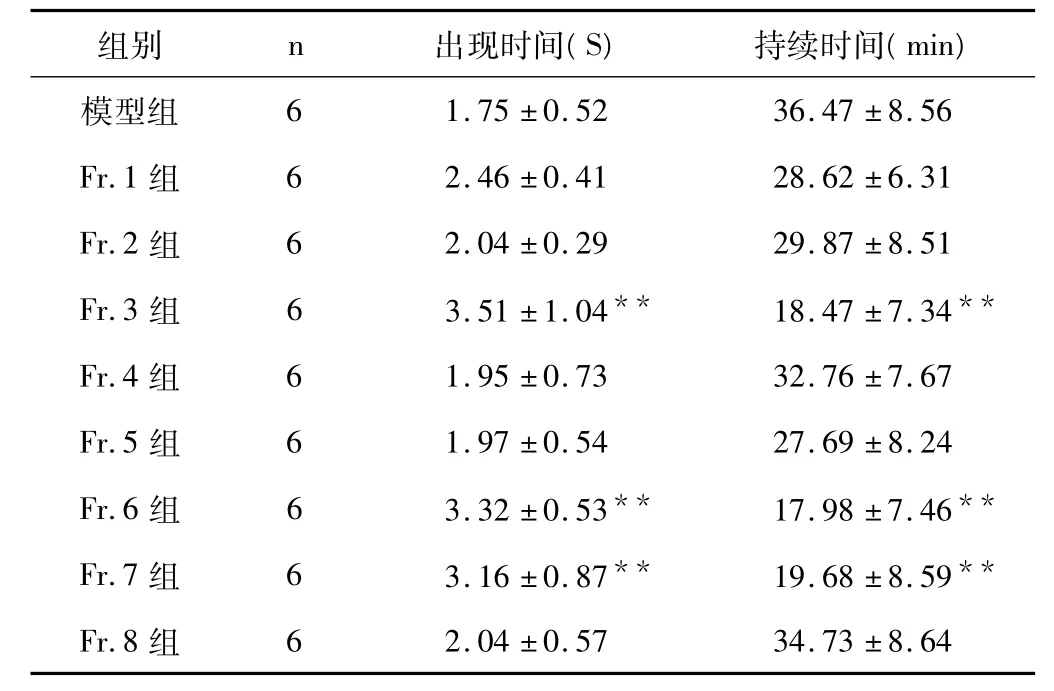
表2 各流分对氯化钙诱发离体心脏心律失常出现时间和持续时间影响(±s)
注:与模型组比较,**P <0.01。
6 1.75 ±0.52 36.47 ±8.56 Fr.1 组 6 2.46 ±0.41 28.62 ±6.31 Fr.2 组 6 2.04 ±0.29 29.87 ±8.51 Fr.3 组 6 3.51 ±1.04** 18.47 ±7.34**Fr.4 组 6 1.95 ±0.73 32.76 ±7.67 Fr.5 组 6 1.97 ±0.54 27.69 ±8.24 Fr.6 组 6 3.32 ±0.53** 17.98 ±7.46**Fr.7 组 6 3.16 ±0.87** 19.68 ±8.59**Fr.8 组模型组6 2.04 ±0.57 34.73 ±8.64
4 再次硅胶柱层析
Fr.3、Fr.6、Fr.7 组再次硅胶柱层析并通过 HPLC色谱,进行成分分析,筛选出成分相对单纯的药物组分,A(氯仿:甲醇 =20∶1中的1~20瓶组分),B(氯仿:甲醇=3∶1中的11~20瓶组分),C(氯仿:甲醇=1∶1中的1~22瓶组分)。
A、B、C三个组分通过薄层色谱的方法寻找硅胶柱色谱的洗脱剂和用于流分检查时的色谱条件,取以上三种组分少量用甲醇溶解,选用氯仿和甲醇的不同比例进行薄层层析,确定出A组分的初始洗脱剂(氯仿:甲醇=15∶1),B和C组分的初始洗脱剂(氯仿:甲醇=5∶1,再加少量水)。按编号收集层析柱流分,每瓶接样500mL,回收洗脱剂,通过薄层色谱进行检识,合并薄层层析斑点一致的流分,减压浓缩至干。
5 HPLC检测组分
仪器:高效液相色谱仪(Waters 2695);荧光检测器;色谱柱:(Diamonsil C18,250mm × 4.6mm,5μm);Shim-pack保护柱;流动相:甲醇∶水(20∶80);柱温:18C;检测波长:365nm。
将经过硅胶柱层析后合并出来的组分通过HPLC色谱,进行成分分析,筛选出药物组分,分别为化合物1(Fr.Ⅰ中的8~19瓶组分),化合物2(Fr.Ⅲ中的35至最后的组分)。见图1、图2。

图1 化合物1的HPLC色谱图
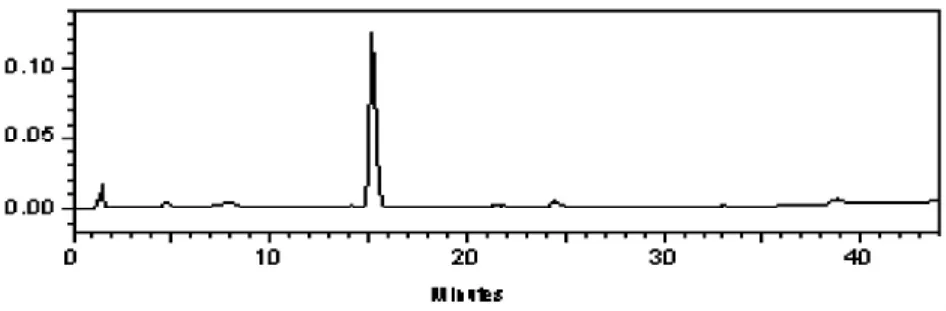
图2 化合物2的HPLC色谱图
6 鉴定
制备型HPLC和重结晶相结合的方法进行单体分离,共得2个到单体化合物。

6.1 化合物1结构鉴定
黄色粉末,mp.235~241℃。HCl-Mg反应呈阳性,Molish反应呈阳性。化合物1经酸水解薄层色谱仅检出D-半乳糖。化合物1的13C-NMR谱中在δ∶101.8(CH),75.8(CH),73.0(CH),71.0(CH),67.8(CH)和67.0(CH2)处可观察到一组归属于l个半乳糖基的6个碳信号。并有C谱可知化合物1中归属于苷元部分的碳信号共为15个,以上表明化合物1为一个半乳糖黄酮苷类化合物。化合物1的1HNMR谱中归属于B环的3个质子为7.63(1H,d,J=2.0Hz)处的 H-2',7.70(1H,dd,J=2.0,7.0Hz)处的H-6'和6.89(1H,d,J=7.0Hz)处的 H-5',由以上 3个质子的偶合情况可知该黄酮化合物的B环为3',4'-二氧取代;归属于A环的质子为6.27(1H,d,J=2.0Hz)处的 H-6 和6.49(1H,d,J=2.0Hz)处 H-8,由以上2个质子的化学位移和偶合情况可推知该黄酮化合物的A环为5,7-二氧取代。化合物1的1HNMR 中在5.40(1H,d,J=8.0Hz)处还可观察到归属于半乳糖端基质子的信号,根据其偶合常数(J=8.0Hz)推断化合物1的糖苷键构型为β-构型。
综上所述,将此化合物的1H-NMR谱中的主要质子信号和13C-NMR谱中的所有碳信号综合分析,均进行了归属,并与相关文献的已知化合物A(金丝桃苷)相比较,发现两者相应的氢和碳的化学位移基本一致。因此,鉴定化合物1为金丝桃苷(Hyperin)。见表3。

6.2 化合物2结构鉴定
淡黄色粉末,紫外灯下显黄色荧光。Molish反应阳性,盐酸镁粉反应红色,二氯氧锆反应加枸橼酸后黄色褪去,表明可能是黄酮类化合物。推测其为黄酮苷类化合物。
在1H-NMR(DMSO-d6,600MHz)中,归属于苷元部分A环的母核质子只有2个,即δ6.18(1H,d,J=2.4Hz)处的 H-6 和 δ6.37(1H,d,J=1.8Hz)处的 H-8,可推断其A环为5,7位二取代;归属于苷元部分B 环的母核质子有3 个,即 δ7.52(1H,d,J=1.8Hz)处的 H-2',δ7.54(1H,dd,J=2.4,7.8Hz)处的 H-6'和δ6.83(1H,d,J=7.8Hz)处的 H-5',组成一个 ABX偶合系统,可推测其B环为1',3',4'位三取代。此外在低场区可见 δ12.59(1H,s),δ10.81(1H,br.s),δ 9.64(1H,br.s),δ9.16(1H,br.s)处有4 个酚羟基质子信号。在高场区 δ0.98(3H,d,J=6.0Hz)处出现了归属于L-鼠李糖C-6‴位的甲基质子信号。还可见δ5.33(1H,d,J=7.2Hz)处归属于 D-葡萄糖端基的质子信号和δ4.40(1H,s)处归属于L-鼠李糖端基质子的信号,根据它们的端基质子的耦合常数,可推断葡萄糖苷键为β构型,鼠李糖苷键为α构型。

Table.3 1H 和13C-NMR Data of Compound 1 and A(in DMSO-d6)

Table.4 1H和13C-NMR Data of Compound 2 and B(in DMSO-d6)
在13C-NMR(DMSO-d6,150MHz)谱中给出了27个碳信号,其中包括归属于黄酮母核的15个碳信号(C 环:δ156.6、133.3、177.3,A 环:δ161.2、98.7、164.1、93.6、156.4、103.9,B 环:δ121.2、116.2、148.4、144.7、115.6、121.6);归属于葡萄糖的 6 个碳信号(101.2、74.0、76.4、69.9、75.9、67.0);归属于鼠李糖的 6 个碳信号(100.7、70.4、70.5、71.8、68.2、17.7);其中葡萄糖基的6位碳原子的化学位移为δ67.0,据此可推知鼠李糖基是连接于葡萄糖的6位上。化合物2的13C-NMR数据见Table.2。
综上所述,将此化合物的1H-NMR谱中的主要质子信号和13C-NMR谱中的所有碳信号综合分析,均进行了归属,并与相关文献的已知化合物B(芦丁)[3]相比较,发现两者相应的氢和碳的化学位移基本一致。因此,鉴定化合物2为芦丁(rutin)。
[1] 李冀,曹明明,高彦宇.乌腺金丝桃与丹参配伍对心肌缺血模型动物影响的研究[J].中医药学报,2012,40(1):17-19.
[2] 马育轩,王艳丽,周海纯,等.乌腺金丝桃的化学成分及药理作用研究进展[J].中医药学报,2012,40(6):125-126.
[3] 杨秀伟.中草药化学成分的研究[J].中草药,2007,30(7):47-49.

