西门岛人工秋茄林恢复对大型底栖生物的影响
黄 丽,陈少波,仇建标,丁文勇,郑春芳,伍锦姑,周志明,王 宁
(浙江省海洋水产养殖研究所,温州 325005)
自20世纪70年代后期以来世界各地采取了一系列措施减缓和抑止红树林退化丧失的趋势,在美洲、大洋洲、亚洲等地区进行了人工红树林的恢复。但是在红树林的恢复过程中,其湿地的本质属性往往被忽略,而只重视了植被恢复。国内外的研究人员在红树植被恢复方面做了大量积极而有意义的工作,如红树植物树种选育、退化次生林改造、红树林宜林地指标研究等[1-5]。在红树林恢复过程中,只重视植被的现象是与其具有“森林”的特点分不开的。红树林植被恢复的同时,系统内各生物类群发生不同的动态过程[6-7]。红树林恢复应包括稳定的植被覆盖和生态恢复两个目标,而生态恢复的目的是恢复生态系统的结构和功能[8]。红树林属于典型的滨海湿地生态系统。大型底栖动物在红树林碎屑食物链中具有承上启下的重要功能[9],并且大型底栖动物本身的特征也决定了其群落结构变化能够很好地反映其生境的状况[10-11]。研究红树林恢复过程对大型底栖动物的影响,具有重要的生态恢复效益指示意义[12-14]。
生态恢复研究很少能够做到对恢复地的长期跟踪监测,因此多采用空间代替时间的方法。此方法的最大的缺点就是不同的人工恢复地,其恢复初的生态背景大多不同,而这又是影响大型底栖动物分布的重要因素[15],从而增加了人工红树林植被恢复地大型底栖动物多样性动态研究的难度。针对此问题,本文在选址方面首先保障了环境背景值一致的同一片海域。通过分析不同季节不同时期造林断面的大型底栖生物群落结构和特征,探讨人造红树林恢复过程对大型底栖生物的影响,以期为红树林湿地恢复提供相关依据。
1 材料与方法
1.1 选址及采样位点设置
本文选择乐清湾西门岛的人工秋茄林作为研究对象。西门岛位于乐清湾的湾底,地理坐标121°09′22″—121°12′13″E,28°19′50″—28°21′33″N。由于历史的原因,这里保留了中国最北界人工红树林,也是浙江省内唯一一片树龄超过50a的秋茄成林。并且从2002年开始,陆续不断的红树林造林引种,形成了在同一海域1—8a的秋茄幼林、50a的老林、以及互花米草丛和光滩并存的现状。因此保证调查的不同群落环境背景值基本一致。并且,所有采样位点均设置在同一个潮位断面(中潮位,黄零潮位为1.5—1.7 m左右),以去除潮位不同对底栖动物分布的影响。除光滩外,采样位置均分布在有红树林或互花米草分布的林下滩涂。2010年秋季(10月)和2011年春季(5月)分别对西门岛南侧海域的1a秋茄林(M1)、4a秋茄林(M4)、8a秋茄林(M8)、50a秋茄林(M50)的红树林群落,以及互花米草丛(Sa)和光滩(NB)的大型底栖动物进行了定量采样,各位点分布见图1。其中,1、4、8、50a秋茄林的面积分别为1.7、0.7、0.4 hm2和0.2 hm2左右,林子的郁闭度分别为35%、65%、95%、98%;互花米草丛和光滩为斑块状分布。

图1 西门岛6个不同的调查位点图Fig.1 Map showing the location of six different sampling sites in Ximen Island
1.2 样品采集与处理
在每个采样位点随机布设4个重复,每个重复用25 cm×25 cm定量框取样,样品用0.5 mm孔径的网筛筛洗,标本用5%的福尔马林固定。室内进行分类鉴定、个体计数以及称重(湿重)等工作。样品的处理、保存、计数和称重等均按照《海洋调查规范》(GB/T 12763.9—2007)进行。
1.3 数据处理
计算群落的生物量和栖息密度、物种优势度指数(Y)、Shannon-Wiever的种类多样性指数(H′)、Margalef的种类丰度(D)和Pielous的种类均与度(J)等参数。原始丰度数据经二次方根转化后,在Bray-Curtis相似性测量的基础上,结合使用等级聚类分析(Cluster)和非度量多维标度排序(Non-matric Multidimentional Scaling,MDS)两种统计方法来分析动物群落的聚类与排序,探讨各群落间的相似度。采用丰度/生物量比较趋向ABC曲线(Abundance-Biomass Comparison curve)分析系统相对稳定性。

式中,Pi为第i种的个数与样方总个数之比值,fi为种i在群落内各样方出现的频率,物种优势度Y≥0.02时,该种为优势种[16-17]。
结合本文实际采样情况将物种生活型划分为:底上生活类群(GS)和底内生活类群(GSB)两大类。其中GS包括底上附着型和游泳型,GSB包括底内潜穴型和穴居型[18]。
数据分析和作图采用excel、SPSS和Primer 5软件。
2 结果
2.1 种类组成及优势种
两次调查共鉴定出红树林区大型底栖动物24种,软体动物种类最多共15种,节肢动物甲壳类居第2位有5种,两类合计20种,占总种类的83.3%,此外还有多毛类2种,星虫1种,其他种类1种。调查区域滩涂底泥中大型底栖动物的主要优势种如表1所示,其中绯拟沼螺、纵带滩栖螺和珠带拟蟹守螺分布量相当丰富,是该区大型底栖动物中的主要代表种(表1)。可口革囊星虫是M50中的特征种,在春秋两季的优势度指数分别为0.472和0.560。从生活类型分,底上附着型是所有群落的主要优势种。而潜穴型和穴居型多作为NB、Sa和M50的优势种出现,在红树林幼林(M1、M4、M8)中分布较少。NB和Sa的潜穴型动物在春秋两季变化较大。
2.2 栖息密度和生物量

如图2所示各群落之间的生物量差异性比栖息密度大,两参数指标在秋季的差异性又较春季大。差异性分析显示:春季各群落间栖息密度无显著性差异,而生物量NB明显低于M8和M50,呈显著差异(P<0.05)。秋季各群落间的栖息密度和生物量均表现出显著差异,其中NB与M1之间,M8与M50之间的栖息密度均差异极显著(P<0.01),M4与M50栖息密度差异显著(P<0.05)。秋季NB与M1、M50之间、M1与M8之间的生物量均差异极显著(P<0.01)。并且4个红树林群落区域的生物量高于光滩和互花米草丛。
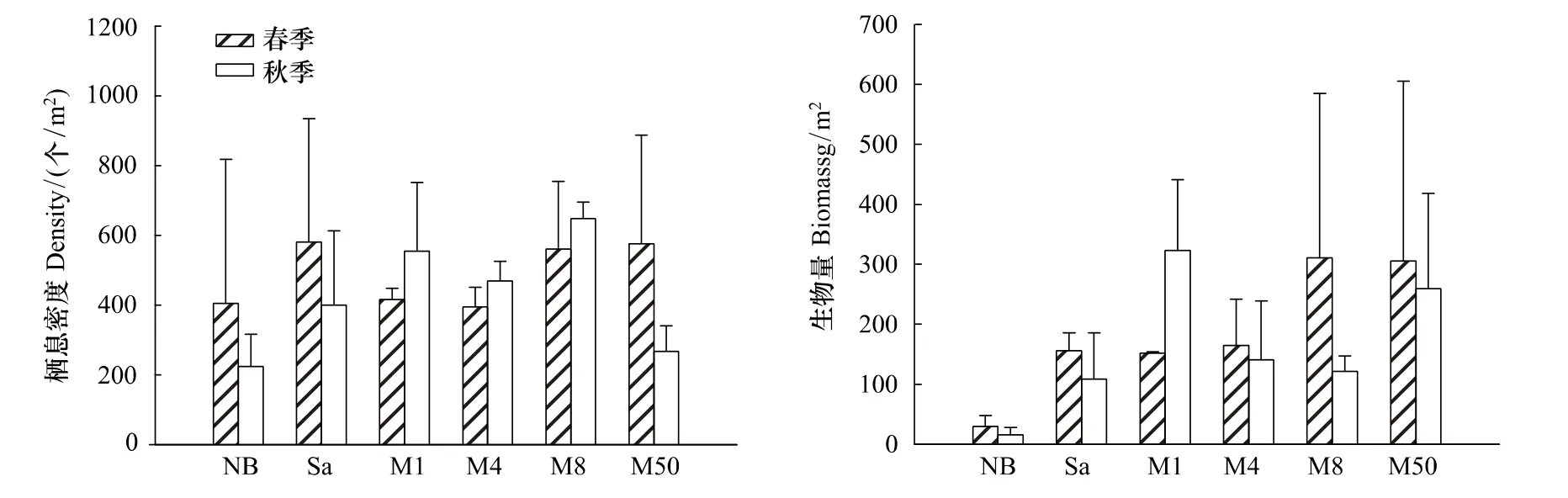
图2 西门岛不同群落内大型底栖动物栖息密度和生物量分布(平均值±2SE)Fig.2 Distribution of macrobenthic biomass and density in different communities in Ximen Island(means±2SE)
2.3 大型底栖动物多样性指数
春秋两季各个群落的多样性指数H′、物种丰富度指数D和均匀度指数值的最大值均出现在M50:H′=2.47、D=2.84和J=0.54;而各指标的最小值分别出现在 M1(H′=0.94和 D=1.18),和 M4(J=0.18)中。总体统计,M50、NB和Sa的H′、D和J值普遍高于M1、M4和M8(表2)。

表2 西门岛大型底栖动物群落生物多样性指数比较Table 2 The index analyse of H′,D,J on macrobenthic communities in Ximen Island
2.4 类群及生活型划分
各群落生境的不同生活型动物种数见表3。4种生活型动物在群落中一起出现的几率为:M50>NB>Sa>(M1、M4、M8),尤其是M1、M4和M8中均未采集到穴居型动物。从生活类群数据分析(表3),秋季不论是种数、密度还是生物量,GS/GSB值均表现为:Sa=M4>M1>M8>NB>M50;而在春季各参数的趋势略有差别,其中密度和生物量的GS/GSB值的趋势比较一致,分别为M4>M8>M1>Sa>M50>NB和M4>M8>M1>Sa>NB>M50,种数的GS/GSB值则为M4=M8>M50>NB>M1>Sa,这与春季各群落参数的差异性小于秋季的结果一致。秋季的GS/GSB值和春季栖息密度和生物量的GS/GSB值均显示:M1、M4和M8主要分布为底上生活类群,NB和M50中底下生活类群相对增加。Sa的GS/GSB值在春秋两季差异较大。
2.5 聚类分析结果
聚类分析图显示春季各个群落间的相似度远远高于秋季。春季各个群落相似度为50%时被分为两大组,即M1、Sa和NB为一组,M4、M8和M50为一组(图3)。而秋季各群落相似度为50%时被分为4组,即NB、M50、M1分别各为一组,M4、M8和Sa为一组(图3)。非度量多维标度(MDS)(图4)与聚类分析结果一致。根据Clarke K.R.等认为,当stress(胁强系数)<0.05为吻合极好;stress<0.1为吻合较好;stress<0.2为吻合一般;stress>0.3为吻合较差。本次调查春季的stress为0.01,秋季为0.03,吻合极好。

表3 各群落生境动物生活型和生活类群的数量特征Table 3 Numerical features of life forms and life groups for the macrobenthos in various beach habitats
2.6 大型底栖动物ABC曲线
ABC曲线是将丰度和生物量的K-优势曲线绘于同一张图上,ABC曲线通常能反映大型底栖生物群落的稳定性,一般认为正常稳定的群落,其生物量曲线始终位于丰度曲线的上方,丰度比生物量具有更高的多样性;一旦两条曲线相互交叉或重叠,说明群落稳定性下降或受到干扰[19]。西门岛各个群落春季和秋季的ABC曲线分析如图5可知,只有M50的生物群落比较稳定,其他各群落均受到不同程度的干扰。
3 讨论
3.1 西门岛红树林大型底栖动物种类组成及分布
高爱根等[20]调查了西门岛红树林区的大型底栖动物种类为42种,而本次调查的结果为24种,并且种类组成和数量略有不同。这与大型底栖动物具有潮位分带分布现象相关。因为前者设置了高、中、低潮带的采样点,而本次采样仅仅选择了同一潮位的林下滩涂。高爱根的调查断面为成熟的红树林区,与本文M50一样均得出可口革囊星虫是该区域的特征种。

图3 西门岛各大型底栖动物群落的等级聚类图Fig.3 The dendrogram for the similarity matrix of the different macrobenthos communities in Ximen Island

图4 西门岛各群落内大型底栖动物的MDS排序分析Fig.4 The MDS for the similarity matrix of the macrobenthos communities in Ximen Island
红树林植被恢复过程中必将导致海岸湿地底栖动物亚系统的变化。虽然各群落内种类数量差别不大,但是生活型分布差异明显,基本表现为幼林以底上附着型为主,而在光滩、50a老林和互花米草中底下生活类群相对增加。并且穴居型动物只出现在发育成熟的生态系统内(NB、Sa和M50)。需要指出的是在春季作为NB和Sa优势种出现的潜穴型动物(主要双壳类如彩虹明樱蛤和缢蛏等),秋季却没有采集到,这是因为它们是当地渔民4—9月份采捕的对象。这也是导致GS/GSB值在Sa中春秋季变化较大的原因。
除了季节和潮位,植物群落和底质是影响红树林大型底栖动物分布的主要因素[21-22]。而不同演替阶段中的红树植物对底质的影响各异[23-24]。发育成熟的红树林土壤多表现出酸性大、透气性差、H2S增加、土壤质地黏重等特点,这也是典型的红树林土壤又黑又臭的原因[9]。并有许多研究证明这样的土壤会制约一些底栖生物的生存,导致发育成熟的红树林内生物结构相对于林外滩涂更简单[20,25-26]。与以往研究结果不同,本文50a老林的大型底栖动物生物种类的丰度及群落的物种多样性最高,并不与红树林的发育状况呈负相关,也不比邻近光滩低。结合50a林下滩涂底泥中凋落物和半分解凋落物较少,土壤也没有表现出典型红树林土壤的又黑又臭现象,本文认为西门岛50a红树林林下滩涂的底质发育要落后于国内天然红树林土壤。这可能与当地红树林造林规模小以及强潮差海域有关,导致外界环境的影响超过了红树林植被对底质的影响。此观点有待于进一步的土壤监测来证实。
3.2 大型底栖动物与红树林人工恢复的生态关系

图5 西门岛不同大型底栖动物群落的ABC曲线Fig.5 ABC plots of macrobenthic communities in Ximen Island
人们早就证实物种多样性导致生态稳定性的观点,但在一个较小的生态系统和相对较短的生态周期内,生态系统稳定性提高的同时,也会降低种群的稳定性[27-29]。虽然西门岛不同树龄秋茄林之间种类数量差异不大,但并不代表不同树龄群落各有优势。在比较群落间差异性时使用优势种比全部种更可靠,而生活型或者群落结构对稳定性的指示作用优于单个种和种类数量。功能群和功能多样性更适于被用来测度系统稳定性和预测群落变化[30]。本文的各项结果显示M50群落生态稳定性较好,光滩和互花米草丛次之,但优于发育中的秋茄幼林,而1—8a红树林之间却没有规律可循。陈光程[31]研究了九龙江口不同时间人工恢复秋茄林地的大型底栖动物,认为退化红树林林生态系统的人工恢复需要20a左右可以趋于稳定。至今尚没有确实的实验证明,随着种类的进一步增加,稳定性也恒定地提高[32],并且物种多样性与生态稳定性之间并非属于简单的线性关系,对于红树林生态系统,其适用的系统面积和演替时间的尺度范围有待深入探讨。
[1] Lewis R R.Ecologically based goal setting in mangrove forest and tidal marsh restoration in Florida.Ecological Engineering,2000,15(3/4):191-198.
[2] Field C D.Rehabilitation of Mangrove ecosystems:an overview.Marine Pollution Bulletin,1998,37(8/12):383-392.
[3] Zhang Q M,Sui S Z,Zhang Y C,Yu H B,Sun Z X,Wen X S.Marine environmental indexes related to mangrove growth.Acta Ecologica Sinica,2001,21(9):1427-1437.
[4] Liao B W,Zheng S F,Chen Y J,Li M.Advance in researches on rehabilitation technique of mangrove wetlands.Ecologic Science,2005,24(1):61-65.
[5] Peng Y S,Zhou Y W,Chen G Z.The restoration of mangrove wetland:a review.Acta Ecologica Sinica,2008,28(2):786-797.
[6] Bosire J O,Dahdouh-Guebas F,Kairo J G,Cannicci S,Koedam N.Spatial variations in macrobenthic fauna recolonisation in a tropical mangrove bay.Biodiversity and Conservation,2004,13(6):1059-1074.
[7] Chen Y J,Liao B W,Zheng S F,Li W,Song X Y.Dynamics and species-diversities of artificial Sonneratia apetala,Sonneratia caseolaris and Kandelia candel communities.Chinese Journal of Applied Ecology,2004,15(6):924-928.
[8] Lewis R R.Ecological engineering for successful management and restoration of mangrove forests.Ecological Engineering,2005,24(4):403-418.
[9] Wang W Q,Wang M.The Mangroves of China.Beijing:Science Press,2007.
[10] Zhao Y Q,Zeng J N,Gao A G,Chen Q Z,Liao Y B,Shou L.Community pattern and diversity of macrozoobenthos in an intertidal flat,Jiaojiang Estuary.Biodiversity Science,2009,17(3):303-309.
[11] Hu Z Y,Bao Y X,Cheng H Y,Zhang L L,Ge B M.Research progress on ecology of natural wetland zoobenthos in China.Chinese Journal of Ecology,2009,28(5):959-968.
[12] Ye Y,Weng J,Lu C Y,Chen G C.Mangrove biodiversity restoration.Acta Ecologica Sinica,2006,26(4):1243-1250.
[13] Lee S Y.The ecological role of grapsid crabs in mangrove ecosystems:implications for conservation.Marine and Freshwater Research,1998,49(4):335-343.
[14] Lee S Y.Tropical mangrove ecology:physical and biotic factors influencing ecosystem structure and function.Australian Journal of Ecology,1999,24(4):355-366.
[15] Wang B S,Liao B W,Wang Y J,Zan Q J.Mangrove Forest Ecosystem and Its Sustainable Development in Shenzhen Bay.Beijing:Science Press,2002.
[16] An C G,Zhao Y L,Lin L,Li J Y,Cui L L,Ma C Y.The biodiversity of marobenthos of intertidal zone on Chongming Island in summer.Acta Ecologica Scinica,2008,28(2):577-586.
[17] Shou L,Zeng J N,Liao Y B,Zhao Y Q,Jiang Z B,Chen Q Z,Gao A G,Yang J X.Seasonal distribution of macrozoobenthos and its relations to environmental factors in Oujiang River estuary sea area.Chinese Journal of Applied Ecology,2009,20(8):1958-1964.
[18] Fan H Q,He B Y,Wei S Q.Influences of sand dune movement within the coastal mangrove stands on the macrobenthos in Situ.Acta Ecologica Scinica,2000,20(5):722-727.
[19] Warwick R M,Pearson T H,Roswahyumi.Detection of pollution effects on marine macrobenthos:further evaluation of the species abundance biomass method.Marine Biology,1987,95(2):193-200.
[20] Gao A G,Chen Q Z,Zeng J N,Liao Y B,Yang J Y.Macrofauna community in the mangrove area of Ximen Island,Zhejiang.Journal of Marine Sciences,2005,23(2):33-40.
[21] Gray J S.Animal-sediment relationships.Oceanography and Marine Biology:An Annual Review.1974,12:223-261.
[22] Whitlach R B.Animal-sediment relationships in intertidal marine benthic habitats:some determinants of deposit-feeding species diversity.Journal of Experimental Marine Biology and Ecology,1981,53(1):31-46.
[23] Lioa J F.Physico-chemical properties of mangrove solochak in Leizhou peninsula.Soils,2004,36(5):561-564.
[24] Wen Y G,Liu S R,Yuan C A.The population distribution of mangrove at Yingluogang of Guangxi,China.Acta Ecologica Sinica,2002,22(7):1160-1165.
[25] Zhang Y Z,Chen C Z,Wang Y Y,Chen P J,Yang R Q.The ecology of benthos in Fujian mangrove swamps.Acta Ecologica Sinica,1999,19(6):896-901.
[26] Ellis J,Nicholls P,Craggs R,Hofstra D,Hewitt J.Effects of terrigenous sedimentation on mangrove physiology and associated macrobenthic communities.Marine Ecology Progress Series,2004,207:71-82.
[27] Naeem S,Thompson L J,Lawler S P,Lawton J H,Woodfin R M.Declining biodiversity can alter the performance of ecosystems.Nature,1994,368(6473):734-737.
[28] Schindler DW.Experimental perturbations of whole lakes as tests of hypotheses concerning ecosystem structure and function.Oikos,1990,57(1):25-41.
[29] Tilman D,Downing J A,Wedin D A.Does diversity beget stability.Nature,1994,371(6493):257-264.
[30] Zhao P,Peng S L.Species and species diversity in relation with restoration and persistence of degraded ecosystem functions.Chinese Journal of Applied Ecology,2001,12(1):132-136.
[31] Chen G C.Study of Certain Ecological Relationships Between Kandelia candel Vegetation and Common Macro-Benthic Fauna in Jiulongjiang Estuary[D].Xiamen:Xiamen University of Environment,2009.
[32] Kareiva P.Diversity and sustainability on the prairie.Nature,1996,379(6567):673-674.
参考文献:
[3] 张乔民,隋淑珍,张叶春,于红兵,孙宗勋,温孝胜.红树林宜林海洋环境指标研究.生态学报,2001,21(9):1427-1437.
[4] 廖宝文,郑松发,陈玉军,李玫.红树林湿地恢复技术的研究进展.生态科学,2005,24(1):61-65.
[5] 彭逸生,周炎武,陈桂珠.红树林湿地恢复研究进展.生态学报,2008,28(2):786-797.
[7] 陈玉军,廖宝文,郑松发,李玫,宋湘豫.无瓣海桑、海桑、秋茄红树人工林群落动态及物种多样性研究.应用生态学报,2004,15(6):924-928.
[9] 王文卿,王瑁.中国红树林.北京:科学出版社,2007.
[10] 赵永强,曾江宁,高爱根,陈全震,廖一波,寿鹿.椒江口滩涂大型底栖动物群落格局与多样性.生物多样性,2009,17(3):103-112.
[11] 胡知渊,鲍毅新,程宏毅,张龙龙,葛宝明.中国自然湿地底栖动物生态学研究进展.生态学杂志.2009,28(5):959-968.
[12] 叶勇,翁劲,卢昌义,陈光程.红树林生物多样性恢复.生态学报,2006,26(4):1243-1250.
[15] 王伯荪,廖宝文,王勇军昝启杰.深圳湾红树林生态系统及其持续发展.北京:科学出版社,2002.
[16] 安传光,赵云龙,林凌,李嘉尧,崔丽丽,马春艳.崇明岛潮间带夏季大型底栖动物多样性.生态学报,2008,28(2):577-586.
[17] 寿鹿,曾江宁,廖一波,赵永强,江志兵,陈全震,高爱根,杨家新.瓯江口海域大型底栖动物分布及其与环境的关系.应用生态学报,2009,20(8):1958-1964.
[18] 范航清,何斌源,韦受庆.海岸红树林地沙丘移动对林内大型底栖动物的影响.生态学报,2000,20(5):722-727.
[20] 高爱根,陈全震,曾江宁,廖一波,杨俊毅.西门岛红树林区大型底栖动物的群落结构.海洋学研究,2005,23(2):33-40.
[23] 廖金凤.雷州半岛红树林盐土的某些理化性质.土壤,2004,36(5):561-564.
[24] 温远光,刘世荣,元昌安.广西英罗港红树植物种群的分布.生态学报,2002,22(7):1160-1165.
[25] 张雅芝,陈灿忠,王渊源,陈品健,杨瑞琼.福建红树林区底栖生物生态研究.生态学报,1999,19(6):896-901.
[30] 赵平,彭少麟.种、种的多样性及退还生态系统功能的恢复和维持研究.应用生态学报,2001,12(1):132-136.
[31] 陈光程.九龙江口秋茄红树植被与主要大型底栖动物某些生态关系的研究[D].厦门:厦门大学环境科学学院,2009.

