不同起始状态对草原群落恢复演替的影响
杨 晨,王 炜,*,汪诗平,梁存柱,3,王立新
(1.内蒙古大学生命科学学院,呼和浩特 010021;2.中国科学院青藏高原研究所,北京 100085;3.中美生态、能源及可持续性科学内蒙古研究中心,呼和浩特 010021;4.内蒙古大学环境与资源学院,呼和浩特 010021)
锡林郭勒草原是中国四大草原之一,是亚洲中温带半干旱草原的典型代表[1]。它是全国重要的放牧畜牧业基地,又是北方和京津地区重要的绿色屏障。近些年来在利用强度不断增加及不利自然因素影响下,草地大面积退化[2]。
在草地生态学领域,国内外许多研究者从群落生产力、种的形态、数量和分布格局、物种多样性、土壤物理、化学和生物学性状的变化等多方面研究了放牧退化和围封恢复演替过程,获得了许多规律性的认识[3-6]。
王炜等[4]对典型草原因过度放牧而退化的机理进行研究的过程中确定:导致草原群落退化的机理性环节是植物个体小型化,这一过程引起以植物群落生产力下降和优势种更替为主要特征的草原生态系统退化。而退化草原群落的小型化个体的正常化过程一般情况下要历时七八年[5]。然而,如果群落恢复演替的起点不同,其正常化的时间会有变化吗?
关于草原群落的放牧演替已经有了大量的研究[7-12],但不同起始状态(不同牧压导致的退化状态)草原群落的禁牧恢复演替的研究比较少。本文对经历不同放牧率的草原群落在禁牧恢复6a后的植被进行研究,期望回答退化草原群落恢复之前的本底是否对草原群落的恢复有影响,及有何影响的问题。
1 研究区域与实验方法
1.1 研究区域概况
本实验研究样地位于内蒙古锡林河中游,中国科学院内蒙古草原生态系统定位站西侧500 m处(43°26'—44°08'N,116°04'—117°05'E),地势平坦,北边有一条宽约10 km的固定沙带。该样地土壤为沙质栗钙土,栗钙土的腐殖质层呈较均匀的栗色,厚25—35 cm,腐殖质含量为1.5%—3%;地面50 cm以下有明显的钙积层,紧密而坚实。沙质栗钙土由于沙性较重,经开垦或过度放牧后,易遭受风蚀,往往就地起沙,形成沙地。土壤pH值为7.2—7.5。实验区地处内蒙古高原中部,其东缘属大兴安岭西麓低山丘陵区,南接玄武岩台地。该区属内蒙古高平原中部的锡林郭勒高平原和丘陵部分,区域地形东南高达1500 km以上,西北低至约900 m。地形以低山丘陵为特征,坡度较缓,低山相对高差不大于300 m,丘陵相对起伏约为30—150 m。而北部则是蒙古高平原的一部分,以低山丘陵与塔拉相间分布为其特征。中间则是绵延东西、风成的固定沙带。锡林河自东向西流过本区,将本区分成南北两大部分。本区的地貌类型主要是波状高平原,兼有玄武岩台地、沙地、河流等。该区属温带大陆性半干旱气候,冬季寒冷干燥,夏季温暖较湿润。年平均气温0.18℃;年平均降水量349.6 mm,年均净水面蒸发量1641.5 mm。年均日照时数2533 h,大于0℃的积温平均为2428.7℃,大于10℃的多年平均积温为1983.3℃,具有冬寒夏温的中温带气候特征。
1989年夏季开始在该样地进行放牧实验。实验开始时样地是以冷蒿及小禾草为主的退化草原。实验动物为绵羊。共设 SR1 1.33、SR2 2.67、SR3 4.00、SR4 5.33、SR4 6.67 羊/hm2,5 个放牧率及无牧对照(SRO)共6个处理。放牧方式为轮牧,每个放牧率3次重复,轮牧周期45d。试验采用不完全拉丁方设计,小区面积100 m×100 m。到2005年,连续不同放牧率下放牧16a后,植物群落、土壤理化性状等生态系统的结构和功能发生了明显的变化,草原生态系统处于不同的退化阶段。为了探讨这些不同退化阶段的草原生态系统在“围封禁牧”后的恢复进程,于2005年停止了放牧实验,到2011年自然状态下恢复了6a。放牧试验布置见图1。具体设计和管理措施参考李永宏等[13]的文章。

图1 中国科学院草原生态系统定位研究站放牧样地实验设计示意图Fig.1 Experiment design in grazing plot of IMGERS
1.2 研究方法及数据处理
1.2.1 植物群落组成及各个种群地上现存生物量的测定
野外调查与取样在2011年8月进行。在每个围栏及围栏外(围栏外为自然放牧,放牧时间为常年不分季节放牧。由于该处草原紧挨着湿地,是牲畜饮水必经的一个通道,故该处草原植物的啃食、践踏比较严重,植株比较矮小,放牧强度应该比较大,具体强度大小不好统计)做分种产量样方,样方大小1 m×1 m,分种齐地面剪取,记录高度、株丛,剪取的植物于烘箱中65℃烘干至恒重称重,精确至0.01 g,得出地上生物量。每个围栏做5个样方①2005年的地上生物量数据是中国科学院汪诗平老师提供。
1.2.2 植物群落个体性状的测定
在不同放牧率围栏及围栏外选取7种植物,包括羊草(Leymus chinensis)、米氏冰草(Agropyron michnoi)、克氏针茅(Stipa krylovii)、糙隐子草(Cleistogenes squarrosa)、冷蒿(Artemisia frigida)、双齿葱(Allium bidentatum)、木地肤(Kochia prostrata)。其中根茎型植物2种和丛生型植物5种,根茎型植物测定其营养枝高度或者生殖枝高度、植物节间长及对应的叶长、叶宽。丛生型植物测定其营养枝高度或者生殖枝高度。每个围栏每种植物随机选取20株完整个体。
1.2.3 土壤物理性状的测定
用SC-900数显式土壤紧实度仪(USA,量程:0—1000 PSI)测定不同放牧围栏的土壤紧实度(1psi=6.89kPa)。测定土壤紧实度从土壤表层以下到30 cm处,每隔2.5 cm测定1次。取样点是随机的,每个围栏测定10个点。
在植物群落样方调查处测定土壤容重。土壤容重的测定采用环刀法:用容积为100 cm3的土壤环刀分别测定0—10 cm,10—20 cm,20—30 cm,30—40 cm,40—50 cm的土壤容重。每样地重复3个,土壤样品于烘箱中105℃下烘干至恒重,计算土壤容重。
1.2.4 数据处理
数据的分析、统计处理采用Excel 2003完成;用SPSS 16.0进行单因素方差分析及相关性分析;群落排序分析选用主成分分析(PCA),用软件Canoco 4.5制图。
2 结果与分析
2.1 不同放牧率下植物群落排序
根据不同放牧率下草原群落中不同植物的相对生物量,采用主分量分析(PCA)法[14]进行分析。计算结果表明,2005年和2011年前两个主分量分别反映总信息量的75.4%和87.9%。应用前两个主分量值,相互搭配构成的二维排序图(图2)则可充分反映不同放牧率下植物群落的分类和排序。图中的15个圈代表15个样方。15个样方是这样确定的:把每个围栏里做的5个1 m×1 m的小样方,当做一个大样方,共有15个围栏即共有15个大样方。其中样方1—3、4—6、7—9、10—12、13—15 的放牧率分别为 SR1、SR2、SR3、SR4、SR5。由图2可看出:2005年,样方分布较为分散,说明样地间演替起始状态存在差异(尽管群落优势种大致相同,见下文);各样方代表的群落的位置及相对关系发生了变化,这种变化说明在过去的6a中群落演替在进行着;大多数样方向左侧移动,从而导致图的左侧点较密,说明群落在过去6a中的演替具有趋同的态势。
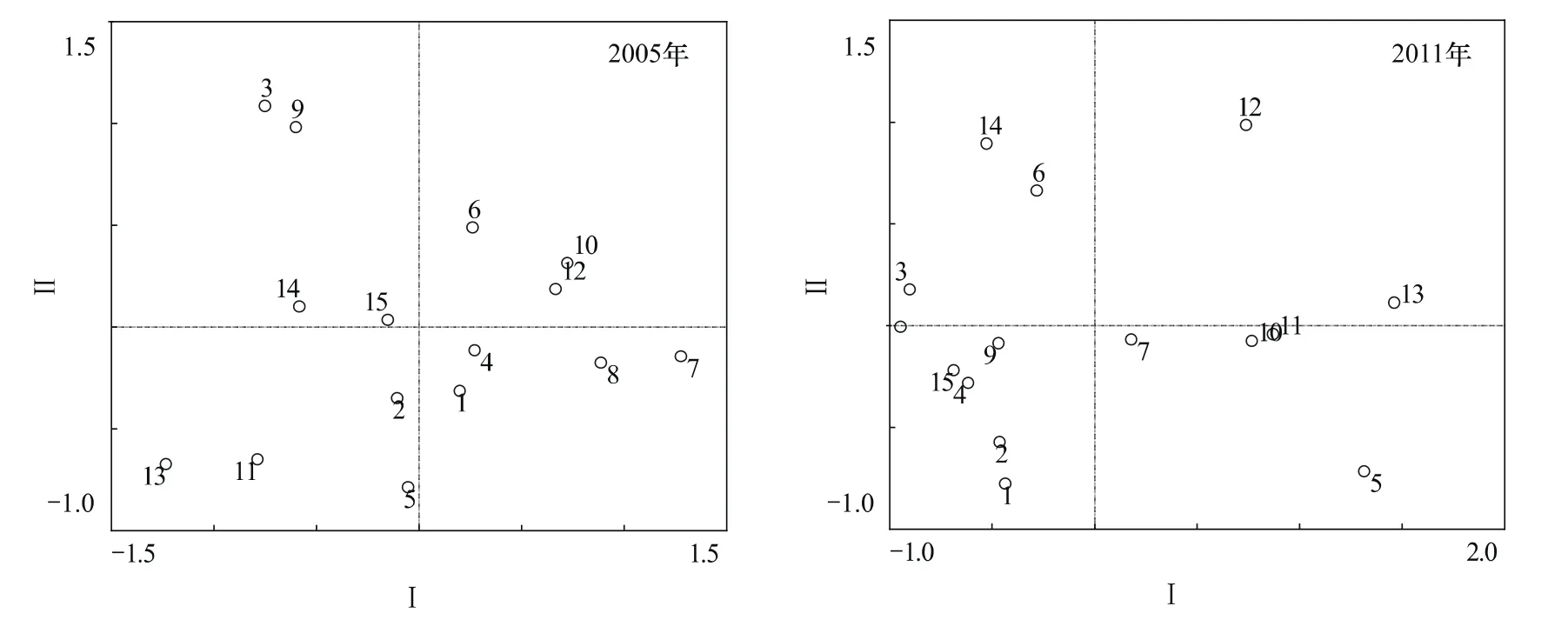
图2 2005年和2011年不同放牧率围栏主成分分析图Fig.2 The diagram of PCA under different grazing rate in 2005 and 2011
2.2 不同放牧率植物群落的群落类型
草原植物群落以优势种和种类组成为特征[15],优势种的更替是植物群落演替的标帜[16]。以下用不同恢复演替阶段植物群落主要植物种的地上生物量作为衡量和判定优势种的指标,即通过对群落中主要物种的地上生物量由高到低进行排序,得出群落的优势种。2005年不同放牧率植物群落类型见表1;2011年不同放牧率植物群落类型见表2。不同放牧率下的草原经过6a的禁牧恢复演替有个共同的规律:即都是由原先冷蒿建群的植物群落演替为木地肤建群的植物群落,又因木地肤是小半灌木,不可能长时期是草原群落的建群种,因此,草原群落将最终演替为克氏针茅建群的草原。
2.3 主要植物种相对生物量的变化
2005年及2011年不同放牧率群落主要植物种相对生物量的变化见表3、表4。不同放牧率退化草原休牧6a后,不同植物种群的相对生物量均表现出不同的变化特征。从各放牧率群落的主要植物种构成上看,2005年,SR1、SR2、SR3、SR4、SR5主要构成植物为冷蒿、木地肤、双齿葱和星毛委陵菜,4者生物量占群落总生物量的比重分别为 79.57%、92.19%、87.28%、95.06%、80.28%;SR0 主要构成植物是冷蒿、木地肤、米氏冰草、羊草,四者生物量占群落总生物量的比重为76.66%。2011年,SR1、SR2、SR3、SR4、SR5主要构成植物为木地肤、克氏针茅、双齿葱、糙隐子草。四者生物量占群落总生物量的比重分别为87.13%、88.53%、84.2%、89.93%、86.57%;SR0主要构成植物是冷蒿、克氏针茅、羊草,三者生物量占群落总生物量的比重为86.83%。总体上看,经过6a的禁牧恢复,群落结构发生了很大的变化,即建群种由冷蒿变成了木地肤,不同放牧率群落中糙隐子草的比例相对较高,而糙隐子草在群落演替过程中是典型衰退种[5],说明群落虽然得到恢复,但是没有恢复到顶级群落状态。

表1 2005年研究样地不同放牧率的植物群落类型Table 1 The type of community in different grazing rate in research plots in 2005

表2 2011年研究样地不同放牧率的植物群落类型Table 2 The type of community in different grazing rate in research plots in 2011
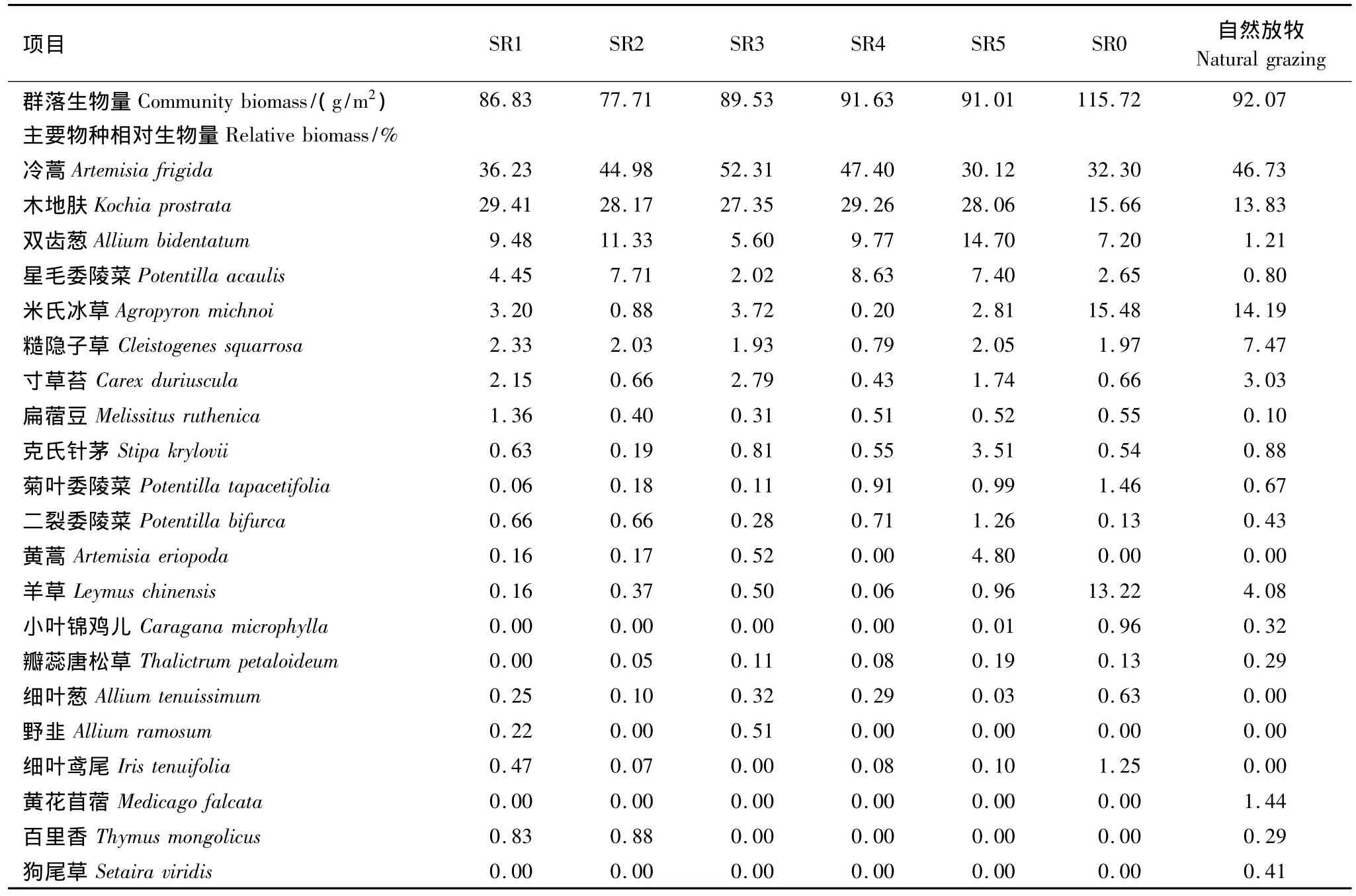
表3 2005年主要植物种相对生物量的变化Table 3 Ghanges of the main plant species relative biomass in 2005

表4 2011年主要植物种相对生物量的变化Table 4 Ghanges of the main plant species relative biomass in 2011
2.4 不同放牧率植物群落地上生物量的差异
植物群落地上生物量是衡量生态系统生产力的重要指标,生态系统退化的最直接表现是群落地上生物量的减少,群落生产力的下降[16]。根据图3可知:2011年不同放牧率群落的生物量显著高于2005年;单因子方差分析表明:2005年,不同放牧率SR1、SR2、SR3、SR4、SR5和围栏外自然放牧群落的地上生物量差异不显著,但他们和对照SR0差异显著,说明无放牧率的围栏已经得到恢复;2011年,随着放牧强度的增大,地上生物量有略微降低的趋势,但 SR1、SR2、SR3、SR4之间差异不显著;SR1、SR2、SR3、SR4、SR0的地上生物量分别和SR5的地上生物量有显著差异;并且不同放牧率群落的地上生物量显著高于围栏外自然放牧群落的地上生物量。
2011年,不同放牧率群落地上生物量SR1、SR2、SR3、SR4之间差异不显著,说明当放牧率≤SR4时,演替的起始状态对当前生物量没有影响;而SR1、SR2、SR3、SR4与SR5群落的地上生物量有显著差异,说明当放牧率>SR4时,演替的起始状态对当前生物量有影响,会导致当前生物量降低,不利于草原的恢复。
2.5 植株高度、植物茎节及对应植物叶片长度和宽度的差异

图3 不同放牧率围栏地上生物量的差异Fig.3 The change of aboveground biomass under different grazing rates
植株高度是既可反映群落外貌,又体现个体大小的定量指标[4]。在不同放牧率围栏及围栏外选取7种植物,其中根茎型植物2种和丛生型植物5种,测定其植物个体特征。结果表明:不同放牧率植物群落经过6a的禁牧恢复,根茎型植物羊草和冰草的植株高度、节间、叶长、叶宽没有显著差异,它们与对照SR0也没有显著差异;但与自然放牧差异显著(表5);丛生型植物克氏针茅、糙隐子草、冷蒿、双齿葱、木地肤的高度没有显著性差异,与对照差异不显著,但与自然放牧差异显著(图4)。

表5 在不同放牧率下植株高度、节间长度和叶片大小的差异Table 5 The difference of plant height,plant internode length and of the length and width of leaf blades in different grazing rate
通过不同放牧率植物群落根茎型植物和丛生型植物个体特征比较,得出不同放牧率群落植物个体特征差异不显著,说明放牧导致的植物“个体小型化”现象消失,植物个体趋向正常化[4]。
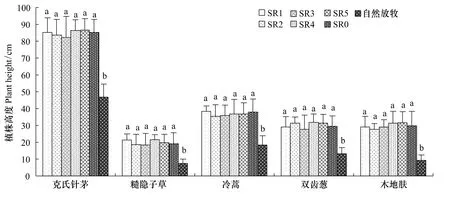
图4 不同放牧率围栏植株高度的差异Fig.4 The change of plant height under different grazing rates
2.6 不同放牧强度土壤紧实度的差异
放牧主要影响表层土壤的理化性质[17]。家畜长期践踏可导致土壤表层附近变得紧实,使土壤通透性变差,这样降雨后水分下渗速率降低,因而易形成地表径流,群落获得的水量会大幅度减少,同时紧实的土壤表层会导致气体交换速率下降,使得植物根系呼吸受到影响,从而加速草原的退化。
在本实验研究区域,经过6a的禁牧恢复,随着深度的增加,土壤紧实度总体呈现出较紧实的趋势(图5),可能是由于土壤深度的增加,钙积层的出现导致紧实度的增加;0—12.5 cm的土层之间,不同放牧强度土壤紧实度表现为自然放牧样地﹥放牧率样地﹥无放牧率样地SR0。由此可知,经过6a的禁牧恢复,5个不同放牧率的禁牧样地仍存在一定的紧实层,无放牧率样地已经不存在紧实层;而围栏外的自然放牧在0—7.5 cm处紧实度急剧上升,其7.5 cm以下的土壤紧实度的变化趋于缓和,说明其存在紧实层;5个不同放牧强度的放牧围栏在0—12.5 cm处土壤紧实度变化趋势及幅度一致。说明不同放牧率导致的土壤紧实,经过6a的自然恢复,紧实度都有降低的趋势,且紧实效果是一致的。从图的变化来看,得出一个重要规律:不同放牧率对土壤紧实度的影响不很明显,随土壤深度的增加其变化趋势基本相似。可能与土壤质地有关。
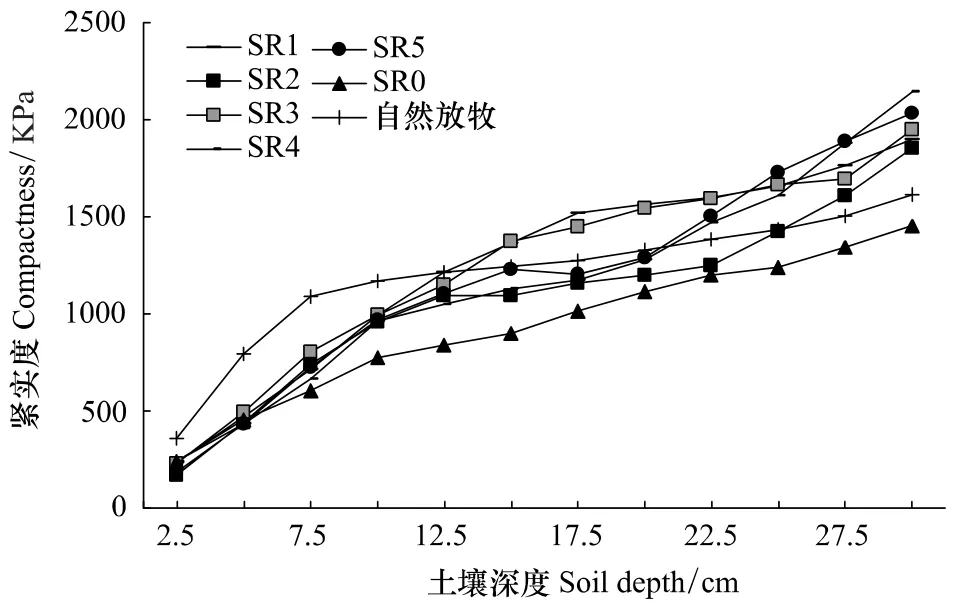
图5 不同放牧率围栏土壤紧实度的差异Fig.5 The change of soil compactness under different grazing rates
2.7 不用放牧强度土壤容重的差异
土壤容重是衡量土壤孔隙度、土壤紧实度的重要指标[18]。土壤容重的大小随质地、结构性和松紧度的变化而变化。容重小,表明土壤疏松多孔;反之,则表明土壤紧实板硬,缺少团粒结构[19]。
在本实验研究区域,不同放牧率的围栏草地土壤容重随土壤深度的增加有增大的趋势。经过6a的自然恢复,0—10 cm土层间,不同放牧率的植物群落土壤容重都比较小且变化幅度一致,并且它们明显高于对照(SR0)的容重,明显低于围栏外的自然放牧的土壤容重(图6)。
3 结论与讨论
3.1 恢复演替过程中群落组成及地上现存生物量的变化趋势
2005年,不同放牧率植物群落中几乎没有1年生植物,而到了2011年,刺穗藜、尖头叶藜和猪毛菜等1年生植物的出现,说明去除牧压后,过剩的资源(退化群落未充分利用的土壤养分与水分等环境资源)释放出来,被1年生植物得到利用。
2011年,不同放牧率群落木地肤含量均比较高,为对此找出一个合理的解释,用2005年无放牧率围栏和2005年退化样地的“退新围栏”(1996年围封,到2005年自然恢复了10a)的植物群落组成进行了比较,退新围栏木地肤相对生物量为0.98%,无放牧率围栏为15.66%,通过对比可以看出:退新围栏的木地肤含量很低,而本试验区无放牧率(SR0)围栏的木地肤含量比较高,已知退新围栏的土壤质地为壤质,无放牧率围栏的土壤质地为沙质,说明可能与不同研究样地的土壤质地有关,木地肤可能更喜欢生长在沙质土壤的环境中,可以推断:经过6a的禁牧恢复,不同放牧率围栏的木地肤较多,很有可能是沙质土壤的缘故。
根据结果分析来看,2005年,随着放牧率的增大,地上生物量没有显著性差异。这可能与优势种都是冷蒿和木地肤有关;也有可能与放牧草场具有极强适牧的营养繁殖和生殖对策有关[20];对照(SR0)2005年(经过16a的围封恢复)的地上生物量显著小于2011年(经过22a的围封恢复),这很有可能与2005年的降水量低有关(2005年:年降水量为166.1 mm,8月合计降水量为13.2 mm;2011年:年降水量为287.8 mm,8月合计降水量为26.8 mm)。
退化草原群落一旦去除牧压,过剩的资源便发挥作用,种群的拓殖能力便驱动群落向顶级群落方向演替[6]。2005年禁牧开始,不同起始状态群落中的过剩资源包括土壤养分与水分等环境资源释放出来,发挥作用,使得群落开始向着顶级群落方向演替。但是,草原群落不同的起始状态,对草原群落地上生物量的恢复产生了一定的影响,根据统计分析结果:当放牧率≤SR4时,对草原群落生物量的恢复没有影响;当放牧率超过SR4时,不利于草原的恢复。这说明SR4是个临界点,如果放牧强度超过这个临界点,说明此时的放牧强度已经很大,对草原群落的地上生物量恢复已经产生不利影响,将会导致草原群落恢复的速度减慢,时间变长。因此,在实际的放牧活动中,要注意放牧强度的控制。
3.2 植物个体性状的变化趋势
从植物个体特征结果分析来看,虽然群落恢复演替的起点不同,但植物个体趋向正常化的时间几乎是一致的。研究不同群落状态恢复演替规律时,植物个体性状可以作为一个很好的辅助指标来考虑。
3.3 土壤物理性质的变化趋势
放牧使土壤表层,尤其是0—5 cm变得紧实,并且土壤硬度在0—20 cm随放牧强度增加呈先增后减趋势[21]。这与本研究的结果相类似。经过6a的禁牧恢复,各放牧率样地在0—12.5 cm处的紧实度均明显大于对照(SR0),且小于围栏外自然放牧的紧实度。这表明土壤虽得到恢复,但仍没有恢复完全,仍存在一定的紧实层[22]。土壤容重与紧实度的规律一致。
总之,作为退化草地治理的手段之一,休牧通过自然力的作用使退化草地植被和土壤状况得以改善[23]。本项研究不同起始状态的草原群落经过6a的禁牧恢复,总结得出以下结论:
(1)不同放牧率的植物群落,经过6a的禁牧恢复,群落类型发生了变化且群落趋于一致。
(2)当放牧率SR≤5.33羊/hm2(SR4)时,演替起始状态对草原群落地上生物量的恢复没有影响;当放牧率SR>5.33羊/hm2时,演替起始状态对草原群落地上生物量的恢复产生影响,其结果是导致当前生物量降低,不利于草原的恢复。
(3)不同放牧率植物群落的植物个体特征趋于一致,“个体小型化”现象消失。同时,也说明群落恢复演替的起点不同,正常化的时间没有太大的变化。
(4)不同放牧率植物群落的土壤紧实度和容重经过6a的禁牧恢复,没有得到完全恢复,但均达到一致的水平。
[1] Inner Mongolia-Ningxia Synthetical Inspection Group of Science Academy of China.Vegetation of Inner Mongolia.Beijing:Science Press,1985.
[2] Li B.The rangeland degradation in north China and its preventive strategy.Scientia Agricultura Sinica,1997,30(6):1-9.
[3] Liu Z L,Wang W,Hao D Y,Liang C Z.Probes on the degeneration and recovery succession mechanisms of Inner Mongolia steppe.Journal of Arid Land Resources and Environment,2002,16(1):84-91.
[4] Wang W,Liang C Z,Liu Z L,Hao D Y.Analysis of the plant individual behavior during the degradation and restoring succession in steppe community.Acta Phytoecologica Sinica,2000,24(3):268-274.
[5] Wang W,Liang C Z,Liu Z L,Hao D Y.Research on restoring succession of the degenerated grassland in Inner Mongolia Ⅳ.Analysis of plant population dynamics during restoring succession.Journal of Arid Land Resources and Environment,1999,13(4):44-55.
[6] Wang W,Liu Z L,Hao D Y,Liang C Z.Research on the restoring succession of the degenerated grassland in Inner Mongolia Ⅰ.Basic characteristics and driving force for restoration of the degenerated grassland.Acta Phytoecologica Sinica,1996,20(5):449-459.
[7] Wang D L,Lv X L,Luo W D.Analysis to effects of different grazing density on characteristics of rangeland vegetation.Acta Prataculturae Sinica,1996,5(3):28-33.
[8] Liu Z L,Wang W,Liang C Z,Hao D Y.The regressive succession pattern and its diagnostic of Inner Mongolia steppe in sustained and superstrong grazing//Acta Agrestia Sinica,1998,6(4):244-251.
[9] Li Y H.The divergence and convergence of aneurolepidium chinense steppe and stipa grandis steppe under the grazing influence in Xilin river valley,Inner Mongolia.Acta Phytoecologica et Geobotanica Sinica,1988,12(3):189-196.
[10] Wang S P,Li Y H,Wang Y F,Chen Z Z.Influence of different stocking rates on plant diversity of artemisia frigida community in Inner Mongolia steppe.Acta Botanica Sinica,2001,43(1):89-96.
[11] Zhou X M,Wang Q J,Zhang Y Q,Zhao X Q,Lin Y P.Quantitative analysis of succession law of the alpine meadow under the differerent grazing intensities.Acta Phytoecologica Sinica,1987,11(4):276-285.
[12] Ellison L.Influence of grazing on plant succession of rangelands.The Botanical Review,1960,26(1):1-78.
[13] Li Y H,Chen Z Z,Wang S P,Huang D H.Grazing experiment for sustainable management of grassland ecosystem of Inner Mongolia steppe:experimental design and the effects of stocking rates on grassland production and animal liveweight.Acta Agrestia Sinica,1999,7(3):173-182.
[14] Zhang J T.Quantitative Ecology.Beijing:Science Press,2011:137-143.
[15] Chen Z Z,Wang S P.Chinese Typical Grassland Ecosystem.Beijing:Science Press,2000.
[16] Wang W,Liu Z L,Hao D Y,Liang C Z.Research on the restoring succession of the degenerated grassland in Inner Mongolia Ⅱ.Analysis of the restoring processes.Acta Phytoecologica Sinica,1996,20(5):460-471.
[17] Greene R S B,Kinnell P I A,Wood J T.Role of plant cover and stock trampling on runoff and soil-erosion from semi-arid wooded rangelands.Australian Journal of Soil Research,1994,32(5):953-973.
[18] Drewry J J,Lowe J A H,Paton R J.Effect of sheep stocking intensity on soil physical properties and dry matter production on a Pallic Soil in Southland.New Zealand Journal of Agricultural Research,1999,42(4):493-499.
[19] Li D R.Practical Handbook of Soil Fertilizer.Beijing:China Agricultural Science and Technology Press,1989:544-546.
[20] Li Y H,Wang S P.Vegetative reproductive strategies of plant population to livestock grazing.Research on Grassland Ecosystem(No.5).Beijing:Science Press,1997:23-31.
[21] Jia S H,Wang C Z,Sun Z T,Li S L,Chen Y J,Jin C W.Study on grassland dark sandy chestnut compaction by grazing intensity and grazing season.Acta Agrestia Sinica,1999,7(3):217-222.
[22] Wang D B.Phenomenon analysis and primary study of mechanisms on root shallow-distributi in degenerated community in Inner Mongolia Typical[D].Hohhot:Inner Mongolia University,2007.
[23] Liu Z K,Wang S P,Chen Z Z,Wang Y F,Han J G.Properties of soil nutrients and plant community after rest grazing in Inner Mongolia steppe,China.Acta Ecologica Sinica,2006,26(6):2048-2056.
参考文献:
[1] 中国科学院内蒙古宁夏综合考察队.内蒙古植被.北京:科学出版社,1985.
[2] 李博.中国北方草地退化及其防治对策.中国农业科学,1997,30(6):1-9.
[3] 刘钟龄,王炜,郝敦元,梁存柱.内蒙古草原退化与恢复演替机理的探讨.干旱区资源与环境,2002,16(1):84-91.
[4] 王炜,梁存柱,刘钟龄,郝敦元.草原群落退化与恢复演替中的植物个体行为分析.植物生态学报,2000,24(3):268-274.
[5] 王炜,梁存柱,刘钟龄,郝敦元.内蒙古草原退化群落恢复演替的研究 Ⅳ.恢复演替过程中植物种群动态的分析.干旱区资源与环境,1999,13(4):44-54.
[6] 王炜,刘钟龄,郝敦元,梁存柱.内蒙古草原退化群落恢复演替的研究 Ⅰ.退化草原的基本特征与恢复演替动力.植物生态学报,1996,20(5):449-459.
[7] 王德利,吕新龙,罗卫东.不同放牧密度对草原植被特征的影响分析.草业学报,1996,5(3):28-33.
[8] 刘钟龄,王炜,梁存柱,郝敦元.内蒙古草原植被在持续牧压下退化演替的模式与诊断.草地学报,1998,6(4):244-251.
[9] 李永宏.内蒙古锡林河流域羊草草原和大针茅草原在放牧影响下的分异和趋同.植物生态学和地植物学学报,1988,12(3):189-196.
[10] 汪诗平,李永宏,王艳芬,陈佐忠.不同放牧率对内蒙古冷蒿草原植物多样性的影响.植物学报,2001,43(1):89-96.
[11] 周兴民,王启基,张堰青,赵新全,林亚平.不同放牧强度下高寒草甸植被演替规律的数量分析.植物生态学报,1987,11(4):276-285.
[13] 李永宏,陈佐忠,汪诗平,黄德华.草原放牧系统持续管理试验研究:试验设计及放牧率对草-畜系统影响分析.草地学报,1999,7(3):173-182.
[14] 张金屯.数量生态学.北京:科学出版社,2011:137-143.
[15] 陈佐忠,汪诗平.中国典型草原生态系统.北京:科学出版社,2000.
[16] 王炜,刘钟龄,郝敦元,梁存柱.内蒙古草原退化群落恢复演替的研究 Ⅱ.恢复演替时间进程的分析.植物生态学报,1996,20(5):460-471.
[19] 李笃仁.实用土壤肥料手册.北京:中国农业科技出版社,1989:544-546.
[20] 李永宏,汪诗平.草原植物对家畜放牧的营养繁殖对策初探//草原生态系统研究(第5集).北京:科学出版社,1997:23-31.
[21] 贾树海,王春枝,孙振涛,李绍良,陈有君,靳存旺.放牧强度和时期对内蒙古草原上土壤压实效应的研究.草地学报,1999,7(3):217-222.
[22] 王东波.内蒙古典型草原退化群落植物根系分布浅层化的现象分析与机理探讨[D].呼和浩特:内蒙古大学,2007.
[23] 刘忠宽,汪诗平,陈佐忠,王艳芬,韩建国.不同放牧强度草原休牧后土壤养分和植物群落变化特征.生态学报,2006,26(6):2048-2056.

