茉莉酸对棉花单宁含量和抗虫相关酶活性的诱导效应
杨世勇,王蒙蒙,谢建春
(1.安徽师范大学生命科学学院,芜湖 241000;2.安徽师范大学生物环境与生态安全省级重点实验室,芜湖 241000;3.安徽师范大学环境科学与工程学院,芜湖 241000)
诱导抗性是植物界存在的普遍现象,能通过对昆虫取食、产卵偏好、繁殖力、发育历期、免疫力、解毒力、被捕食和被寄生比率以及生活史其它特征的影响,间接调控害虫的种群密度和种群增长[1-7]。茉莉酸(jasmonic acid,JA)是一种具有多种生理功能的植物激素,除调节植物的基础发育外,还在植物的伤反应、臭氧和紫外线暴露、病原菌侵染、昆虫取食和水分胁迫反应中起信号传递的作用,诱导植物直接和间接防御反应的发生[8-9]。JA 及其功能类似物茉莉酸甲酯 (methyl jasmonate,MeJA)处理后,番茄[1]、甘蓝[2,10]、拟南芥[3]、枸杞[5-6]、豌豆[11]、落叶松[12]、玉米[13-14]、水稻[15]、花生[16]等植物叶片或根部防御相关酶活性增强、防御性次生代谢物含量或挥发性有机物释放量增加,对害虫的抗性提高,但在棉花中相关研究并不多[7,17-18],对棉花抗虫性诱导的生化机理、浓度依赖性和持久性尚未见报道。本研究以棉花幼苗为试材,以不同浓度茉莉酸为诱导子,从棉花幼苗多酚氧化酶 (Polyphenol oxidase,PPO)、过氧化物酶 (Peroxidase,POD)、过氧化氢酶(Catalase,CAT)和苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)活性以及棉叶丹宁和胰蛋白酶抑制素(Proteinase inhibitors,PIs)含量的诱导入手,探讨茉莉酸诱导棉花幼苗抗虫性的浓度依赖性和持久性,为农业害虫的防治和生物安全农药的研发提供理论与实验依据。
1 材料与方法
1.1 材料培养与茉莉酸处理
供试棉花(Gossypium hirsutum L.)种子皖棉28F1购自芜湖市城南某种子公司,由安徽省农业科学研究院研制。将颗粒饱满的种子于室内催芽,待种子露白后播于盛满黄壤土∶草木灰∶砂子重量比1∶1∶1的塑料花盆(底面半径r=9 cm;盆高H=15 cm)中于大棚内育苗。棚内光照约为自然光照的85%。育苗期间根据情况适时浇水,无施肥。待幼苗长出2片真叶后,间苗至每盆4株。幼苗长至5—6片真叶时(出苗后45d左右)用于实验。实验设4个处理(包括对照),每处理重复4次。
茉莉酸(≥95%,Sigma-Aldrich)用无水乙醇和蒸馏水稀释成浓度为0.01、0.1和1.0 mmol/L的溶液。以无水乙醇 +蒸馏水为对照,用手持式喷雾器向棉株均匀喷施,直到叶面有液滴落下为止。为减少茉莉酸因蒸发损失,喷施后用透明塑料袋将整株套住,8h后移除塑料袋,并分别于喷施茉莉酸后1、7、14d采集棉花叶片进行生化分析。植物样从每盆的4株植物上采取并混合。
1.2 测定方法
1.2.1 棉叶单宁含量的测定
棉叶单宁含量采用香草醛法进行测定[19]。取0.2 g棉叶剪碎后浸入25 mL甲醇中提取2 h,再取上清液和4% 的香草醛-甲醇溶液各2.0 mL,与1.0 mL盐酸混合后于 30℃水浴中保温20 min。室温下用 PG-1810APC(普析通用,北京)分光光度计测定510 nm下的吸光度值。以不同浓度单宁酸为标样绘制单宁浓度与吸光度的标准曲线并计算单宁含量。单宁含量用mg/g鲜重表示。
1.2.2 PIs含量的测定
PIs根据Stout等的方法进行测定[20]。准确称取0.2 g棉花叶片,用4 mL含有7% 的PVP、1.67 mmol/L苯硫脲、0.3 mol/L KCl和0.4 mmol/L抗坏血酸的 Tris-HCl缓冲液 (50 mmol/L,pH值7.8)研磨成匀浆。再将匀浆在13000 r/min,4°C下离心10 min,上清液用于测定棉胰凝乳蛋白酶含量。测定时,先在含有0.0015 mg胰凝乳蛋白酶的HCl溶液(1.0 mmol/L)中加入等量提取液混合反应10 min,再取100 μL混合液与2.9 mL含有0.5 mmol/L BTEE(N-苯甲酰-L-酪氨酸乙酯)的甲醇-磷酸缓冲液 (pH值 8.0)混匀,于256 nm下测定10 min内吸光度的变化值。用BTEE和胰凝乳蛋白酶作对照。单位时间内吸光度值变化0.01代表生成一个单位PIs(单位U),PIs含量用U/g鲜重表示。
1.2.3 PAL、PPO、POD 和 CAT 活性的测定
酶液提取:于冰浴中将0.2 g棉花叶片用1.25 mL含有体积分数7%PVPP的磷酸缓冲液 (0.1 mol/L,pH值7.4)研磨成匀浆,再向匀浆中加入0.4 mL体积分数10%的Trition X-100,混匀后在10000 g,4℃ 下离心10 min。上清液直接用于PPO、POD、CAT和PAL活性测定。酶活性测定温度为25℃。
PAL活性参照邹志燕和王振中的方法进行测定[21]。在2.80 mL含有L-苯丙氨酸 (20 mmol/L)的硼酸缓冲液 (0.2 mol/L,pH值8.8)中加入20 μL酶提取液,混匀后于290 nm处测定2 min内吸光度值的变化。OD290每增加0.01个单位相当于生成了1 μg/mL肉桂酸,PAL活性用μg·g-1鲜重·min-1表示。
PPO活性以邻苯二酚为底物,参照Tan等的方法进行测定[22]。在2.90 mL含有邻苯二酚 (0.02 mol/L)的磷酸缓冲液 (0.2 mol/L,pH值7.4)中加入100 μL酶提取液,混匀后于420 nm处测定2 min内吸光度值的变化。以每分钟吸光度值变化0.01表示1个酶活力单位,PPO活性用U·g-1鲜重·min-1表示。
POD活性以愈创木酚为底物,参照Kumari等的方法进行测定[23]。在2.99 mL含有0.2% 愈创木酚和0.3%H2O2的磷酸缓冲液 (0.05 mol/L,pH值7.4)中加入10 μL酶提取液,混匀后于470 nm处测定3 min内吸光度值的变化。以每分钟吸光度值变化0.1表示1个酶活力单位,POD活性用U·g-1鲜重·min-1表示。
CAT活性参照Kumari等的方法进行测定[23]。在含有0.3%H2O2的磷酸缓冲液 (0.05 mol/L,pH值7.0)中加入20 μL酶提取液,混匀后于240 nm处测定2 min内吸光度值的变化。以每分钟吸光度值变化0.1表示1个酶活力单位,CAT活性用U·g-1鲜重·min-1表示。
1.3 数据处理与分析
以酶活性和单宁含量为自变量,以茉莉酸浓度和时间为固定因子,采用单变量多因素方差分析对数据进行处理,并进行Tukey HSD多重比较(SPSS 15.0,P=0.05)。浓度和处理后时间对酶活性和单宁含量的影响用一维方差分析(One-way analysis of variance)进行检验,并进行Tukey HSD多重比较 (P=0.05)。
2 结果与分析
2.1 茉莉酸处理对棉花单宁含量的影响
由表1可知,茉莉酸浓度和处理后时间以及浓度和时间的交互作用对棉叶单宁含量影响极显著(P<0.001)。不同浓度茉莉酸诱导效果的多重比较表明:0.1 mmol/L和1.0 mmol/L茉莉酸处理组棉叶单宁含量均明显高于对照 (P <0.001);0.1 mmol/L茉莉酸的诱导效果明显优于0.01 mmol/L(P <0.001),但和1.0 mmol/L 的差异不显著 (P=0.057)。
处理后不同时间单宁含量的多重比较表明:处理后第14天棉叶单宁含量明显高于第1天和第7天(P<0.001),但第1天和第7天棉叶单宁含量差异不明显 (P=0.106)。

表1 茉莉酸及茉莉酸处理后时间对棉单宁含量影响的主效应检验Table 1 Main effects of JA treatment and time after JA treatment on tannin contents of cotton leaves
浓度与处理后天数对棉叶单宁含量影响的多重比较表明(图1):茉莉酸处理后1天,各处理组棉叶单宁含量均明显高于对照,但以0.1 mmol/L茉莉酸处理组单宁含量最高,且与0.01 mmol/L和1.0 mmol/L两处理组存在组间 (P=0.002)差异。处理后7天,0.1 mmol/L茉莉酸处理组棉叶单宁含量仍明显高于对照和0.01与 1.0 mmol/L处理组 (P 值分别为 < 0.001,0.002和0.001)。处理后 14d,1.0 mmol/L 茉莉酸处理组棉叶单宁含量明显高于对照 (P=0.042);0.1和1.0 mmol/L处理组单宁含量明显高于0.01 mmol/L处理组 (P=0.007 和 0.006)。

图1 茉莉酸处理对棉叶单宁含量的影响Fig.1 Effects of JA treatment on tannin content in cotton leaves
2.2 茉莉酸处理对PIs含量的影响
由表2可知,JA浓度和处理后时间对棉叶PIs含量影响极显著(P<0.001)。不同浓度茉莉酸诱导效果的多重比较表明:0.01 mmol/L和0.1 mmol/L茉莉酸处理组棉叶的 PIs含量明显高于对照 (P=0.027和0.000),但 0.1 mmol/L 茉莉酸的诱导效果明显高于 0.01 mmol/L 和 1.0 mmol/L(P=0.046 和 0.002);0.01 mmol/L和1.0 mmol/L茉莉酸的诱导效果差异不明显 (P=0.6)。

表2 茉莉酸及茉莉酸处理后时间对棉叶PIs含量影响的主效应检验Table 2 Main effects of JA treatment and time after JA treatment on PIs contents of cotton leaves
处理后不同时间PIs含量的多重比较表明:处理后第7天棉叶PIs含量明显高于第1天(P=0.038)和第14天(P <0.001),但处理后第1天的PIs含量却明显高于第14天(P=0.002)。
浓度与处理后天数对棉叶PIs含量影响的多重比较表明 (图2):处理后1d,0.1 mmol/L茉莉酸处理组棉叶PIs含量明显高于对照 (P=0.049),但和其它两处理组间的差异并不显著。处理后第7天,0.01 mmol/L和0.1 mmol/L茉莉酸处理组棉叶内PIs明显高于对照 (P=0.032和 0.035)。处理后第 14天,除 0.1 mmol/L茉莉酸处理组和对照组有显著差异外 (P<0.03),其它各组间的差异不显著。
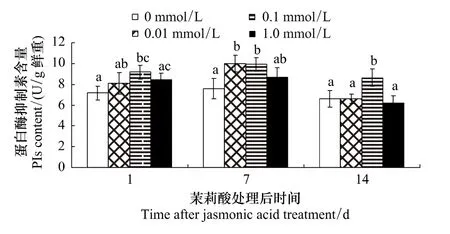
图2 茉莉酸处理对棉叶PIs含量的影响Fig.2 Effects of JA treatment on PIs content in cotton leaves
2.3 茉莉酸处理对棉叶PPO活性的影响
由表3可知,JA浓度和处理后时间以及浓度和时间的交互作用对棉叶PPO活性的影响明显。不同浓度茉莉酸诱导效果的多重比较表明:茉莉酸处理组棉叶PPO活性明显高于对照 (P <0.004);0.1 mmol/L茉莉酸的诱导效果明显高于 0.01 mmol/L和1.0 mmol/L(P=0.001),但0.01 mmol/L和1.0 mmol/L组无组间差异。
处理后不同时间PPO活性的多重比较表明:处理后第7天棉叶PPO活性明显高于第14天 (P=0.012),但和第1天差异不明显 (P=0.52)。

表3 茉莉酸及茉莉酸处理后时间对棉叶PPO活性影响的主效应检验Table 3 Main effects of JA treatment and time after JA treatment on PPOs activities of cotton leaves
浓度与处理后天数对棉叶PPO活性影响的多重比较表明(图3):3种浓度茉莉酸处理均提高了棉叶的PPO活性,但各浓度的诱导效应不同 (P <0.05)。处理后1d和7d,0.1 mmol/L和 1.0 mmol/L 处理组棉叶PPO活性均明显高于对照组 (处理后第1天,P=0.002 和 0.038;处理后第7天,P=0.006 和 0.04,但组间差异不明显)。处理后14d,0.1 mmol/L组棉叶PPO活性明显高于对照和1.0 mmol/L组 (P=0.006和0.009),其它各处理组间差异不明显。
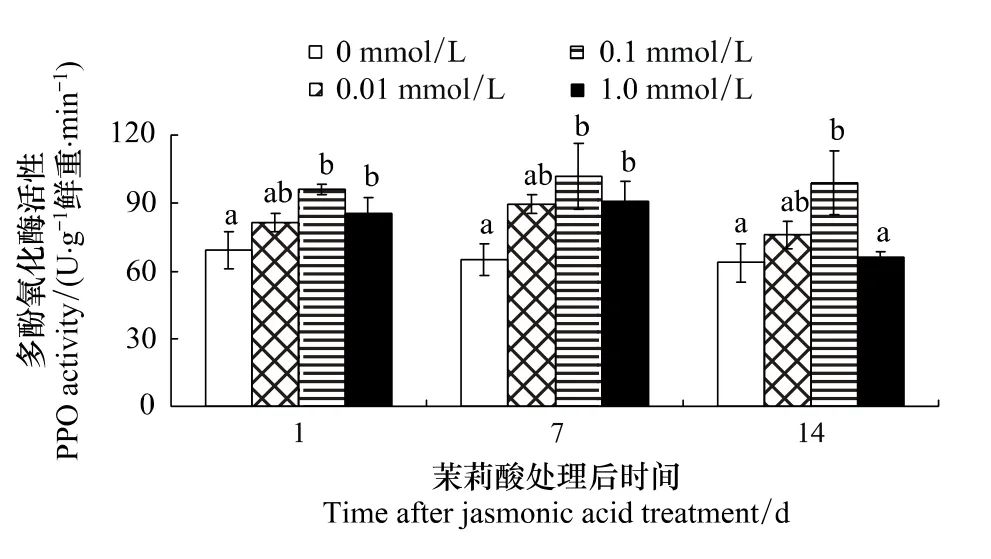
图3 茉莉酸处理对棉叶PPO活性的影响Fig.3 Effects of JA treatment on PPO activity of cotton leaves
2.4 茉莉酸处理对棉叶PAL活性的影响
由表4可知,JA浓度和处理后时间对棉叶PAL活性的影响明显(P <0.001)。不同浓度茉莉酸诱导效果的多重比较表明:0.1 mmol/L和1.0 mmol/L茉莉酸处理组棉叶的PAL活性明显高于对照 (P <0.001),但0.01 mmol/L茉莉酸处理组较对照组差异不明显(P=0.132);0.1 mmol/L茉莉酸处理组棉叶的 PAL活性明显高于0.01 mmol/L组 (P <0.001),但较1.0 mmol/L JA处理组差异不显著 (P=0.057)。
处理后不同时间PAL活性的多重比较表明:处理后第7天和第14天棉叶的PAL活性均明显高于第1天 (P=0.000和0.006),但第7天和14天棉叶的PAL活性差异不明显 (P=0.106)。

表4 茉莉酸及茉莉酸处理后时间对棉叶PAL活性影响的主效应检验Table 4 Main effects of JA treatment and time after JA treatment on PAL activities of cotton leaves
浓度与处理后天数对棉叶PAL活性影响的多重比较表明(图4):处理后1d各组间PAL活性均无明显差异。处理后7d,0.1和1.0 mmol/L组PAL活性均明显高于对照 (P=0.003和0.007),但组间差异不明显(P=0.86)。处理后 14d,0.1 mmol/L 组棉叶 PAL活性明显高于对照组和0.01 mmol/L组 (P <0.05),但较1.0 mmol/L茉莉酸处理组差异不明显。
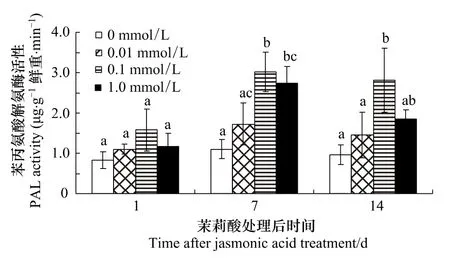
图4 茉莉酸处理对棉叶PAL活性的影响Fig.4 Effects of JA treatment on PAL activities of cotton leaves
2.5 茉莉酸处理对棉叶POD活性的影响
由表5可知,JA浓度和处理后时间以及浓度和时间的交互作用对棉叶POD活性的影响极显著 (P<0.001)。不同浓度茉莉酸诱导效果的多重比较表明:0.1 mmol/L和1.0 mmol/L茉莉酸处理组棉叶的POD活性均明显高于对照(P <0.001);0.1 mmol/L茉莉酸的诱导效果明显高于0.01 mmol/L和1.0 mmol/L(P <0.001),而1.0 mmol/L茉莉酸的诱导效果明显优于 0.01 mmol/L(P=0.041)。
处理后不同时间POD活性的多重比较表明:处理后第7天和第14天棉叶的POD均明显低于第1天(P=0.001和0.000),但第7天和14天棉叶的POD活性差异不明显。

表5 茉莉酸及茉莉酸处理后时间对棉叶POD活性影响的主效应检验Table 5 Main effects of JA treatment and time after JA treatment on POD activities of cotton leaves
浓度与处理后天数对棉叶POD活性影响的多重比较表明 (图5):处理后第1天,0.1 mmol/L和1.0 mmol/L组棉叶POD活性显著高于对照 (P <0.001),且存在组间差异 (P <0.01)。处理后第7天和14天,0.1 mmol/L组棉叶POD活性均明显高于其它各组 (P <0.01)。
2.6 茉莉酸处理对棉叶CAT活性的影响
由表6可知,JA浓度以及浓度和时间的交互作用对棉叶CAT活性的影响明显(P <0.05)。不同浓度茉莉酸诱导效果的多重比较表明:0.1 mmol/L茉莉酸的诱导效果明显高于1.0 mmol/L(P=0.005)。虽然0.1 mmol/L和0.01 mmol/L处理的组间差异不明显,但0.1 mmol/L茉莉酸处理组的 CAT活性却较0.01 mmol/L茉莉酸处理组高。处理后不同时间CAT活性的多重比较表明各处理组间CAT活性均无明显差异。

表6 茉莉酸及茉莉酸处理后时间对棉叶CAT活性影响的主效应检验Table 6 Main effects of JA treatment and time after JA treatment on CAT activities of cotton leaves

图5 茉莉酸对棉叶POD活性的影响Fig.5 Effects of JA treatment on POD activities of cotton leaves

图6 茉莉酸对棉叶CAT活性的影响Fig.6 Effects of JA treatment on CAT activities of cotton leaves
浓度与处理后天数对棉叶CAT活性影响的多重比较表明(图6):0.01 mmol/L和0.1 mmol/L茉莉酸对棉叶过氧化氢酶活性有明显影响 (P <0.05)。处理后1d和7d,0.01 mmol/L和0.1 mmol/L茉莉酸处理组棉叶CAT活性均明显高于对照(处理后第1天,P=0.008和0.004;处理后第7天,P=0.017和0.005,但组间差异不明显(图6)。处理后14d,各组棉叶CAT活性均无明显差异。
3 讨论
茉莉酸是一种具有多种功能的植物生长调节物,能通过防御相关基因的增强表达和抗虫相关化合物的增量合成提高植物的抗虫性。植物抗性诱导的效率取决于诱导因子施用的时机和浓度,诱导抗性只有发生在食草昆虫生长和发育的关键期时才能发挥最大效率。本研究表明,茉莉酸在诱导棉花幼苗抗虫相关次生代谢物含量和相关酶活性方面存在浓度依赖性和滞后性。棉花单宁、PIs、PPO、POD、PAL和CAT等对JA处理的敏感性和滞后期各不相同。
3.1 茉莉酸对棉花单宁的诱导
单宁又称植物多酚,能与昆虫的唾液蛋白和消化酶结合,引起昆虫消化酶失活,干扰昆虫对植物蛋白的消化吸收[24]。外源茉莉酸或茉莉酸甲酯对植物单宁含量有一定的诱导作用,但存在浓度依赖性和滞后性。冯远娇等研究外源茉莉酸对玉米(Zea mays)幼苗化学防御的系统诱导时发现,0.1 mmol/L茉莉酸处理后48 h玉米叶片总酚含量明显高于对照,而其它浓度如0.01,0.05和0.2 mmol/L对玉米幼苗总酚的诱导不明显,在48 h以前甚至抑制玉米幼苗的酚酸合成[14]。用更低浓度的 MeJA诱导玉米幼苗异羟肟酸 (hydroxamic acid)和酚酸时发现,1 μL/L和2 μL/L(约0.005 mmol/L和 0.01 mmol/L)的MeJA 处理后 48 h,处理组幼苗叶内酚酸含量明显高于对照[25],但10 mmol/L JA对玉米叶片总酚的诱导只局限在处理后 3—6 h[13]。Moreira等研究发现,用5 mmol/L MeJA处理海岸松 (Pinus pinaster)幼苗后60d,针叶的总酚含量升高不明显[26]。本研究没有采用低于0.01 mmol/L和高于1.0 mmol/L的JA对棉花幼苗进行处理,也没有测定24 h以内JA的快速诱导效应,但不排除更低或更高浓度JA对棉花幼苗单宁含量的诱导。实验所采用的3种浓度的茉莉酸均能在14d内诱导棉花幼苗叶片单宁含量升高。如果采样时间延长,可能也会发现更长的诱导滞后期。
茉莉酸及功能类似物诱导植物抗性的浓度依赖性和滞后期表明,茉莉酸、茉莉酮和茉莉酸甲酯都能诱导落叶松单宁含量明显升高,且以0.1 mmol/L茉莉酸的诱导效果最好,滞后期为10—20d[12]。宫玉艳等对枸杞的研究表明,0.1 mmol/L茉莉酸处理5d后,枸杞叶片单宁酸含量增幅最大[6]。海岸松经40 mmol/L MeJA处理后2周,针叶内总酚含量比对照植物高1.9倍[27]。本研究发现0.1和1.0 mmol/L茉莉酸在诱导棉叶单宁含量上等效,JA处理后第14天单宁含量最高,在诱导最佳浓度和滞后期方面分别与枸杞[6]、落叶松[12]和玉米[14]、海岸松[27]等相似。
3.2 茉莉酸对棉叶PIs和 PPO的诱导
PPO是与植物抗虫性密切相关的抗营养蛋白,其催化酚氧化所生成的醌极易攻击并烷基化某些必需氨基酸如半胱氨酸、赖氨酸、组氨酸和甲氨酸,引起昆虫营养失调,抑制幼虫生长和发育[28]。PIs亦称抗消化蛋白酶,能通过抑制昆虫中肠消化酶活性而影响昆虫对植物营养的获取、吸收、发育,甚至引起幼虫死亡[29]。前人研究发现,番茄幼苗经1.5 mmol/L茉莉酸甲酯处理后4d,叶片PPO和PIs活性明显升高[22]。1—2年生油松经0.1 mmol/L茉莉酸甲酯(浓度根据原文计算而得)处理48 h后,球果的PPO活性与PIs含量均明显高于对照[30]。本研究发现,棉花幼苗经0.01、0.1和1.0 mmol/L 3种浓度 JA处理后,PIs含量和 PPO活性均不同程度升高,说明外源JA能通过诱导棉花抗营养酶和抗消化酶活性而提高棉花幼苗的抗虫性。另有研究发现,0.1、0.5、1.0 和 5.0 mmol/L 茉莉酸甲酯也能诱导番茄叶片 PIs含量上升,持久期可达 2 周[31]。木豆(Cajanus cajan)经 0.1 mmol/L茉莉酸甲酯处理后 24 h,叶片的 PIs活性明显升高[32]。辐射松 (Pinus radiata)幼苗经4.5 mmol/L茉莉酸甲酸处理后4d,针叶的 PPO活性比对照高2.3倍,但当 MeJA浓度高于4.5 mmol/L时,却对幼苗有毒[33]。本研究发现,0.1 mmol/L茉莉酸的诱导效果最佳,诱导的滞后期可达2周,但以JA处理后第7天棉叶的PIs含量和PPO活性最高,并没有观察到JA对棉花幼苗的植物毒性。就诱导的最佳浓度而言,与李新岗等对辐射松[30]和 Lomate和 Hivarel[33]对木豆的研究相同;就诱导的滞后期而言,与Fujimoto等[31]对番茄的研究类似。虽然也有研究表明茉莉酸甲酯在诱导番茄 PIs含量上效果不明显[34],但本研究所使用的3种浓度均在一定程度上诱导了棉花幼苗PIs含量的升高。
3.3 茉莉酸对棉叶PAL的诱导
茉莉酸处理能提高叶片的PAL活性[21,35]。豌豆幼苗经JA处理后叶片PAL活性明显上升[35]。水稻幼苗经0.1 mmol/L茉莉酸处理后PAL活性升高,抗稻瘟性也随之增强,持久期可长达15d[21]。本研究表明,0.1和1.0 mmol/L茉莉酸在诱导棉花幼苗PAL活性方面等效(经方差分析差异不显著),诱导的滞后期可达1—2周,结果与邹志燕和王振中[21]对水稻的研究基本相同。此外,有研究表明0.1 mmol/L的茉莉酸甲酯能诱导石蒜 (Lycoris radiata)PAL基因的表达[36]。由于PAL是酚类物质合成的关键酶和限速酶[37],JA处理后棉花幼苗PAL活性上升,说明茉莉酸激活或直接参与了棉花幼苗的苯丙烷代谢途径,在提高棉花幼苗防御性次生代谢物含量方面起重要作用。
3.4 茉莉酸对棉叶抗氧化酶POD和CAT的诱导
POD参与酚的氧化,生成对病原菌毒性较高的醌类化合物,并参与木质素的合成,增厚细胞壁以抵御病菌的入侵和扩散。CAT能将逆境条件下(包括昆虫取食)植物叶绿体和线粒体产生的过量H2O2分解,减轻活性氧成分对植物细胞膜的伤害。前人研究表明,250 μmol/L茉莉酸甲酯可诱导水稻保护酶系POD和CAT活性升高[15]。25、100和250 μmol/L茉莉酸处理提高了7日龄花生幼苗 (Arachis hypogaea L.)根和叶片的POD和CAT活性[23]。茉莉酸处理枸杞幼苗后7d枸杞叶POD活性升高,但0.01 mmol/L茉莉酸的诱导效果最佳[6]。本研究JA对棉花POD和CAT的诱导效应表明,0.1 mmol/L莉酸处理明显提高了棉叶的 POD和CAT活性,诱导效应可持续1—14d,诱导的滞后期与宫玉艳对枸杞和Kumari等对花生的研究基本相同[6,23]。也有研究表明,感染晚疫病的马铃薯(Solanum tuberosum)幼苗经10-4mmol/L茉莉酸处理后,叶片POD活性升高而CAT活性下降[38]。Makissimov等认为:外源茉莉酸处理后,马铃薯叶片可溶性POD活性升高,与晚疫菌(Phytophthora infestans)菌丝体的亲和力增加,起抑制病原菌扩散的作用;CAT活性的下降则削弱JA诱导的马铃薯抗病性,因为CAT催化分解H2O2[38]。本研究中,棉花幼苗经外源JA处理后叶片CAT活性上升,与Makissimov等[38]的报道相反,产生差异的原因可能是二者研究的系统、采用的JA浓度和处理后采样时间不同。Makissimov等的研究对象是被晚疫菌感染的马铃薯植株,而本实验的对象是健康的棉花植株。另外,茉莉酸除可以诱导植株抗病、抗虫性外,还能诱导植株产生H2O2[35,38],而过氧化氧酶在清除多余H2O2、保持细胞的氧化还原稳态中起重要作用。据此推测,本研究中所观察到的CAT活性升高,可能是所使用的茉莉酸诱导了棉花叶片的氧猝发。处理后第14天时CAT活性与对照相比无明显差异,可能是JA诱导的氧猝发随处理时间延长逐渐减弱的缘故。
棉叶中丰富的单宁和棉酚能抑制或减轻绿盲蝽 (Apolygus lucorum)的危害[39]、抑制棉铃虫化蛹[40],甚至直接起毒杀作用[11]。PPO明显抑制棉铃虫的增重和取食[41]。PIs也在番茄和马铃薯的抗棉铃虫中起重要作用[34,42]。虽然本研究没有直接关注JA诱导棉花对棉铃虫等害虫的影响,但茉莉酸及其功能类似物的诱导抗虫性表明:2.0 mmol/L茉莉酸处理的 Bt棉叶大大降低了草地贪夜蛾 (Spodoptera frugiperda)的相对生长率[7]。4龄棉铃虫取食MeJA处理过的番茄 (Tainan ASVEG No.6)叶后,死亡率高达100%[34],外源茉莉酸处理的枸杞苗木和水稻幼苗使枸杞蚜和稻褐飞虱若虫的发育历期延长[5,43]。本研究发现,棉花幼苗经茉莉酸处理后,单宁和抗消化酶含量上升、抗营养酶和抗氧化酶活性升高。因此,根据前人和本实验的结果推测,茉莉酸处理能提高棉花幼苗的抗虫性。另外,由于植物对茉莉酸诱导存在浓度依赖性、发育阶段特异性和物种专一性[30,44-45],开展茉莉酸的诱导抗性实验时除应该多设浓度梯度外,还应关注研究对象的发育阶段。未来应进一步采用分析化学的方法对茉莉酸诱导产生的抗虫性次生代谢物进行定性和定量分析,从棉花诱导防御对棉铃虫等害虫的取食行为、产卵偏好、生态免疫和解毒功能、从可诱导挥发物对棉铃虫捕食性/寄生性天敌的影响等多个营养级层面进行综合研究,揭示茉莉酸诱导普通棉抗虫性的生理、生态和生化机制。
[1] Boughton A J,Hoover K,Felton G W.Impact of chemical elicitor applications on greenhouse tomato plants and population growth of the green peach aphid,Myzuc persicae.Entomologia Experimentalis et Applicata,2006,120(3):175-188.
[2] Bruinsma M,van Dam N M,van Loon J J A,Dicke M.Jasmonic acid-induced changes in Brassica oleracea affect oviposition preference of two specialist herbivores.Journal of Chemical Ecology,2007,33(4):655-668.
[3] Abe H,Shimoda T,Ohnishi J,Kugimiya S,Narusaka M,Seo S,Narusake Y,Tsuda S,Kobayashi M.Jasmonate-dependent plant defense restricts thrips performance and preference.BMC Plant Biology,2009,9:27,doi:10.1186/1471-2229-9-97.
[4] Guan X M,Liu X X,Lu Z Q,Zhao Z W,Zhang Q W,Xia J Y.Influence of tannic acid and Cry1Ac toxin of Bacillus thuringiensis on larval growth,growth and development of Helicoverpa armigera.Entomologia Experimentalis et Applicata,2009,132(1):50-58.
[5] Gong Y Y,Duan L Q,Wang A Q,Cui R J,Qiang Y S.Effects of exogenous jasmonic acid-induced resistance to wolfberry on the development and fecundity of the wolfberry aphid aphis sp.Acta Entomologia Sinica,2010,53(6):670-674.
[6] Gong Y Y,Duan L Q,Wang A Q.Induced effects of jasmonic acid on the contents of biochemical substances and enzyme activity in wolfberry leaves.Plant Protection,2010,36(2):61-65.
[7] Mészáros A,Beuzelin J M,Stout M J,Bommireddy P L,Riggio M R,Leonard B R.Jasmonic acid-induced resistance to the fall armyworm,Spodoptera frugiperda,in conventional and transgenic cottons expressing Bacillus thuringiensis insecticidal proteins.Entomologia Experimentalis et Applicata,2011,140(3):226-237.
[8] Stratmann J W.Long distance run in the wound response-jasmonic acid is pulling head.Trends in Plant Science,2003,8(6):247-250.
[9] Koo A J K,Gao X L,Jones A D,Howe G A.A rapid wound signal activates the systemic synthesis of bioactive jasmonates in Arabidopsis.The Plant Journal,2009,59(6):974-986.
[10] Bruinsma M,Posthumus M A,Mumm R,Mueller M J,van Loon J J,Dicke M.Jasmonic acid-induced volatiles of Brassica oleracea attract parasitoids:effects of time and dose,and comparison with induction by herbivores.Journal of Experimental Botany,2009,60(9):2575-2587.
[11] Koussevitzky S,Ne'eman E,Harel E.Import of polyphenol oxidase by chloroplasts is enhanced by methyl jasmonate.Planta,2004,219(3):412-419.
[12] Meng Z J,Zhou Y Q,Yang S C,Jin H,Hu X.Effects of exogenous jasmonates on tannin content in needles of two larch species.Scientia Silvae Sinicae,2010,46(3):96-104.
[13] Feng Y J,Wang J W,Luo S M.Timing and concentration effects on the defense response of Zea mays seedlings after application of jasmonic acid to leaves.Chinese Journal of Plant Ecology,2009,33(4):812-823.
[14] Feng Y J,Wang J W,Luo S M.Timing-and concentration effect of belowground treatment with jasmonic acid on maize seedlings chemical defense response.Chinese Journal of Applied Ecology,2009,20(8):1883-1890.
[15] Wu G Z,Zeng R S.The influence of protective enzymes Perpendicular Gaozhou wild rice(Oryza rufipogon)treated with exterior signal compounds salicylates and jasmonates.Acta Agricultural Boreali-Occidentalis Sinica,2007,16(3):82-84.
[16] War A R,Paulraj M G,War M Y,Ignacimuthu S.Jasmonic acid-mediated-induced resistance in groundnut(Arachis hypogaea L.)against Helicoverpa armigera(Hübner)(Lepidoptera:Noctuidae).Journal of Plant Growth Regulation,2011,30(4):512-523.
[17] Omer A D,Granett J,Karban R,Villa E M.Chemically induced resistance against multiple pests in cotton.International Journal of Pest Management,2001,47(1):49-54.
[18] Opitz S,Kunert G,Gershenzon J.Increased terpenoid accumulation in cotton(Gossypium hirsutum)foliage is a general wound response.Journal of Chemical Ecology,2008,34(4):508-522.
[19] Lin F M,W D,Lu Y H,Zhang Y J,Wang M,Wu K M.The relationship between the main secondary metabolites and the resistance of cotton to Apolygus lucroum.Acta Phytophylacica Sinica,2011,39(3):202-208.
[20] Stout M J,Workman K V,Bostock R M,Duffey S S.Stimulation and attenuation of induced resistance by elicitors and inhibitors of chemical induction in tomato(Lycopersicon esculentum)foliage.Entomologia Experimentalis et Applicata,1998,86(3):267-279.
[21] Zhou Z Y,Wang Z Z.Effects of jasmonic acid on induced resistance of rice seedlings to Magnaporthe Grisea.Acta Phytopathologica Sinica,2006,36(5):432-438.
[22] Tan C W,Lou J C,Yadav J,Ravuiwasa K T,Hwang S Y.Methyl jasmonate induced responses in four plant species and its effects on Spodoptera litura Fab.Performance.Journal of Asia-Pacific Entomology,2011,14(3):263-269.
[23] Kumari G J,Reddy A M,Naik S T,Kumar S G,Prasnathi J,Sriranganayakulu G,Reddy P C,Sudhakar C.Jasmonic acid induced changes in protein pattern,antioxidative enzyme activities and peroxidase isozymes in peanut seedlings.Biologia Plantarum,2004,50(2):219-226.
[24] Barbehenn R V,Jaros A,Lee G,Mozola C,Weir Q,Salminen J P.Hydrolyzable tannin as“quantitative defense”:limited impact against Lymantria dispar caterpillars on hybrid poplar.Journal of Insect Physiology,2009,55(4):297-304.
[25] Wang J W,Xu T,Zhang LW,Zhong Z M,Luo S M.Effects of methyl jasmonate on hydroxamic acid and phenolic acid content in maize and its allelopathic activity to Echinochloa crusgalli(L.).Allelopathy Journal,2007,19(1):161-17.
[26] Moreira X,Sampedro L,Zas R.Defensive responses of Pinus pinaster seedlings to exogenous application of methyl jasmonate:concentration effect and systemic response.Environmental and Experimental Botany,2009,67(1):94-100.
[27] Moreira X,Zas R,Sampedro L.Quantitative comparison of chemical,biological and mechanical induction of secondary compounds in Pinus pinaster seedlings.Trees,2012,26(2):677-683.
[28] Duffey S S,Stout M J.Antinutritive and toxic components of plant defense against insects.Archives of Insect Biochemistry and Physiology,1996,32(1):3-37.
[29] Gatehouse A M R,Norton E,Davison G M,Babbé S M,Newell C A,Gatehouse J A.Digestive proteolytic activity in larvae of tomato moth,Lacanobia oleraceae;effects of plant protease inhibitors in vitro and in vivo.Journal of Insect Physiology,1999,45(6):545-558.
[30] Li X G,Liu H X,Hou H B,Gao W H.Response of Chinese pine cones to induction of exogenous methyl jasmonate and Gravitarmata margarotna larvae.Scientia Silivae Sinicae,2007,43(3):66-72.
[31] Fujimoto T,Tomitaka Y,Abe H,Tsuda S,Futai K,Mizukubo T.Expression of profile of jasmonic acid-induced genes and the induced resistance against the root-know nematode(Meloidogyne incognita)in tomato plants(Solanum lycopersicum)after foliar treatment with methyl jasmonate.Journal of Plant Physiology,2011,168(10):1084-1097.
[32] Lomate P R,Hivrale V K.Wound and methyl jasmonate induced pigeon pea defensive proteinase inhibitor has potency to inhibit insect digestive proteinases.Plant Physiology and Biochemistry,2012,57(2):193-199.
[33] Gould N,Reglinski,Northcott G L,Spiers M,Taylor J T.Physiological and biochemical responses in Pinus radiata seedlings associated with methyl jasmonate-induced resistance to Diplodia pinea.Physiological and Molecular Plant Pathology,2009,74(2):121-128.
[34] Tan C W,Chiang S Y,Ravuiwas K T,Yadav J,Hwang S Y.Jasmonate-induced defenses in tomato against Helicoverpa armigera depend in part on nutrient availability,but artificial induction via methyl jasmonate does not.Arthrod-Plant Interactions,2012,doi:10.1007/s11829-012-9206-3.
[35] Liu Y,Pan Q H,Yang H R,Liu Y Y,Huang W D.Relationship between H2O2and jasmonic acid in pea leaf wounding response.Russian Journal of Plant Physiology,2008,55(6):765-775.
[36] Jiang Y M,Xia N,Li X D,Shen W B,Liang L J,Wang C Y,Wang R,Peng F,Xia B.Molecular cloning and characterization of a phenylalanine ammonia-lyase gene(LrPAL)from Lycoris radiata.Molecular Biology Reports,2011,38(3):1935-1940.
[37] Ritter H,Schulz G E.Structural basis for the entrance into the phenylpropanoid metabolism catalyzed by phenylalanine ammonia lyase.Plant Cell,2004,16(12):3426-3436.
[38] Maksimov I V,Sorokan A V,Chereoanova E A,Surina O B,Troshina N B,Yarullina L G.Effects of salicylic and jasmonic acids on the components of pro/antioxidant system in potato plants infected with late blight.Russian Journal of Plant Physiology,2011,58(2):299-306.
[39] Lin F M,Wu D,Lu Y H,Zhang Y J,Wang M,Wu K M.The relationship between the main secondary metabolites and the resistance of cotton to Apolygus lucroum.Acta Phytophylacica Sinica,2011,39(3):202-208.
[40] Guan X M,Liu X X,Lu Z Q,Zhao Z W,Zhang Q W,Xia J Y.Influence of tannic acid and Cry1Ac toxin of Bacillus thuringiensis on larval growth,growth and development of Helicoverpa armigera.Entomologia Experimentalis et Applicata,2009,132(1):50-58.
[41] Bhonwong A,Stout M J,Attajarusit J,Tantasawat P.Defensive role of tomato polyphenol oxidases against cotton bollworm(Helicoverpa armigera)and beet armyworm(Spodoptera exigua).Journal of Chemical Ecology,2009,35(1):28-38.
[42] Dunse K M,Stevens J A,Lay F T,Gaspar Y M,Health R L,Anderson M A.Coexpression of potato type I and II proteinase inhibitors gives cotton plants protection against insect damage in the field.Proceedings of the National Academy of Sciences of the United States of America,2010,107(34):15011-15015.
[43] Senthil-Nathan S,Kalaivani K,Choi M Y,Paik C H.Effects of jasmonic acid-induced resistance in rice on the plant brownhopper,Nilaparvata lugens Stål(Homoptera:Delphacidae).Pesticide Biochemistry and Physiology,2009,95(2):77-84.
[44] Matthes M C,Pickett J A,Napier J A.Natural variation in responsiveness of Arabidopsis thaliana to methyl jasmonate is developmentally regulated.Planta,2008,228(6):1021-1028.
[45] Cooper W R,Rieske L K.Differential responses in American(Castanea dentate Marshall)and Chinese(C.mollissima Blume)chestnut(Falalles:Fagceae)to foliar application of jasmonic acid.Chemoecology,2008,18(2):121-127.
参考文献:
[5] 宫玉艳,段立清,王爱清,崔瑞娟,钱远松.外源茉莉酸诱导枸杞对枸杞蚜生长发育和繁殖的影响.昆虫学报,2010,53(6):670-674.
[6] 宫玉艳,段立清,王爱清.茉莉酸诱导对枸杞叶生化物质及酶活性的影响.植物保护,2010,36(2):61-65.
[12] 孟昭军,周永泉,严善春,金虎,胡晓.外源茉莉酸类化合物对2种落叶松针叶内单宁含量的影响.林业科学,2010,46(3):96-104.
[13] 冯远娇,王建武,骆世明.叶片涂施茉莉酸对玉米幼苗防御反应的时间和浓度效应.植物生态学报,2009,33(4):812-823.
[14] 冯远娇,王建武,骆世明.外源茉莉酸处理地下部对玉米化学防御反应影响的时间和浓度效应.应用生态学报,2009,20(8):1883-1890.
[15] 吴国昭,曾任森.外源水杨酸甲酯和茉莉酸甲酯处理对挺立型普通野生水稻保护酶活性的影响.西北农业学报,2007,16(3):82-84.
[21] 邹志燕,王振中.茉莉酸诱导水稻幼苗对稻瘟病抗性作用研究.植物病理学报,2006,36(5):432-438.
[30] 李新岗,刘慧霞,候慧波,高文海.油松球果对外源茉莉酸甲酯和虫害诱导的生化反应.林业科学,2007,43(3):66-72.
[39] 林凤敏,吴敌,陆晏辉,张永军,王沫,吴孔明.棉花主要抗虫次生物质及其对绿盲蝽抗性的关系.植物保护学报,2011,39(3):202-208.
——“单宁”

