RNA干扰抑制HOXA7表达能逆转白血病U937细胞多药耐药
尹宝慧,贾秀红,李建厂
滨州医学院附属医院儿科,山东 滨州 256603
白血病的发病率在儿童恶性肿瘤中占首位,对其治疗主要是以化疗为主的综合治疗,但多药耐药(multidrug resistance,MDR)常导致化疗失败。MDR是肿瘤细胞对某一化疗药物产生耐药性后,对其他化学结构及作用机制不同的化疗药物也产生交叉耐药的现象。凋亡诱导的耐药是白血病复杂的耐药机制之一,某些基因过表达通过改变白血病细胞执行程序性死亡的能力或改变细胞凋亡通路而诱导耐药。研究表明,在白血病发生中,同源盒基因(homeobox gene,HOX)A7过表达能抑制白血病细胞凋亡,且HOXA7过表达与白血病患者对化疗的抵抗性有关[1,2]。因此预测,抑制HOXA7过表达有望提高白血病对化疗的敏感性,在一定程度上逆转白血病MDR。RNA干扰(RNA interference,RNAi)是近年来发展起来的能高效、特异性沉默靶基因的技术。本研究运用RNAi抑制白血病U937细胞中HOXA7表达后,检测U937细胞对化疗药物阿糖胞苷(cytarabine,Ara-C)和高三尖杉酯碱(homoharringtonine,HHT)敏感性的变化,为探讨RNAi逆转白血病MDR提供实验依据。
1 材料与方法
1.1 主要材料与试剂 人单核细胞白血病细胞株U937由滨州医学院肿瘤分子生物学重点实验室提供;RPMI 1640培养液和胎牛血清购自美国Hyclone公司;X-tremeGENE HP DNA转染试剂购自德国Roche公司;反转录试剂盒购自加拿大Fermentas公司;RNAiso Plus总RNA提取试剂和PCR检测试剂盒购自日本TaKaRa公司;MTT细胞增殖及细胞毒性检测试剂盒、RIPA裂解液和BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;兔抗人β-actin多克隆抗体购自南京巴傲得生物科技有限公司;辣根过氧化物酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司;兔抗人HOXA7多克隆抗体购自武汉博士德生物工程有限公司;HOXA7和内参β-actin引物由上海赛百盛基因技术有限公司合成;靶向HOXA7基因的特异性小发夹RNA(small hair RNA,shRNA)及阴性对照RNA和空载体质粒pGPU6/GFP/Neo均由上海吉玛制药技术有限公司设计合成或提供;注射用Ara-C购自哈尔滨博莱制药有限公司;注射用HHT购自北京协和药厂;其余试剂均为国产分析纯。
1.2 U937细胞培养 人白血病细胞株U937在含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素双抗的完全培养液中,置于37 ℃、CO2体积分数为5%的培养箱中培养。根据细胞生长状况,2~3 d传代一次,取对数生长期细胞进行后续实验。
1.3 U937细胞转染及分组 本课题前期实验中根据HOXA7基因序列,设计并合成3对靶向HOXA7基因的特异性shRNA,并筛选出对HOXA7表达抑制效率最佳的1对shRNA(引物序列:正义链5’-CCTCCTACGACCAAAACAT-3’,反义链5’-ATGTTTTGGTCGTAGGAGG-3’),由此shRNA序列设计并合成靶向HOXA7基因的特异性真核表达载体pGPU6/GFP/Neo-shHOXA7;同时设计并合成阴性对照载体pGPU6/GFP/Neo-shNC,作为阴性对照。转染前取对数生长期U937细胞,用含10%胎牛血清的RPMI 1640培养液悬浮后,以6×105个/孔的细胞密度接种于6孔板。根据X-tremeGENE HP DNA转染试剂说明书,优化转染条件。pGPU6/GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC分别用不含抗生素和血清的RPMI 1640培养液稀释,混匀后取X-tremeGENE HP DNA转染试剂加入到稀释好的重组载体中,混匀后室温孵育30 min,小心将混合物加到U937细胞中,置于37 ℃、CO2体积分数为5%的培养箱中继续培养。转染24 h后加G418(800 μg/mL)进行阳性细胞筛选,4周后用G418(400 μg/mL)维持培养,得到稳定表达pGPU6/GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC的U937细胞。实验重复3次。后续实验分3组:实验组(稳定表达pGPU6/GFP/Neo-shHOXA7的U937细胞)、阴性对照组(稳定表达pGPU6/GFP/Neo-shNC的U937细胞)和空白对照组(未转染的U937细胞),即收集以上3组细胞进行后续实验。
1.4 RT-PCR检测各组细胞中HOXA7 mRNA表达情况 分别收集各组细胞,运用RNAiso Plus提取细胞总RNA,测定RNA纯度及浓度。两步法进行RT-PCR检测HOXA7 mRNA的表达情况。所用引物序列如下:HOXA7正义链为5’-ACCGACACTGAAAGCTGCCG-3’,反义链为 5’-AGGTCCTGAAGACCGCATCC-3’,扩增产物长度为410 bp;β-actin正义链为5’-CTCCATCCTGGCCTCGCTGT-3’,反义链为 5’-GCTGTCACCTTCACCGTTCC-3’,扩增产物长度为268 bp。按下列条件进行RTPCR扩增:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸30 s,共进行35个循环;最后72 ℃延伸10 min。实验独立重复3次。PCR产物经1%琼脂糖凝胶电泳鉴定,采用Tanon Gel凝胶图像分析软件,在mRNA水平计算各组细胞中HOXA7的相对表达量。HOXA7 mRNA相对水平=HOXA7灰度值/β-actin灰度值×100%。
1.5 蛋白质印迹法检测各组细胞中HOXA7蛋白表达情况 分别收集各组细胞,应用RIPA+PMSF裂解液抽提细胞总蛋白,BCA法检测蛋白质浓度。蛋白与5×SDS-PAGE上样缓冲液混合(体积比为5:1)后,95 ℃煮样10 min,取40 μg蛋白进行10%SDS-PAGE分离,然后将蛋白电转移至硝酸纤维素膜上,加入含7%脱脂奶粉的TBST封闭液并置于摇床上封闭2.5 h。加入兔抗人HOXA7多克隆抗体(稀释比例为1:100),4 ℃摇床过夜,经TBST充分漂洗(10 min/次,共洗3次),再加辣根过氧化酶标记的山羊抗兔二抗(稀释比例为1:5000),室温摇床上放置2 h后洗膜,化学发光法显色。用兔抗人β-actin多克隆抗体(稀释比例为1:3000)作为内参。实验独立重复3次。采用Chemiscope软件分析图像,在蛋白质水平计算各组细胞中HOXA7的相对表达量。HOXA7蛋白相对表达量=HOXA7灰度值/β-actin灰度值×100%。
1.6 MTT法检测各组细胞对Ara-C和HHT的敏感性 取对数生长期的各组细胞,以3×104个/孔的细胞密度接种于96孔板上,调整培养液终体积为200μL。分别将不同浓度的Ara-C(终质量浓度分别为 0、0.1、1、10、100和 1000 μg/mL)和HHT(终质量浓度分别为0、0.05、0.5、5、50和500 μg/mL)加入各组细胞培养液中,每组设3个平行孔。加药48 h后,每孔加入MTT 20μL(5 mg/mL),继续置于 37 ℃、CO2体积分数为5%的培养箱中培养4 h,离心并小心吸出孔中培养液,加入DMSO 150μL/孔,摇床上避光振荡15~20 min。酶标仪检测各孔在560 nm处的吸光度(D560)值,分别计算Ara-C和HHT对各组细胞的半数抑制浓度(half-inhibitory concentration,IC50)。实验独立重复3次。
1.7 FITC-PI标记的FCM法检测各组细胞的凋亡情况 取对数生长期的各组细胞,以6×105个/孔的细胞密度接种于6孔板,调整培养液终体积为1.5 mL。每组中再设未加药组(加等量完全培养液)、Ara-C组(终质量浓度为10 μg/mL)和HHT组(终质量浓度为0.5 μg/mL),加药48 h后离心收集细胞(2000 r/min离心5 min),PBS洗涤细胞 2次(2000 r/min离心5 min),再加入500μL Binding Buffer悬浮细胞,然后加AnnexinⅤ-FITC和碘化丙啶(propidium iodide,PI)各5μL,室温避光反应15 min后,上流式细胞仪检测各组细胞的凋亡率。实验独立重复3次。
1.8 统计学方法 采用SPSS 13.0统计学软件进行数据处理。结果数据以表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结 果
2.1 荧光显微镜下观察各组细胞的转染效率 经G418稳定筛选后,荧光显微镜下观察各组细胞。因重组质粒载体pGPU6/GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC均带有绿色荧光蛋白(green fluorescent protein,GFP)基因,因此如预期,观察发现实验组和阴性对照组细胞均有绿色荧光,转染效率在70%以上,而空白对照组细胞未见绿色荧光(图1)。
2.2 pGPU6/GFP/Neo-shHOXA7转 染 能 有 效抑制HOXA7 mRNA和蛋白的表达 RT-PCR检测各组细胞中HOXA7 mRNA的相对水平分别如下:实验组(23.910±1.662)%,阴性对照组(81.579±0.310)%,空白对照组(82.232±0.511)%。实验组明显低于阴性对照组和空白对照组(P<0.05),而阴性对照组和空白对照组细胞中HOXA7 mRNA相对水平无明显差异(P>0.05,图 2A)。
蛋白质印迹法检测各组细胞中HOXA7蛋白的相对表达量,结果显示:实验组HOXA7蛋白相对表达量为(25.980±1.651)%,明显低于阴性对照组的(72.885±0.762)%和空白对照组的(73.669±1.066)%,差异均有统计学意义(P<0.01);而阴性对照组和空白对照组细胞中HOXA7蛋白相对表达量比较的差异无统计学意义(P>0.05,图2B)。

Fig.1 The leukemia U937 cells after different transfections were selected by G418 and observed under a light microscope(A-C) and a fluorescence microscope (D-F) (×200).A and D: U937 cells without transfection as a blank control group;B and E: U937 cells transfected with pGPU6/GFP/Neo-shNC (a negative control small-hair RNA) vector as a negative control group; C and F: U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 (a small-hair RNA targeting HOXA7 gene) vector as a experimental group.The results showed that GFP (green fluorescent protein) displaying green fuorescence in U937 cells after transfection with pGPU6/GFP/Neo-shNC and pGPU6/GFP/Neo-shHOXA7, and the transfection efficiencies of the two groups were more than 70%.图1 显微镜下观察经G418稳定筛选后各组白血病U937细胞的转染效率

Fig.2 The expressions of HOXA7 mRNA and protein in U937 cells transfected with shHOXA7 (small-hair-RNA targeting HOXA7 gene) were detected by RT-PCR (A)and Western blotting (B), respectively.1: Blank control group (U937 cells without transfection); 2: Negative control group (U937 cells transfected with pGPU6/GFP/Neo-shNC vector); 3: Experimental group (U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 vector).The results showed that both HOXA7 mRNA and protein expressions were significantly decreased in the U937 cells transfected with shHOXA7 (P<0.05, P<0.01, n=3).图2 RT-PCR和蛋白质印迹法检测稳定转染HOXA7基因特异性shRNA的U937细胞中HOXA7 mRNA和蛋
以上结果提示,稳定转染含有HOXA7基因特异性shRNA的重组表达质粒pGPU6/GFP/Neo-shHOXA7的U937细胞系构建成功,该载体能在mRNA和蛋白水平有效抑制HOXA7基因的表达,而阴性对照质粒pGPU6/GFP/NeoshNC不能抑制HOXA7表达。因此,选取实验组细胞进行后续实验。
2.3 MTT法检测RNAi抑制HOXA7表达后细胞对Ara-C和HHT的敏感性变化 MTT结果(图3)显示:在不同浓度的Ara-C和HHT作用下,实验组、阴性对照组和空白对照组的细胞增殖均受到抑制,且随着药物浓度增加,细胞增殖抑制率增加;相同药物浓度下,实验组细胞增殖抑制率高于2个对照组;实验组中Ara-C的IC50为(3.063±0.570)μg/mL,明显低于阴性对照组的(10.863±0.740)μg/mL和空白对照组的(11.282±1.733)μg/mL(P< 0.05),而后两组比较的差异无统计学意义(P>0.05);实验组中HHT的IC50为(0.059±0.031)μg/mL,明显低于阴性对照组的(0.514±0.035)μg/mL和空白对照组的(0.564±0.098)μg/mL(P<0.05),而后两组比较的差异无统计学意义(P>0.05);实验组Ara-C和HHT的IC50与对照组相比,分别降低了3.5倍和8.5倍。以上结果表明,RNAi抑制HOXA7表达后,实验组细胞对Ara-C和HHT的敏感性明显增加。
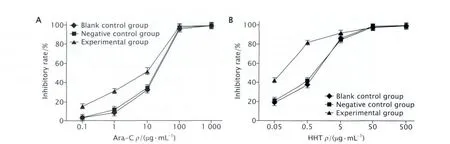
Fig.3 The inhibitory effects of Ara-C (cytarabine, in Fig.3A) and HHT (homoharringtonine, in Fig.3B) on the proliferation of U937 cells transfected with shHOXA7 (small-hair RNA targeting HOXA7 gene) were detected by MTT method.Blank control group: U937 cells without transfection; Negative control group: U937 cells transfected with pGPU6/GFP/Neo-shNC vector; Experimental group: U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 vector.The results showed that the inhibition effect of cellular proliferation in each group after treatment with Ara-C or HHT was gradually enhanced in a dose-dependent manner.The inhibition rate of the U937 cells transfected with shHOXA7 was significantly higher than that of the control cells exposed to the same concentration of Ara-C or HHT (P<0.05, n=3).图3 MTT法检测HOXA7基因特异性shRNA转染后U937细胞对Ara-C和HHT的敏感性变化

Fig.4 The apoptosis of U937 cells transfected with shHOXA7 (small-hair RNA targeting HOXA7 gene) after treatment with Ara-C (cytarabine) or HHT (homoharringtonine) was detected by FCM (flow cytometry).Blank control group:U937 cells without transfection; Negative control group: U937 cells transfected with pGPU6/GFP/Neo-shNC vector;Experimental group: U937 cells transfected with pGPU6/GFP/Neo-shHOXA7 vector.The results showed that Ara-C or HHT could induce the apoptosis of U937 cells transfected with shHOXA7, as compared with those in the blank control and the negative control groups (P<0.05,n =3).图4 FCM法检测HOXA7基因特异性shRNA转染后U937细胞在Ara-C或HHT作用下的凋亡情况
2.4 FCM法检测RNAi抑制HOXA7表达后细胞的凋亡情况 FCM法检测结果(图4)显示:未加化疗药物时,实验组细胞凋亡率与阴性对照组和空白对照组相比,差异均有统计学意义(P<0.05),而后两组比较无明显差异(P>0.05),表明RNAi抑制HOXA7表达能在一定程度上促进U937细胞凋亡;加化疗药物Ara-C和HHT作用后,实验组细胞凋亡率明显高于阴性对照组和空白对照组(P<0.05),后两组比较差异无统计学意义(P>0.05)。以上结果说明,RNAi抑制HOXA7表达后,能在一定程度上促进U937细胞凋亡,且能增强Ara-C和HHT对U937细胞的凋亡诱导作用。
3 讨 论
HOX基因在控制胚胎发育和造血细胞增殖、分化过程中发挥了重要的调控作用,其异常表达与肿瘤发生、发展及预后密切相关。Gaspar等[3]在儿童高分化神经胶质瘤研究中发现,HOX基因高表达与患者预后差有关,且其高表达可作为患者对替莫唑胺耐药的有效预测指标。HOXA7是HOX基因家族中的重要一员,其异常表达与白血病的关系近年来受到广泛关注。白血病致病相关基因MLL和NUP98等可与多种易位基因形成融合蛋白,通过上调HOXA7基因表达,从而导致白血病的发生。在慢性粒细胞白血病急淋变过程中,白血病细胞恶性克隆常伴有HOXA7基因的异常高表达,说明其作为原癌基因在白血病发生和发展过程中发挥了重要作用。另外,HOXA7异常表达与白血病的治疗和预后也密切相关。Drabkin等[1]研究证明,HOXA7过表达与急性骨髓性白血病患者对化疗的反应差及预后不佳有关。Afonja等[4]研究发现,HOXA7高表达的白血病患者表现为对化疗药物诱导凋亡的抵抗增强,而HOXA7低表达或无表达的患者对化疗药物反应好,提示HOXA7高表达在白血病MDR中发挥了重要作用。
有关HOXA7高表达导致白血病MDR的机制,目前国内外研究较少。许多化疗药物通过诱导白血病细胞凋亡达到治疗目的,而细胞周期相关基因p53等异常表达能通过改变细胞凋亡通路,拮抗外来信号诱导细胞凋亡作用,从而诱导耐药,这种凋亡诱导的耐药是白血病MDR的重要机制之一[5]。有研究表明,HOXA7能调控细胞周期相关基因p53的表达,提示HOXA7高表达可能通过抑制白血病细胞凋亡,从而诱导耐药[6]。因此,抑制HOXA7高表达有望通过促进白血病细胞凋亡,提高白血病对化疗药物的敏感性,最终逆转MDR。但有关该方面的研究,目前国内外尚无相关报道。
目前,逆转白血病MDR的方法主要有以下2类:(1)经典的MDR逆转剂,即针对MDR发生环节的特异性逆转药物,如钙离子通道阻滞剂、钙调蛋白抑制剂、免疫调节剂、激素类化合物、谷胱甘肽转移酶和拓扑异构酶Ⅱ抑制剂等;(2)以生物治疗剂作为逆转剂,如某些细胞因子、单克隆抗体、核酶、中药制剂、反义寡核苷酸和小干扰RNA为基础的RNAi,其中RNAi沉默靶基因具有特异性高、操作简单、快速和无毒等优点[7],是目前国内外最先进的抑制靶基因表达的方法。因此,基于RNAi的新型逆转白血病MDR的治疗手段是目前白血病治疗的热点。Rumpold等[8]运用RNAi技术抑制白血病MDR相关基因P-gp表达后,发现慢性粒细胞白血病细胞株恢复了对化疗药物甲磺酸伊马替尼和多柔比星的敏感性。Zhou等[9]研究发现,在多柔比星诱导的白血病MDR细胞株K562/A02和白血病患者中均存在sorcin高表达,靶向sorcin的小干扰RNA通过抑制sorcin表达,逆转白血病MDR。本课题组前期实验证明,RNAi抑制HOXA9表达后能增强U937细胞对长春新碱和柔红霉素的敏感性[10],逆转白血病MDR。以上研究结果表明,RNAi可通过抑制白血病MDR相关基因表达来逆转白血病MDR。
本研究将前期构建的靶向HOXA7基因的特异性真核表达载体pGPU6/GFP/Neo-shHOXA7稳定转染至U937细胞,RT-PCR和蛋白质印迹法分别鉴定该载体对HOXA7表达的抑制作用,结果显示:实验组细胞中HOXA7在mRNA和蛋白水平的相对表达量均明显低于阴性对照组和空白对照组,表明稳定表达pGPU6/GFP/NeoshHOXA7的U937细胞系构建成功,该载体在mRNA和蛋白水平均能有效抑制HOXA7表达。在此基础上,本研究运用MTT法检测各组细胞对Ara-C和HHT的敏感性变化,结果显示:实验组RNAi抑制HOXA7表达后,细胞对化疗药物的敏感性明显提高,实验组Ara-C和HHT的IC50与对照组相比,分别降低了3.5倍和8.5倍,这说明RNAi抑制HOXA7表达后能增强U937细胞对化疗药物的敏感性。Orlovsky等[11]在NOD/SCID小鼠中研究发现,抑制HOXA7表达能阻碍白血病细胞在骨髓中的植入,并抑制白血病细胞在小鼠体内的增殖。本研究也发现,相同浓度的Ara-C和HHT作用时,实验组细胞增殖抑制率高于对照组,说明RNAi抑制HOXA7表达能抑制白血病细胞增殖,这与Orlovsky等[11]的研究结论相同。本研究还运用FCM法检测各组细胞凋亡情况,结果显示:未加化疗药物时,实验组细胞出现一定程度的凋亡,加入化疗药物Ara-C或HHT后,实验组细胞因RNAi抑制了HOXA7的表达,其凋亡率明显高于阴性对照组和空白对照组,该结果说明RNAi抑制HOXA7表达后能通过促进U937凋亡或增强化疗药物对U937细胞的诱导凋亡作用,逆转U937细胞MDR。
综上所述,HOXA7高表达与白血病MDR密切相关,本研究构建的稳定表达pGPU6/GFP/Neo-shHOXA7的U937细胞能有效抑制HOXA7表达;在此基础上,RNAi抑制HOXA7表达后能通过增强化疗药物Ara-C和HHT对U937细胞的增殖抑制及凋亡诱导作用,在一定程度上逆转白血病MDR。因此,提示RNAi抑制HOXA7表达有望成为逆转白血病MDR的新方法。
[1]DRABKIN H A, PARSY C, FERGUSON K, et al.Quantitative HOX expression in chromosomally defined subsets of acute myelogenous leukemia[J].Leukemia, 2002, 16(2):186-195.
[2]WANG G G, CAI L, PASILLAS M P, et al.NUP98-NSD1 links H3K36 methylation to Hox-A gene activation and leukaemogenesis[J].Nat Cell Biol,2007, 9(7):804-812.
[3]GASPAR N, MARSHALL L, PERRYMAN L, et al.MGMT-independent temozolomide resistance in pediatric glioblastoma cells associated with a PI3-kinase-mediated HOX/stem cell gene signature[J].Cancer Res, 2010, 70(22):9243-9252.
[4]AFONJA O, SMITH JE J R, CHENG D M, et al.MEIS1 and HOXA7 genes in human acute myeloid leukemia[J].Leuk Res, 2000, 24(10):849-855.
[5]CAVALCANTI G B Jr, VASCONCELOS F C, PINTO de FARIA G,et al.Coexpression of p53 protein and MDR functional phenotype in leukemias : the predominant association in chronic myeloid leukemia[J].Cytometry B Clin Cytom, 2004, 61(1):1-8.
[6]MISHRA B P, ANSARI K I, MANDAL S S.Dynamic association of MLL1, H3K4 trimethylation with chromatin and Hox gene expression during the cell cycle[J].FEBS J, 2009, 276(6):1629-1640.
[7]OLIVIERI D, SYKORA M M, SACHIDANANDAM R,et al.An in vivo RNAi assay identifies major genetic and cellular requirements for primary piRNA biogenesis in Drosophila[J].EMBO J, 2010,29(19):3301-3317.
[8]RUMPOLD H, WOLF A M, GRUENEWALD K, et al.RNAi-mediated knockdown of P-glycoprotein using a transposon-based vector system durably restores imatinib sensitivity in imatinibresistant CML cell lines[J].Exp Hematol, 2005,33(7):767-775.
[9]ZHOU Y, XU Y, TAN Y, et al.Sorcin, an important gene associated with multidrug-resistance in human leukemia cells[J].Leuk Res, 2006,30(4):469-476.
[10]朱立平, 贾秀红, 李建厂.靶向HOXA9基因RNAi慢病毒载体增加人急性单核细胞白血病U937细胞的药物敏感性[J].肿瘤, 2013, 33(1):21-27.
[11]ORLOVSKY K, KALINKOVICH A, ROZOVSKAIA T,et al.Down-regulation of homeobox genes MEIS1 and HOXA in MLL-rearranged acute leukemia impairs engraftment and reduces proliferation[J].Proc Natl Acad Sci U S A, 2011,108(19):7956-7961.