风速和持续时间对树麻雀能量收支的影响
杨志宏,吴庆明, 董海燕, 邹红菲
(东北林业大学野生动物资源学院, 哈尔滨 150040)
风速和持续时间对树麻雀能量收支的影响
杨志宏,吴庆明, 董海燕, 邹红菲*
(东北林业大学野生动物资源学院, 哈尔滨 150040)
风是自然环境中常见的因子之一,会对动物的行为以及能量收支产生不同程度的影响。为探讨不同风速和持续时间对树麻雀能量收支的影响,以3种风速(0.2—0.4、1.2—1.4、3.2—3.6 m/s)和3种持续时间(1、2、4 h)的9组树麻雀进行为期1周的不同风环境驯化,测定其体重、体温和摄食量、摄水量、排泄粪量、排泄次数、摄入能、排泄粪能、排出水热能散失、消化能、同化能并计算消化率和同化率。去除初体重影响和双因素分析的结果发现,摄水量(排出水量)和排出水热能散失随着风速增大而显著减少(P﹤0.001);持续时间与树麻雀的摄入能、粪能和散热调节的次数显著相关(P﹤0.01),其能量收支最高和散热调节次数最多为2 h,最低(少)为4 h;双因素交互作用对树麻雀能量收支的影响不显著。3级风速(4 m/s)和持续时间4 h以内的风环境不会对树麻雀的能量收支产生显著影响。
能量收支;树麻雀;风
地球的转动和地球表面受太阳加热程度的差异形成风。风是重要的生态因子之一,会对动物的生存、繁殖、分布和种群数量变动产生直接或间接的影响。风与鸟类密切相关[1- 3],如迁徙鸟类会对不同风速及风向选择不同的迁徙对策[4- 5]、冬季寒冷季节中的鸟多选择迎风觅食和大风可造成鸟的“迷飞”等。风速大小会对鸟的飞行产生影响[6- 7],善飞鸟类如军舰鸟、信天翁和风雨鸟等通常会借助风力来减少飞行能耗。不同种类的鸟对风速大小的适应能力和适应对策也不同,并直接影响其能量收支。鸟类行为谱及其时间分配会因风持续时间不同而发生改变或调整[8],其不同的能量预算对策也会产生不同的收益。物种的分布、丰富度和适合度往往取决于该物种的能量代谢水平[9]。保持最适的能量收支平衡是鸟类重要的生存对策,其生理和行为的适应性调节变化与其能量收支、分配和利用以及个体的能量预算对策密切相关[10- 12]。鸟类能量生态学研究有助于揭示其生物学特征和探索它们应对不同环境的适应策略。许多研究表明环境因子与鸟类的能量收支密切相关,如温度[13- 14]、光周期[15- 16]和食物质量差异[17- 18]等。其中,有关风环境与鸟类能量收支的研究相对较少,而报道又多是针对鸟类体内能量储备和器官可塑性变化[6,8],所以这方面的研究对进一步了解鸟类的环境适应及能量预算对策有着重要的意义。
树麻雀(Passermontanus)为古北型留鸟,属雀形目(Passeriformes)雀科(Fringillidae)。世界分布从澳大利亚向北沿海至欧洲东部鄂霍次克海地区,向西遍及整个欧洲,在亚洲北起俄罗斯,南到马来西亚半岛和印度尼西亚,东自日本,经朝鲜、中国向西,通过南亚、西南亚,一直到大西洋沿海岸诸国及其附近岛屿。在我国,遍布全国各地包括海南岛及台湾,高可至中等海拔区[19]。树麻雀食性很杂,随着季节的变化而不同,春夏季多食昆虫,秋冬两季则以植物性食物为主。树麻雀分布范围广,数量大,是具有代表性和容易获得的研究材料。已发现树麻雀具有较高的基础代谢率(BMR)和热传导,相对较宽的热中性区(TNZ)和较低的下临界温度[20]。相对于善飞鸟类,树麻雀的两翅与其身体的比例相对较小,故不能远飞。飞行高度一般在10—20 m,飞行时间通常不会超过4min和时速不会超过8—10 m/s,但其高超的飞行技巧可使其能在短程和有障碍的空间穿梭自如。通常树麻雀会选择适应或躲避的对策来应对不同风速,即风速较小时适应和风速增大至一定限度时会选择躲避。风的大小与多数哺乳动物的汗液蒸发速度密切相关,从而会对其热调节产生影响。鸟类体表无汗腺,因此无法通过汗液蒸发的方式进行散热调节。
中国东北地区46年的平均风速为3.0 m/s,平均风速明显的年特征变化为3—5月、10—11月风速最大,7—9月风速较小处于波谷,其中平均风速4月最大达4.1 m/s,8月最小仅为2.4 m/s,比4月份低41%。东北地区春夏秋冬四季季节平均风速分别为:3.8、2.7、2.9和2.9 m/s[21]。鸟类的任何行为都会有能耗发生。相对无风天气,不同风速和持续时间必然会引起树麻雀行为谱和时间分配发生变化。不同风速和持续时间是否会对树麻雀的能量收支产生影响?尚未见报道。所以,本文通过对9组(选择鸟类能够适应的3种风速和设定3种持续时间)树麻雀(当地留鸟)7 d的驯养、比较和分析,探讨风速和持续时间对小型鸟类能量收支的影响。
1 材料与方法
1.1 实验动物
90只树麻雀于2012年12月捕自黑龙江省齐齐哈尔地区(47°29′N, 124°02′E)。该地区年平均气温为3.4 ℃,变化范围从-32.2到35.7 ℃,其中最冷月(1月)和最热月(7月)的平均气温分别为-20.6 ℃和22.9 ℃。冬季自然生境中树麻雀主要摄食带壳的草籽种子。东北林业大学野生动物保护医学与生态安全研究中心饲养和适应7 d后,逐一称重、标记和分组。不同风速和持续时间分别为:0.2—0.4、1.2—1.4、3.2—3.6 m/s和1、2、4 h,共设9个实验组和10只/组。分组方法,A代表风速和由小到大分别记为A1、A2、A3,B代表持续时间和由短到长分别记为B1、B2和B4,Ⅰ、Ⅱ至Ⅸ(9)组依次为A1B1、A1B2、A1B4、A2B1、A2B2、A2B4、A3B1、A3B2和A3B4。实验环境相同(长90 cm×宽50 cm×高60 cm的内置栖架、食盒(每组或笼×2)和饮水器的铁丝笼;环境温度为(21.0±1.0) ℃)。适应和实验期间,食物相同(带壳谷子)和保证每日各食盒于光照时段内始终存有食物(少量和多次添加);饮水器内的水每日定时更换1次。
通过相同的风扇获取风源,风由鸟笼食盒端定向吹入。通过手持式风速仪测定风速,风扇与鸟笼同高,以风扇不同档位和风扇与鸟笼重心的直线距离差异获得各组目标风速,并将风扇与鸟笼的位置固定。同时,保证各组鸟笼的组间距离和风速仪检测无相互的风影响,实验开始。每日风实验时间段为10: 00至14: 00。实验于2011年12月13日开始至20日结束。
1.2 体重和体温的测定
体重用电子天平(BS210型,深圳)测量(测量时软网束缚和读数精确到0.01 g)。用电子体温计(北京师范大学,司南仪器厂)插入泄殖腔约1 cm测量体核温度,每次测温探头在泄殖腔内静置约20 s和数值稳定时读数并记录(精确到0.10 ℃),体温测定各组均在无风时段进行。
1.3 能量收支的测定
每日分别于9: 00—10: 00和15: 00—16: 00两次投喂食物(带壳谷子),饮水器换水和称重于9: 00—10: 00(次/日)。计数粪便混合物痕迹并记为排泄次数。为计数准确,每日换取粪盒和垫纸3次,时间间隔设定分别为:10:00、13:00和16:00。手工分离剩余谷子、谷壳和粪便。累计计数结束,将粪便连同垫纸一同置于60 ℃干燥箱干燥至恒重,以其干重减去垫纸初重值记为粪便干重(精确到0.01 g)。测定和记录上述数据24 h/次,共计7次。用氧弾热量计(GR- 3500型,广东)测定热值。能量收支[16,17, 22- 24]和排出水热能散失计算公式调整如下:
干物质(g)=物质质量(g)-物质中水质量(g)
摄食量(g/d)=投食量(g/d)-剩余食物量(g/d)
摄入能(kJ/d)=摄入干谷子质量(g/d)×谷子热值(kJ/g)-谷壳(干)质量(g/d) ×谷壳热值(kJ/g)
粪能(kJ/d) =粪便干质量(g/d) ×粪便热值(kJ/g)
摄水量(g/d)≈排出水量(g/d)=饮水器和水(初重-末重)(g/d)+摄入食物中的水(g/d)
排出水散失热能(J/d)=水的比热值(J/g℃) ×摄水量(g/d)×(鸟的体温-环境水温)(℃)
消化能(kJ/d)=摄入能(kJ/d)-粪能(kJ/d)
同化能(kJ/d)=消化能(kJ/d)-排出水热能散失(kJ/d)
消化率(%)=消化能(kJ/d) /摄入能(kJ/d) ×100%
同化率(%)=同化能(kJ/d) /摄入能(kJ/d) ×100%
1.4 统计分析
利用SPSS软件包进行相关统计分析。组内实验前后体重和体温的比较采用双尾t检验分析。组间能量收支各参数实测值的比较采用方差分析(One-Way ANOVA);为消除初体重组间差异对能量收支各参数的影响,并以初体重为协变量进行双因素协方差分析(Univariate ANOVA)。文中数据均以平均值±标准误(Mean ±SE)表示,P﹤0.05即认为差异显著。
2 结果
2.1 树麻雀的体重变化
7 d实验结束,树麻雀Ⅰ至Ⅸ各组组内初终体重变化均不显著(t=0.403, df=18,P=0.694;t=-0.209, df=18,P=0.841;t=-0.184, df=18,P=0.857;t=0.900, df=18,P=0.389;t=-0.684, df=18,P=0.506;t= 0.806, df=18,P=0.436;t=0.394, df=18,P=0.417;t=0.461, df=18,P=0.765和t=0.742, df=18,P=0.470)(图1)。
2.2 风速和持续时间对树麻雀体温的影响
结果表明,风速和持续时间及风速-持续时间的交互作用对树麻雀体温影响均不显著(F(2, 89)=0.043,P=0.837;F(2, 89)=0.070,P=0.932;F(4, 89)=0.360,P=0.700)。终体温组间比较差异不显著(F(8, 89)=0.043,P=0.837)。各组(同上)组内初终体温变化均不显著(t=-0.438, df=18,P=0.670;t=-1.019, df=18,P=0.342;t=-0.395, df=18,P=0.701;t=0.151, df=18,P=0.883;t=1.697, df=18,P=0.073;t=-2.137, df=18,P=0.066;t=0.127, df=18,P=0.901;t=-0.174, df=18,P=0.864和t=0.718, df=18,P=0.484)(图2)。
2.3 风速和持续时间对树麻雀能量收支的影响
2.3.1 组间能量收支各参数实测值比较
摄食量、摄入(排出)水量、摄入能、排出水热能散失、消化能和同化能组间差异极显著(F(8, 62)=5.149,P=0.002;F(8, 62)=7.995,P=0.000;F(8, 62)=4.904,P=0.002;F(8, 62)=9.270,P=0.000;F(8, 62)=5.469,P=0.001和F(8, 62)=5.483,P=0.001),排泄的次数、粪量和粪能组间差异显著(F(8, 62)=2.613,P=0.046;F(8, 62)=3.318,P=0.018和F(8, 62)=3.315,P=0.019),排泄单位水热能量散失、消化率和同化率组间差异不显著(F(8, 62)=1.495,P=0.223;F(8, 62)=1.196,P=0.337和F(8, 62)=1.328,P=0.281)(图3和图4)。
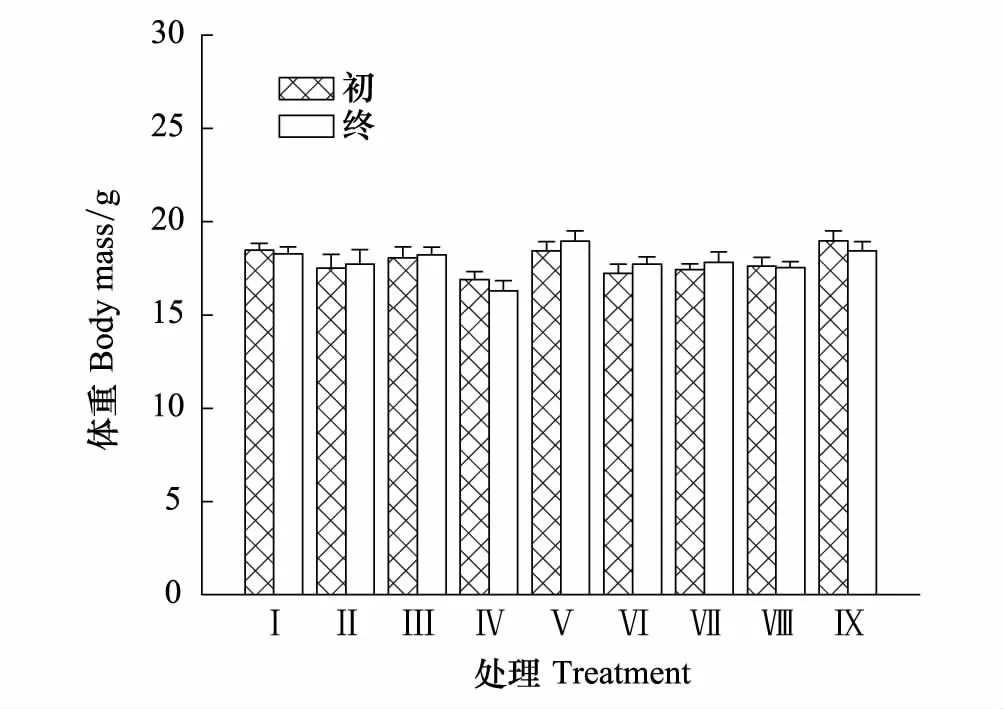
图1 风速和持续时间对树麻雀体重的影响 Fig.1 Effects of wind different speed and duration on body mass in Tree sparrow数据为平均值±标准误
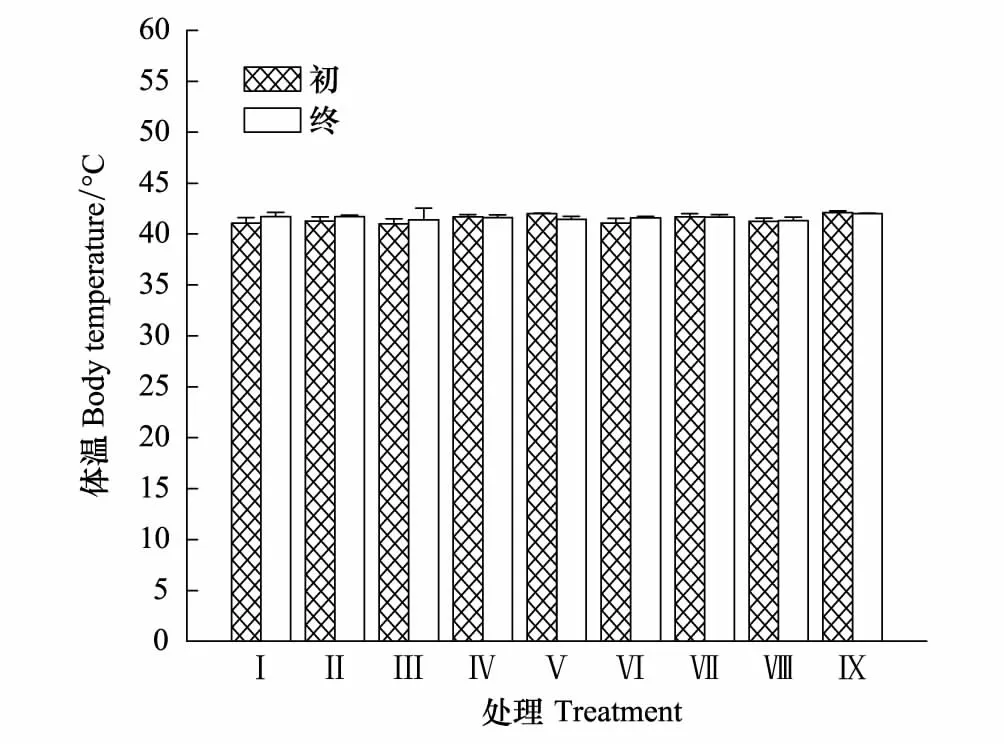
图2 风速和持续时间对树麻雀体温的影响 Fig. 2 Effects of wind different speed and duration on body temperature in Tree sparrow数据为平均值±标准误
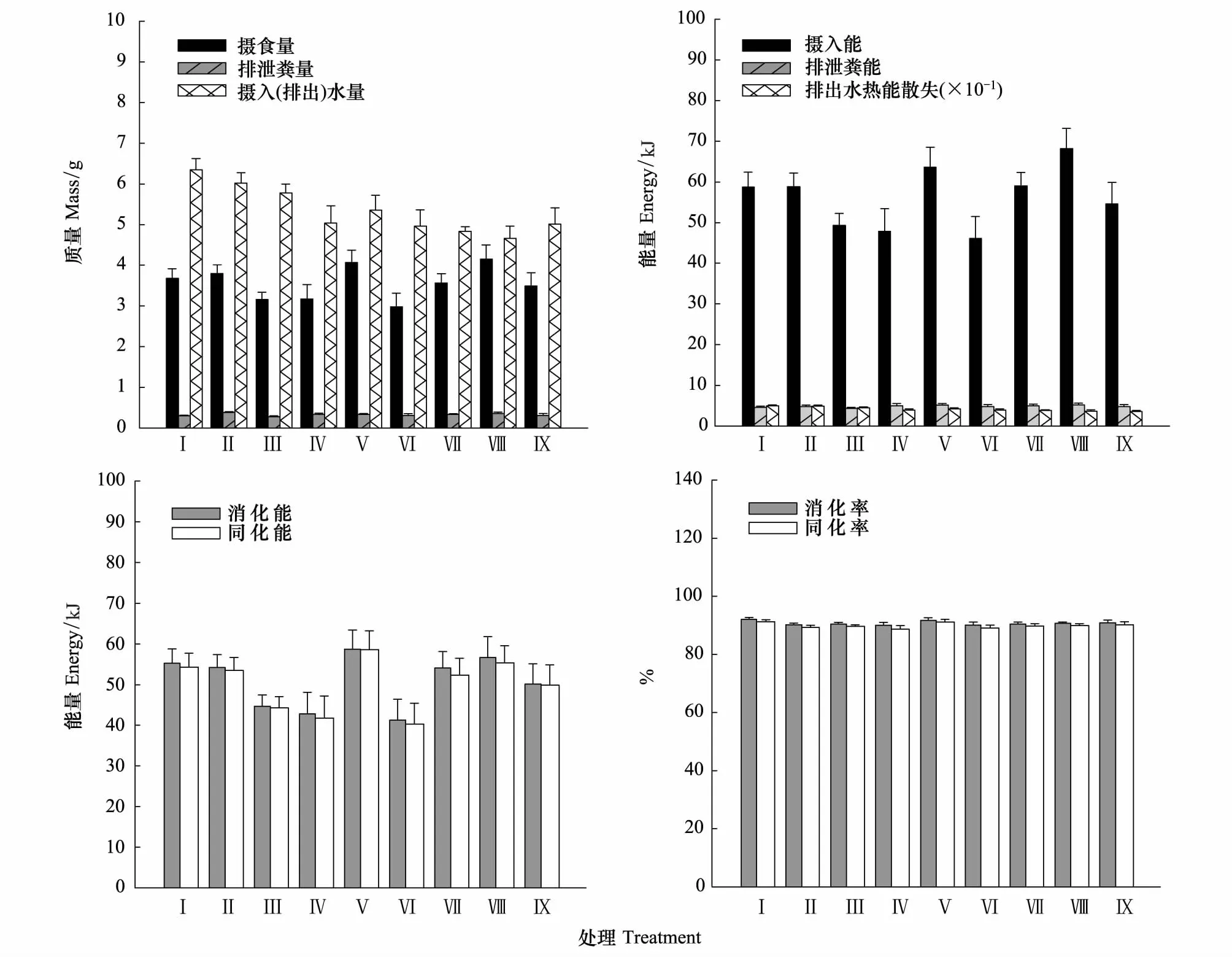
图3 风速和持续时间对树麻雀能量收支的影响Fig.3 Effects of wind different speed and duration on energy budget in Tree sparrow 图中能量收支各参数的结果为组间方差分析(One-Way ANOVA)的实测值;数据为平均值±标准误
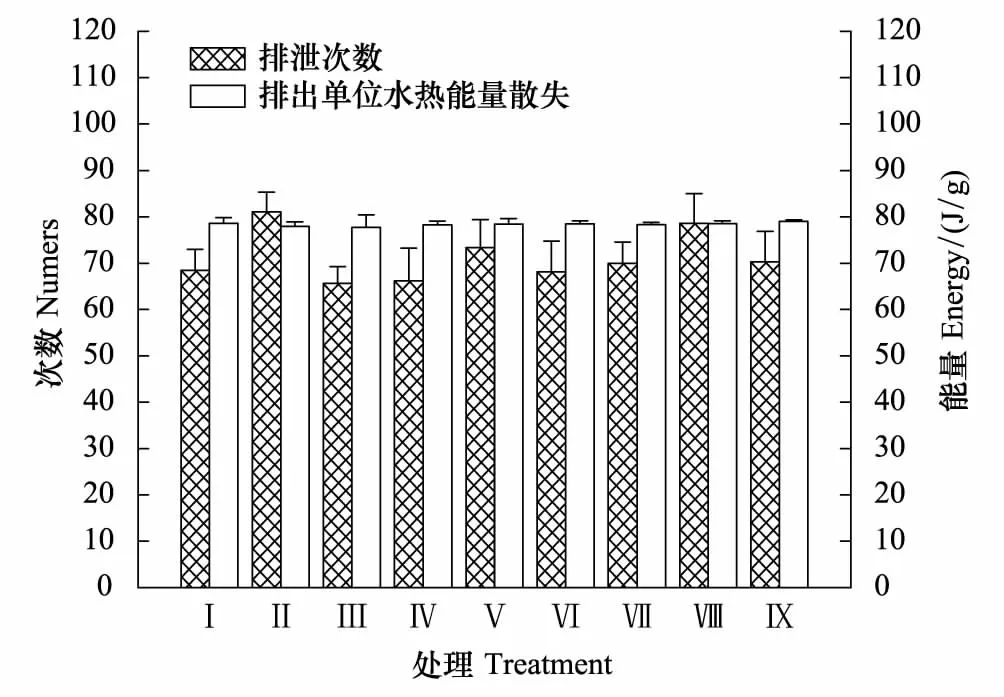
图4 风速和持续时间对树麻雀排泄次数及单位水热散失的影响Fig.4 Effects of wind different speed and duration on discharge frequency and cooling heat energy of every unit water in Tree sparrow 数据为平均值±标准误
2.3.2 双因素协方差分析结果
当体重校正至17.65 g时数据显示,风速对摄水量(排出水量)和排出水热能散失的影响显著(F(2, 62)=14.693,P=0.000;F(2, 62)=16.451,P=0.000),风速增大时摄水量和排出水热能散失减少;对摄食量、排泄粪量、排泄次数、排出单位水热能散失、摄入能、粪能、消化能、同化能、消化率和同化率的影响不显著(F(2, 62)=0.156,P=0.857;F(2, 62)=2.066,P=0.146;F(2, 62)=1.221,P=0.310;F(2, 62)=2.962,P=0.068;F(2, 62)=0.110,P=0.896;F(2, 62)=2.066,P=0.148;F(2, 62)=0.191,P=0.827;F(2, 62)=0.220,P=0.804;F(2, 62)=0.280,P=0.758;F(2, 62)=0.294,P=0.748)。
持续时间对摄食量、排泄粪量、排泄次数、摄入能、排泄粪能、消化能和同化能的影响显著(F(2, 62)=11.726,P=0.000;F(2, 62)=7.677,P=0.002;F(2, 62)=5.531,P=0.009;F(2, 62)=10.577,P=0.000;F(2, 62)=7.676,P=0.002;F(2, 62)=11.630,P=0.000;F(2, 62)=11.214,P=0.000),随着风持续时间的不同,出现摄食量、排泄粪量和摄入能2 h时最大和4 h时最小,排泄次数和粪能2 h最大,消化能和同化能4 h最小的变化趋势;对摄水量、排出水热能散失、排出单位水热能散失、消化率和同化率的影响不显著(F(2, 62)=1.492,P=0.242;F(2, 62)=2.489,P=0.101;F(2, 62)=0.221,P=0.803;F(2, 62)=1.453,P=0.251;F(2, 62)=1.547,P=0.231)。
风速-持续时间交互作用对摄食量、排泄粪量、摄水量、排泄次数、摄入能、排泄粪能、排出水热能散失、排出单位水热能散失、消化能、同化能、消化率和同化率的影响均不显著(F(4, 62)=0.247,P=0.623;F(4, 62)=0.406,P=0.529;F(4, 62)=0.819,P=0.373;F(4, 62)=0.840,P=0.367;F(4, 62)=0.652,P=0.426;F(4, 62)=0.408,P=0.528;F(4, 62)=1.577,P=0.220;F(4, 62)=0.806,P=0.377;F(4, 62)=0.869,P=0.359;F(4, 62)=1.223,P=0.278;F(4, 62)=0.556,P=0.462;F(4, 62)=0.891,P=0.353)。
总之,风速大小与树麻雀摄水量(排出水量)及排出水热能散失显著相关,摄水量和排出水热能散失随着风速增大而减少。风持续时间(1、2或4 h)与树麻雀的能量收支(不含排出水热能散失)和散热调节的次数显著相关,2 h时其能量收支最高和散热调节的次数最多,4 h时其能量收支最低和散热调节的次数最少。然而,风速和持续时间的交互作用对树麻雀能量收支的影响不显著。3级风(4 m/s)和持续时间4 h以内的风环境不会对树麻雀的能量收支产生显著影响,即树麻雀能够适应当地的平均风速环境。
3 讨论
恒温动物排出水的途径有呼吸、粪和尿,多数哺乳动物还可以通过汗液蒸发失水。体表覆羽、皮肤薄、松和缺乏腺体是鸟类进化的特点,鸟类唯一的皮脂腺称尾脂腺,故鸟类不会通过汗液蒸发的方式排出水和散热调节。鸟类的排泄物是以粪尿混合物的方式排出,排泄次数较多,粪尿无法分离。传统鸟类能量学研究中,通常是以粪尿干物质的能值记为排泄能,进而忽略了排泄物中水的能量散失。鸟类呼吸所排出的水分和散失的热能也未被考虑。实验过程中,同时准确获得恒温动物各种途径的排出水量比较困难。本文以树麻雀个体水分含量保持相对恒定和每日摄入水约等于排出水为前提,以其体温与环境温度之差来计算排出水(包含呼吸和粪尿混合物中的水)中的热能量散失,而这部分水中的能量来源于树麻雀体内的能量代谢。鸟类摄入食物(摄入能)、排出粪(粪能)和排出水(热能散失)后,所获得的能量(同化能)可以进行体内能量的转化、储存、分配和利用。因此,本文对能量收支的公式进行了部分调整。
鸟类高体温取决于产热[25]、保温和快速有效的散热调节,其中产热是获得高体温的生理基础,保温是维持高体温的关键,精确散热是保持体温恒定的必要条件。水是鸟类乃至生物体体内储存或进行能量转换的重要介质,也是鸟类和多数哺乳类动物体温维持的关键。鸟类每日可利用水的来源包括摄入的水、食物中的水和体内能量物质分解生成的代谢水。摄入低于体温的水或排出等于体温的水,都可以使其单位体重的热量保持不变。环境温度高于动物体温的特殊环境存在时,排出水仍然可以使动物单位体重的热容量保持不变,但暂时的体温调节和体内含水量减少将会使之很快面临失水(脱水)的生存胁迫。所以,鸟类体内的水是其散热调节的关键。摄水降温往往会受到客观因素的限制。与多数哺乳动物可以通过汗液蒸发散热不同,鸟类只能通过呼吸(少量水分)和以粪尿混合物的方式进行散热调节。需要散热的鸟类更多是因为剧烈运动。深、急呼吸虽然可以带走相对多的热量,但其散热也是有限的。鸟类排泄粪尿混合物中的水是其散热调节的关键,通过排泄次数和每次不同的水量实现精确、迅速和有效的散热,及时排出能使体温升高的多余热量,维持体温恒定。排泄次数能够间接反映出散热调节的次数。
散热调节意味着释放体内高于体温的多余热量。本研究发现,风速增大时排出水热能散失显著减少(P﹤0.001)。不同持续时间,摄入能、排泄的粪能和散热调节的次数(排泄次数)出现显著变化。这些结果很可能与树麻雀的散热调节有关。首先,排出水的热能散失总量仅占摄入能中很少的比例,并远远小于排泄的粪能(图3)。其次,树麻雀体温均测定于无风时段(图2),因此散热调节时的体温很可能高于测定的体温,即单位水热能量散失高于图4中的结果。而且,实际的散热调节中每次或每单位水散失的热量都应该是不同的。散热调节次数显著的增减变化表明,排出水热能量散失总量的真实值很可能已经远远大于或小于测定值。最后,散热调节次数的增减变化很可能与其行为能耗有关,即行为能耗与排出水热能散失共同影响树麻雀个体的能量收支。总之,排出水热能散失的重要生理学意义在于通过每次不同的排泄水量,实现了精确、快速和有效的散热调节,防止体温升高和维持体温相对恒定。
风速和持续时间交互作用及消除初体重影响的结果显示,树麻雀的能量收支包括摄入能、排泄粪能和排出水热能量散失总量没有显著差异。同时,各组组内初终体重变化不显著(图1)。体重是能量摄入和能量消耗最终平衡的结果[16]。因此本文认为,风速(3.6 m/s)和持续时间4 h以内的风环境不会对树麻雀的能量收支产生显著影响,即树麻雀能够适应当地的平均风速环境。自然环境中同时存在极端大风天气。树麻雀不同的行为发生也就意味着它们选择了不同的能量预算对策。当风速超过一定限度时,减少行为能耗同样有可能使树麻雀能量收支的收益相对增加。然而,树麻雀能够适应的风速上限、大风天气采用何种能量预算对策、是否同时与环境温度、光周期和食物可获得性等其它环境因子相关都需要进一步的验证。
[1] Liechti F. Birds: blowin′ by the wind?. Journal of Ornithology, 2006, 147(2): 202- 211.
[2] McLaren J D, Shamoun-Baranes J, Bouten W. Wind selectivity and partial compensation for wind drift among nocturnally migrating passerines. Behavioral Ecology, 2012, 23(5): 1089- 1101.
[3] Shamoun-Baranes J, van Loon E, Liechti F, Bouten W. Analyzing the effect of wind on flight: pitfalls and solutions. Journal of Experimental Biology, 2007, 210(1): 82- 90.
[4] Erni B, Liechti F, Bruderer B. The role of wind in passerine autumn migration between Europe and Africa. Behavioral Ecology, 2005, 16(4): 732- 740.
[5] Liechti F, Bruderer B. The relevance of wind for optimal migration theory. Journal of Avian Biology, 1998, 29(4): 561- 568.
[6] Weber T P, Hedenström A. Optimal stopover decisions under wind influence: the effects of correlated winds. Journal of Theoretical Biology, 2000, 205(1): 95- 104.
[7] Weber T P, Alerstam T, Hedenström A. Stopover decisions under wind influence. Journal of Avian Biology, 1998, 29(4): 552- 560.
[8] Ma Z J, Hua N, Zhang X, Guo H Q, Zhao B, Ma Q, Xue W J, Tang C D. Wind conditions affect stopover decisions and fuel stores of shorebirds migrating through the south Yellow Sea. Ibis, 2011, 153(4): 755- 767.
[9] Alexander R M. Energy for Animal Life. Oxford: Oxford University Press, 1999: 63- 68.
[10] Johnson M S, Thomson S C, Speakman J R. Limits to sustained energy intake Ⅰ. Lactation in the laboratory mouseMusmusculus. Journal of Experimental Biology, 2001, 204(11): 1925- 1935.
[11] Speakman J R, Król E. Limits to sustained energy intake Ⅸ: a review of hypotheses. Journal of Comparative Physiology B, 2005, 175(6): 375- 394.
[12] Klaasen M, Oltrogge M, Trost L. Basal metabolic rate, food intake, and body mass in cold-and warm-acclimated Garden Warblers. Comparative Biochemistry and Physiology A, 2004, 137(4): 639- 647.
[13] Mujahid A. Acute cold-induced thermogenesis in neonatal chicks (Gallusgallus). Comparative Biochemistry and Physiology A, 2010, 156(1): 34- 41.
[14] Collin A, Buyse J, van As P, Darras V M, Malheiros R D, Moraes V M B, Reyns G E, Taouis M, Decuypere E. Cold-induced enhancement of avian uncoupling protein expression, heat production, and triiodothyronine concentrations in broiler chicks. General and Comparative Endocrinology, 2003, 130(1): 70- 77.
[15] Saarela S, Heldmaier G. Effect of photoperiod and melatonin on cold resistance, thermoregulation and shivering/nonshivering thermogenesis in Japanese quail. Journal of Comparative Physiology B, 1987, 157(5): 625- 633.
[16] Ni X Y, Lin L, Zhou F F, Wang X H, Liu J S. Effects of photoperiod on body mass, organ masses and energy metabolism in Chinese bulbul (Pycnonotussinensis). Acta Ecologica Sinica, 2011, 31(6): 1703- 1713.
[17] Yang Z H, Shao S L. The influence of different food qualities on the energy budget and digestive tract morphology of Tree SparrowsPassermontanus. Acta Ecologica Sinica, 2011, 31(14): 3937- 3946.
[18] NcNab B K. Food habits and the evolution of energetics in birds of paradise (Paradisaeidae). Journal of Comparative Physiology B, 2005, 175(2): 117- 132.
[19] Mackinnon J, Phillipps K. A Field Guide to the Birds of China. London: Oxford University Press, 2000: 312- 340.
[20] Deng H L, Zhang X A. Standard metabolic rate in several species of passerine birds in alpine meadow. Acta Zoologica Sinica, 1990, 36(4): 377- 384.
[21] Yang X Y. Studies on Windy Climatic Change and the Formative Causes of Strong Wind in Northeast China [D]. Lanzhou: Lanzhou University, 2008.
[22] Drozdz A. Metabolic cages for small rodents // Grodzinski W, Klekowski R Z, Duncan A, eds. Methods for Ecological Bioenergetics. Oxford: Blackwell Scientific Press, 1975: 346- 351.
[23] Grodzinski W, Wunder B A. Ecological energetics of small mammals // Golley F B, Petrusewicz K, Ryszkowski L, eds. Small Mammals: Their Productivity and Population Dynamics. Cambridge: Cambridge University Press, 1975: 173- 204.
[24] Wang J M, Zhang Y M, Wang D H. Photoperiodic regulation in energy intake, thermogenesis and body mass in root voles (Microtusoeconomus). Comparative Biochemistry and Physiology A, 2006, 145(4): 546- 553.
[25] Zheng W H, Li M, Liu J S, Shao S L. Seasonal acclimatization of metabolism in Eurasian tree sparrows (Passermontanus). Comparative Biochemistry and Physiology A, 2008, 151(4): 519- 525.
参考文献:
[16] 倪小英, 林琳, 周菲菲, 王小华, 柳劲松. 光周期对白头鹎体重、器官重量和能量代谢的影响. 生态学报, 2011, 31(6): 1703- 1713.
[17] 杨志宏, 邵淑丽. 食物质量差异对树麻雀能量预算和消化道形态特征的影响. 生态学报, 2011, 31(14): 3937- 3946.
[20] 邓合黎, 张晓爱. 高寒草甸几种雀形目鸟类的标准代谢 (SMR). 动物学报, 1990, 36(4): 377- 384.
[21] 杨雪艳. 中国东北地区风的气候变化特征及大风的成因研究 [D]. 兰州: 兰州大学, 2008.
TheenergybudgetoftreesparrowsPassermontanusinwinddifferentspeedandduration
YANG Zhihong, WU Qingming, DONG Haiyan,ZOU Hongfei*
CollegeofWildlifeResources,NortheastForestryUniversity,Harbin150040,China
Wind, a common factor in the natural environment, affects the behavior and energy budgets of different small bird species in various ways. The present study examines the correlation between wind speed and duration on the energy budgets of Eurasian tree sparrows (Passermontanus). Ninety adultP.montanuswere live-trapped by mist nets in Qiqihar, Heilongjiang Province, China (47° 29′ N, 124° 02′ E) from November to December 2012. After adapting to captivity for one week at Northeast Forestry University′s Wildlife Conservation Medicine and Ecological Security Research Center, they were randomly assigned to one of nine groups, which were exposed to winds of different speeds (0.2—0.4, 1.2—1.4, 3.2—3.6 m/s) and durations (1, 2, 4 h/d) for one week in otherwise constant laboratory conditions, such as available food, temperature ((21.0±1.0) ℃) and natural light cycle photoperiod. Each group of birds inhabited the same birdcage living space, including two feeders and a water source, which provided unlimited food and water. The wind direction was set to blow from the feeder location in the birdcage to ensure that the birds could forage while facing windward. Winds of different speeds were created by electric fans at varied distances from each birdcage; an anemometer and a timer were used to measure wind speed and duration, respectively. Isolation measures were taken to ensure the experiments for each group did not interfere with the effects of wind on other groups. The body mass of each bird (BS210S balance, Sartorius Instrument Co., Ltd., Shenzhen, China) was measured to 0.01 g immediately after grouping and measured again at weekly intervals over the period of wind acclimation and testing. Body temperature was measured every day to 0.10 ℃, during which there was no wind. Food, water intake and fecal discharge frequency were recorded once a day. Meanwhile, food residues and feces were collected on a daily basis during the experiment and their caloric content was determined using an oxygen bomb calorimeter (GR- 3500, Guangdong Instrument Corp., Guangdong, China).
After acclimation, we found the body mass and body temperature ofP.montanusexhibited no significant changes with variations in wind speed and duration. The energy budgets were significantly different between the nine experimental groups, including significant differences in the mass of food and water intake, energy intake, cooling energy of water discharged, digestible energy and assimilation energy (Plt; 0.01), and the fecal discharge frequency, fecal mass and energy (Plt;0.05). Each unit of cooling energy of water discharge, digestion rate and assimilation rate showed no obvious change with different wind conditions (Pgt; 0.05). The energy budgets among groups were remarkably different without considering the effects of initial body weight. In this paper, as wind speed increased, water intake and cooling energy of water discharge in this species declined proportionally (Plt; 0.001). Variations in wind duration resulted in significant differences in energy intake, fecal energy and discharge frequency (Plt; 0.01) for wind durations of 2 or 4 h. However, the final consequence of wind speed and duration created no significant differences in the energy budgets ofP.montanusunder different experimental conditions, after the effects of initial body mass were eliminated, which was based on double-factorial analysis of variance on the combined action of wind speed and duration. To summarize, the wind environment of this study′s setting, which simulated common local conditions, had no significant effect on the energy budget inP.montanus.
energy budget;Passermontanus; wind
中央高校基本科研业务费支持项目(DL12EA04); 国家自然科学基金资助项目(31070345, 30670350)
2013- 04- 22;
2013- 07- 22
*通讯作者Corresponding author.E-mail: hongfeizou@163.com
10.5846/stxb201304220776
杨志宏,吴庆明, 董海燕, 邹红菲.风速和持续时间对树麻雀能量收支的影响.生态学报,2013,33(19):6028- 6034.
Yang Z H, Wu Q M, Dong H Y,Zou H F.The energy budget of tree sparrowsPassermontanusin wind different speed and duration.Acta Ecologica Sinica,2013,33(19):6028- 6034.

