蓝莓花色苷提取工艺的优化研究
张学宁, 高志华, 刘庆忠, 李会平, 师莉莎
(1.河北科技大学生物科学与工程学院,河北石家庄 050018;2. 河北经贸大学生物科学与工程学院,河北石家庄 050061;3.山东省果树研究所,山东泰安 271000)
蓝莓花色苷提取工艺的优化研究
张学宁1, 高志华2, 刘庆忠3, 李会平2, 师莉莎1
(1.河北科技大学生物科学与工程学院,河北石家庄 050018;2. 河北经贸大学生物科学与工程学院,河北石家庄 050061;3.山东省果树研究所,山东泰安 271000)
以体积分数为0.1%的盐酸乙醇溶液为提取液,探讨蓝莓果实花色苷的最佳提取工艺。采用单因素和正交设计来考察乙醇体积分数(A)、料液比(B)、温度(C)、时间(D)、火力(E)在水浴法、微波法和超声波法3种提取方法中的作用。通过光谱扫描确定了蓝莓花色苷的最大吸收峰在535 nm处,水浴法、超声波法和微波法提取蓝莓果实花色苷的最佳工艺分别为A3B3C2D3,A3B2C1D3和A2B2C2E3。品种间花色苷的最适宜提取方法亦有所不同:超声波法最优,适于北陆和乔治2个品种;微波法次之,适于伯克利品种;水浴法提取效果最差。
蓝莓;花色苷;提取工艺
蓝莓又名蓝果越桔、蓝浆果,为杜鹃花科越桔属植物。蓝莓果实呈蓝色,果肉细腻,果味酸甜,风味独特,其花色苷等多酚类物质是所有水果与蔬菜中含量最高的[1]。蓝莓果实中的花色苷是品质优良的天然色素,具有很强的抗氧化性,具有消除自由基、降低血清胆固醇、抗肿瘤、促进视网膜上视红素再合成等生理活性功能[2-3],可广泛用于食品和医药领域。
花色苷一词是 MARGUART 在1835年首先用来命名矢车菊花朵中的蓝色提取物时提出来的,现在为同类物质的总称。花色苷不稳定,在植物中主要以花色苷糖配体存在。目前普遍采用的提取方法主要有水浴法[4]、醇提法[5-6]、树脂法[7]、微波法[8-9]、超声波法[10]等。蓝莓果中花色苷存在于细胞内或吸附在由纤维素组成的细胞壁上。常规的浸提法提取效率低,成本高,且存在溶剂残留。正交设计试验和响应面法已在食品工业有广泛的应用[11-14]。与响应面法相比,正交设计试验是一种高效率、快速、经济的设计方法。为了更有效地开发蓝莓花色苷资源,笔者采用无毒的乙醇溶剂提取辅助水浴法、超声波法和微波法,以有助于细胞的破碎以及花色苷的释放[10],采用单因素和正交设计试验相结合对蓝莓果实中的花色苷提取工艺进行优化,以期探索最佳提取工艺,提高花色苷的提取率,筛选出最佳的提取工艺参数。
1 材料与方法
1.1材料
将伯克利(Berkeley)、北陆(Northland)、乔治(Georgiagem)等3个蓝莓品种的果实(均采自山东省果树研究所)采摘后立即冷冻并于-40 ℃保存。实验开始后,将果实放入恒温电热鼓风干燥箱内,于45 ℃下恒温烘干果实至恒重,粉碎后过380 μm (40目)筛子。将过筛的果粉放入干燥器中避光、干燥保存。
1.2花色苷最大吸收峰的确定
精确称取0.5 g蓝莓果粉,用盐酸乙醇浸提,真空抽滤,定容至25 mL。取10 mL提取液,用pH值为1.0的溶剂(25 mL 0.2 mol/L KCl+75 mL 0.2 mol/L HCl)定容至25 mL,进行光谱扫描,确定最大吸收峰。
1.3提取溶剂的选择
精确称取0.5 g蓝莓果粉,在40 ℃、料液比为1 g∶20 mL(简称1∶20,下同) 条件下,分别用表1中提取剂浸提120 min,抽滤并用相应的浸提液定容至25 mL。分别取定容好的浸提液10 mL,用pH值为1.0的溶剂定容至25 mL,采用pH值示差法[15]测定花色苷吸光度值,筛选出合适的提取剂。

表1 花色苷提取剂
注:表1中百分数表示体积分数,下同。
1.4提取方法
取蓝莓果粉每份0.2 g,以乙醇+盐酸溶液为提取剂,试验前预处理24 h。设计乙醇浓度(体积分数,下同)、提取时间、提取温度、料液比及微波火力的单因素试验,见表2。浸提后抽滤并定容至25 mL,取10 mL提取液,用pH值为1.0的溶剂定容至25 mL。

表2 蓝莓花色苷提取单因素试验设计
2 结果与讨论
2.1花色苷最大吸收峰的确定
花色苷在中性和弱碱性溶液中不太稳定,提取时通常采用酸性提取剂,在较低的pH值(<4)时花色苷的4种主要结构之间存在平衡,有明显的吸收峰出现[5,16]。孟宪军等研究认为,当pH 值分别为1和3时,溶液吸光度值变化不明显, 颜色为深红色[17]。本试验将在酸性(pH值为1.0)提取液中浸提的花色苷在400~900 nm波长范围内进行光谱扫描,结果见图1。

图1 花色苷吸收峰光谱扫描图Fig.1 Scan spectrum of blueberry extracts
由图1可以看出,花色苷最大吸收峰在535 nm处。该结果与LOHACHOOMPOL等报道的蓝莓果实花色苷的最大吸收峰在538 nm处基本一致[18],但与王秀菊等用蓝莓酿酒果渣中提取的花色苷的最大吸收峰在520 nm处有一定差异[5]。这可能与实验所选用蓝莓的花色苷的性质有关。
2.2提取剂的选择
石碧等研究认为蓝莓花色苷是水溶性多酚类物质,可溶于水、甲醇、乙醇等极性溶剂中[19]。水中加入一定量的乙醇形成多酚复合体系,更适宜多酚的提取。在相同提取条件下,通过pH值示差法测定蓝莓花色苷吸光度。不同提取剂的提取结果见图2。
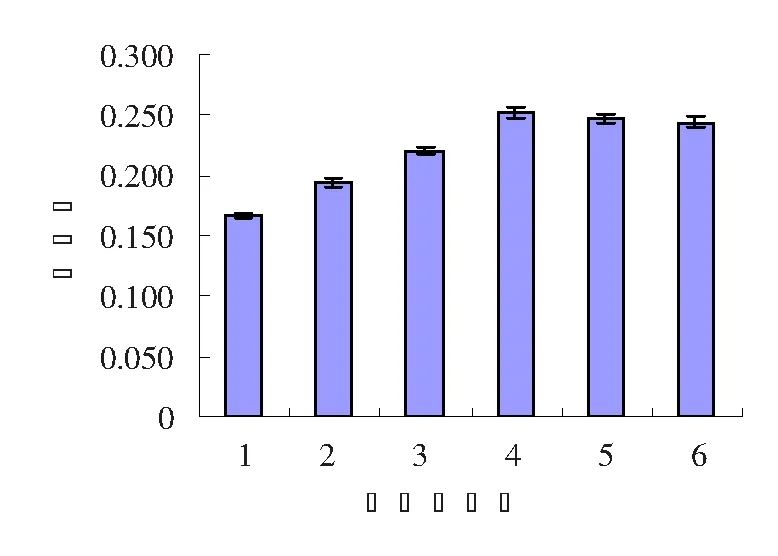
图2 不同提取剂的提取结果Fig.2 Test results of anthocyanins extracted with different solvents
如图2所示,用表1中1,2,3号提取剂与用4,5,6号提取剂相比花色苷吸光度差异比较显著,后三者间差异不显著。考虑到甲醇有毒,而乙醇具有溶解性能好、对植物细胞穿透能力强等优点,本实验选择了5号溶剂(80%乙醇+0.1%盐酸)作为最佳提取剂。
2.3水浴法
2.3.1 单因素实验结果
水浴法单因素实验结果见图3。

图3 水浴法单因素分析Fig.3 Extraction of anthocyanin treated with water-bath affected by different factors
花色苷提取率随乙醇体积分数的增加而升高,如图3 a)所示,其体积分数为60%~90%时花色苷吸光度都比较高。从节约乙醇的角度考虑,乙醇适宜体积分数为60%~80%。
料液比的增加能提高分子扩散速率、缩短平衡时间,因而使溶解在提取剂中的花色苷增多,从而增加了提取量。从图3 b)可以看出,吸光度值在料液比为1∶15时最大;料液比为(1∶15)~(1∶25)时提取率变化较小。从提高效果、减少溶剂量和降低浓缩负荷等方面考虑,料液比为(1∶15)~(1∶20)较为合适。
升温能提高花色苷的溶解度和扩散速度,而且有助于细胞的破坏、提高细胞膜的通透性。由于花色苷对热敏感,研究人员认为当温度超过某一临界温度时会加速花色苷的氧化和降解,反而使提取率下降[20-23]。从图3 c)可以看出:当温度小于50 ℃时,花色苷吸光度值随时间的增加逐渐升高,在50 ℃时花色苷吸光度达最大值,温度再高吸光度值开始下降,可能是由于温度高了出现了降解现象。因此,水浴温度为40~60 ℃较好。
提取时间越长,提取也越充分。但张华等研究认为花色苷易发生氧化、降解损失,时间越长杂质越多[24]。从图3 d)可以看出,花色苷吸光度值随时间的延长而逐渐升高,在水浴时间为120 min时花色苷吸光度达到最高,时间再长吸光度值下降,这可能是出现了降解现象。综合测定结果及时间效益,超声时间为90~150 min较好。
2.3.2 正交试验结果
根据单因素分析的结果进行正交设计,如表3所示,各种因素对提取效果影响的主次顺序为乙醇体积分数>时间>温度>料液比。根据正交试验结果分析得知,最佳提取条件应为A3B3C2D3,即使用0.1%的盐酸乙醇溶液,在乙醇体积分数为80%、料液比为1∶20、温度为60 ℃条件下,对蓝莓果粉水浴120 min进行花色苷提取,测定提取的花色苷吸光度值为0.257。该组合低于试验编号8和编号9的值,方差分析得出与试验编号8和编号9差异不显著,并且各因素影响顺序为A>C>D>B,所以选用A3B3C2D3合理。本试验的结果与王秀菊等的主要差异在于降低了水浴温度,从而减少了花色苷的降解,同时提取时间延长,使提取效果更充分[5]。

表3 水浴法提取蓝莓花色苷正交试验结果
2.4超声波辅助提取法
2.4.1 单因素实验结果
同水浴的单因素分析原理,根据图4超声波法的单因素处理结果,花色苷提取选取体积分数为50%~70%的乙醇,料液比为1︰10,1︰15,1︰20,超声时间为20,30,40 min,提取温度为40~60 ℃进行正交设计。
单因素实验结果见图4。
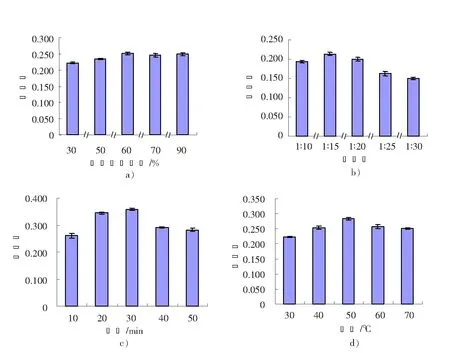
图4 超声波辅助提取法单因素分析Fig.4 Extraction of anthocyanin treated with ultrasonic affected by different factors
2.4.2 正交试验结果(见表4)

表4 超声波辅助提取法提取蓝莓花色苷正交试验结果
从表4可以看出,各种因素对提取效果影响的主次顺序为料液比>温度>乙醇体积分数>超声时间。根据以上实验结果分析,最佳提取条件为A3B2C1D3,即使用体积分数为0.1%的盐酸乙醇溶液,乙醇体积分数为70%,料液比为1∶15,温度为60 ℃,超声波频率为40 kHz,对蓝莓粉末超声20 min进行花色苷提取,测定提取的花色苷吸光度值为0.222。该组合低于实验编号3和编号9。由方差分析得出编号3和编号9差异不显著,并且各因素影响顺序为B>D>A>C,所以选用A3B2C1D3最佳的提取工艺。
2.5微波提取法
2.5.1 单因素实验结果(见图5)
同水浴的单因素分析原理,图5 a)和图5 b)中花色苷提取选乙醇体积分数为60%~80%,料液比为1∶10,1∶15,1∶20进行正交试验。

图5 微波提取法单因素分析Fig.5 Extraction of anthocyanin treated with microwave affected by different factors
花色苷吸光度与时间关系如图5 c)所示。提取时间为10 s时花色苷吸光度值最大,提取时间大于10 s后吸光度逐渐降低。微波作用时间越长,吸光度越高,但微波时间长同时也会导致升温过快,从而使提取液中的乙醇挥发,所以时间越短越好。故提取时间选取5,10,15 s进行正交试验。
花色苷吸光度与火力的关系如图5 d)所示。由于微波对细胞膜具有破碎作用,花色苷吸光度值随着火力的增大逐渐增加,火力增大到80 kHz时吸光度值达到最大,之后开始减小,所以选择火力控制在60~100 kHz进行正交试验。
2.5.2 正交试验结果(见表5)
从表5可以看出,各种因素对提取效果影响的主次顺序为料液比>微波时间>乙醇体积分数>火力。最佳提取条件为A2B2C2E3,即使用体积分数为0.1%的盐酸乙醇溶液,在乙醇体积分数为70%、料液比为1∶15、火力为100 kHz条件下,对蓝莓粉末微波10 s进行花色苷提取。试验验证该条件下,测定提取的花色苷吸光度值为0.277,方差分析结果显示应该选取A2B2C2E3为最优组合。
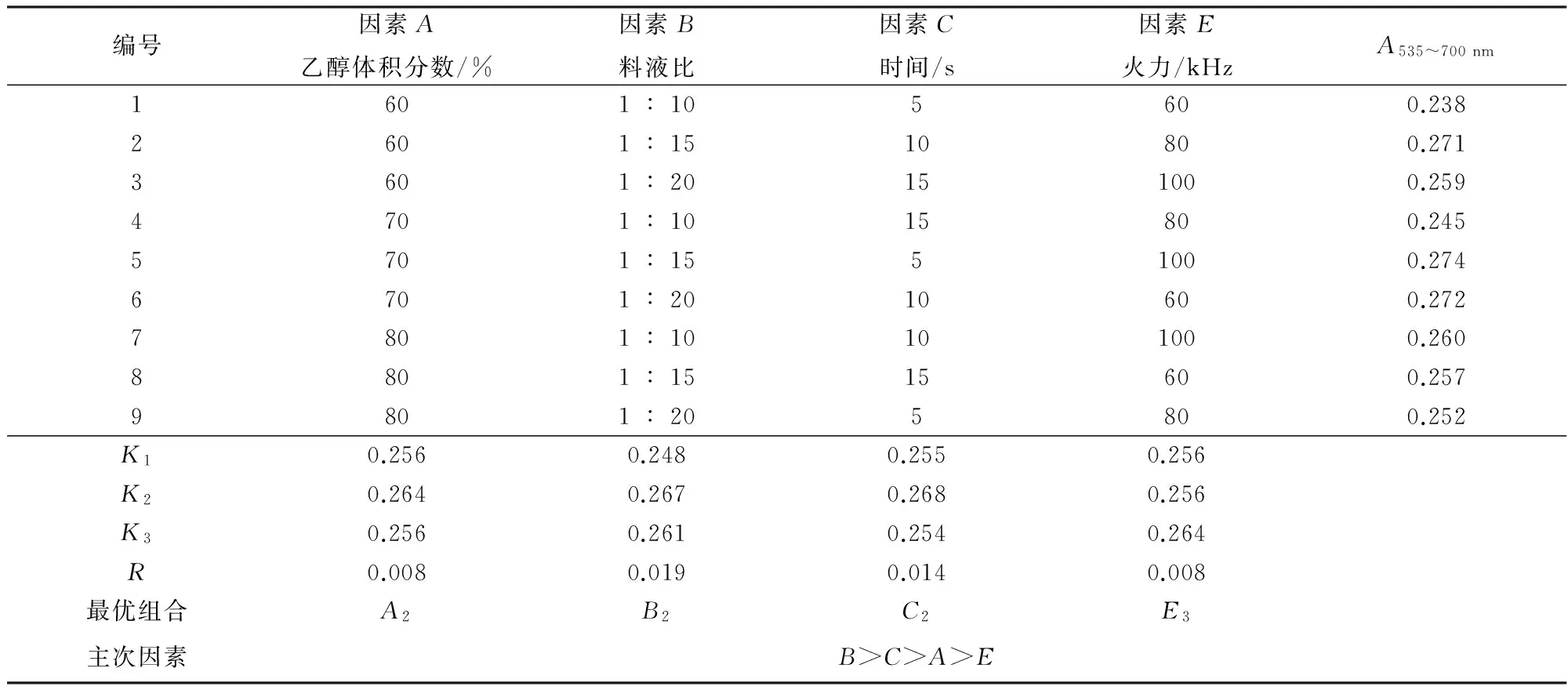
表5 微波法提取蓝莓花色苷正交试验结果
2.6其他蓝莓品种花色苷的提取(见表6)

表6 不同蓝莓品种的花色苷吸光度值
应用以上3种方法筛选出的最佳工艺条件提取3个蓝莓品种的花色苷。由表6可以看出,对于伯克利品种而言,水浴法和超声波法差异不显著,微波法差异显著且更适于该品种。对于北陆和乔治2个品种,3种提取方法都有显著差异,而超声波法更适于这2个品种花色苷的提取。目前,关于蓝莓花色苷的提取方法,提取溶解辅助水浴法的研究较多,但是超声波法和微波法用于蓝莓花色苷的提取报道较少。本实验结果显示这2种提取方法明显优于水浴法,且以超声波法最佳。
/
[1] 李颖畅,宣景宏,孟宪军. 蓝莓果中花色素苷的研究进展[J].食品研究与开发,2007, 28(1):178-180.
LI Yingchang, XUAN Jinghong,MENG Xianjun.Research progress of blueberry anthocyanins[J].Food Research and Development,2007, 28(1):178-180.
[2] 李亚东,张志东,吴 林. 蓝莓果实的成分及其保健功能[J].中国食物与营养, 2002(1): 27-28.
LI Yadong,ZHANG Zhidong,WU Lin. Blueberry fruit ingredients and its health care function[J]. Food and Nutrition in China, 2002(1): 27-28.
[3] 胡雅馨,李 京,惠伯棣. 蓝莓果实中主要营养及花青素成分的研究[J].食品科学, 2006, 27(10): 600-603.
HU Yaxin,LI Jing,HUI Boli. Blueberry fruit study on major nutrition and anthocyanins[J]. Food Science , 2006, 27(10): 600-603.
[4] 马慧萍,贾正平,谢景文,等. 淫羊藿总黄酮的提取分离工艺研究[J].华西药学杂志, 2002,17(1):1-3.
MA Huiping,JIA Zhengping,XIE Jingwen,et al. Studies on extraction and separation of total flavonoid of herbaepimedii[J]. West China Journal of Pharmaceutical Sciences ,2002,17(1):1-3.
[5] 王秀菊,杜金华,马 磊,等. 蓝莓酒渣中花色苷提取工艺的优化及其稳定性的研究[J].食品与发酵工业,2009(9): 109-121.
WANG Xiuju,DU Jinhua,MA Lei,et al. Anthocyanin from blueberry wine pomace:Extraction optimization and stability test[J]. Food and Fermentation Industries, 2009(9): 109-121.
[6] MATAIX E, de CASTRO M D. Determination of anthocyanins in wine based on flow-injection, liquid-solid extraction, continuous evaporation and high-performance liquid chromatography-photometric detection[J]. Journal of Chromatography A, 2001, 910: 255-263.
[7] NORBAK R, BRAANDT K, NIELSEN J K, et al. Flower pigment composition of cross species and cultivars used for a chemotaxonomic investigation[J]. Biochemical Systematics and Ecology, 2002, 30: 763-791.
[8] 周 谨,闰小燕,贺高红,等. 微波提取银杏黄酮苷的方法研究[J].天然产物研究与开发, 2002, 14(1): 42-45.
ZHOU Jin,RUN Xiaoyan,HE Gaohong,et al. Study on extraction of ginkgo biloba flavonoid glycosides by microwave treatment[J].Natural Product Research and Development, 2002, 14(1): 42-45.
[9] 赵丽娟,王翠艳,陈崇军. 葛根总黄酮的两种不同提取方法比较[J]. 鞍山钢铁学院学报, 2002,25(2): 105-107.
ZHAO Lijuan,WANG Cuiyan,CHEN Chongjun. Comparation of two different methods for extraction of total anthoxanthinfrom pueraria thomsonii benth[J].Journal of Anshan Institute of I.& S. Technology, 2002,25(2): 105-107.
[10] 王铮敏. 超声波在植物有效成分提取中的应用[J]. 三明高等专科学校学报, 2002, 19(4): 45-53.
WANG Zhengmin. Applications of ultrasonic extraction in effective constitution of plants[J].Journal of Sanming College, 2002, 19(4): 45-53.
[11] 王晓林,钟方丽,孙 威,等.东北铁线莲总多酚的超声提取工艺研究[J].河北科技大学学报,2012,33(1):32-35.
WANG Xiaolin,ZHONG Fangli,SUN Wei, et al.Study on extraction technology of total polyphenols inClemmatisManshuricaRupr. [J].Journal of Hebei University of Science and Technology,2012,33(1):32-35.
[12] 仇 燕,仇彦博. 柚皮总黄酮超声波辅助提取工艺的研究[J].河北科技大学学报,2010,31(4):330-333.
QIU Yan,QIU Yanbo. Ultrasonication-assisted extraction of total flavonoids from fruit peels of guanxipomelo[J].Journal of Hebei University of Science and Technology, 2010,31(4):330-333.
[13] 冯海燕,李向军,胡瑞省.超声法提取萹蓄总黄酮的正交试验研究[J].河北科技大学学报,2011,32(6):611-614.
FENG Haiyan,LI Xiangjun,HU Ruisheng. Orthogonal test in extraction of total flavonoids from polygonum aviculare by ultrasonic method [J].Journal of Hebei University of Science and Technology,2011,32(6):611-614.
[14] 王 健,张雪霞,王淑华,等.美伐他汀提取工艺研究[J].河北工业科技,2010,27(1):35-37.
WANG Jian,ZHANG Xuexia,WANG Shuhua,et al. Study on process of mevastat in extraction[J].Hebei Journal of Industrial Science and Technology,2010,27(1):35-37.
[15] 霍琳琳,苏 平,吕英华.分光光度法测定桑葚总花色苷含量的研究[J]. 酿酒,2005, 32(4): 88-89.
HUO Linlin,SU Ping,LYU Yinghua.Measurement of total anthocyanins in mulberry by UV- visible spectroscopy[J].Liquor Making,2005, 32(4): 88-89.
[16] 阚建全. 食品化学[M ]. 北京: 中国农业大学出版社, 2002.
KAN Jianquan. Food Chemistry[M].Beijing: China Agricultural University Press,2002.
[17] 孟宪军,于 娜,李颖畅, 等. 蓝莓花色素苷稳定性研究[J]. 食品研究与开发, 2008,29(4):49-53.
MENG Xianjun,YU Na,LI Yingchang,et al.Study on the stability of anthocyanins from blueberry[J]. Food Research and Development,2008,29(4):49-53.
[18] LOHACHOOMPOL V, SRZEDNICKI G, CRASKE J. The change of total anthocyanins in blueberries and their antioxidant effect after drying and freezing[J]. Journal of Biomedicine and Biotechnology, 2004, 5: 248-252.
[19] 石 碧, 狄 莹. 植物多酚[M]. 北京: 科学出版社, 2000.
SHI Bi,DI Ying. Plant Polyphenols[M].Beijing:The Science Press,2000.
[20] 陆国权,吴小蓉.黑豆皮色素的提取及其理化性质研究[J].中国粮油学,1997,12(3):55-57.
LU Guoquan,WU Xiaorong.Pigment extraction from dark soybean skin and its physical and chemical properties[J].Journal of the Chinese Cereals and Oils Association, 1997,12(3):55-57.
[21] 双长明,陈学平.杨梅果汁花色苷及其色泽稳定性的研究[J].食品与发酵工业,1991(3):1-6.
SHUANG Changming,CHEN Xueping. Myrica rubra fruit anthocyanins and color stability[J].Food & Fermentation Industry ,1991(3):1-6.
[22] 郑 杰,丁晨旭,赵先恩,等.花色苷化学研究进展[J].天然产物研究与开发,2011,23(5):970-978.
ZHENG Jie,DING Chenxu,ZHAO Xianen,et al.Review of anthocyanins chemical studies[J].Natural Product Research and Development,2011,23(5):970-978.
[23] 位佳静,邓浩红,田小燕,等.花色苷稳定化途径及自聚合效应研究进展[J].包装与食品机械,2012,30(4):44-49.
WEI Jiajing,DENG Haohong,TIAN Xiaoyan,et al.Advance in research of anthocyanins stabilization approach and self-association effect[J].Packaging and Food Machinery,2012,30(4):44-49.
[24] 张 华,李景琳,李传新, 等.越桔红色素提取工艺的研究[J].辽宁农业科学,1998, 29(2):8-12.
ZHANG Hua,LI Jinglin,LI Chuanxin,et al. Study on the extraction technology of red pigment from blueberry[J]. Liaoning Agricultural Science,1998, 29(2):8-12.
Optimization of extraction procedure of anthocyanins from blueberry
ZHANG Xuening1, GAO Zhihua2, LIU Qingzhong3, LI Huiping2, SHI Lisha1
(1.School of Biological Science and Engineering, Hebei University of Science and Technology, Shijiazhuang Hebei 050018, China; 2.School of Biological Science and Engineering, Hebei University of Economics and Business, Shijiazhuang Hebei 050061, China; 3.Shandong Institute of Pomology, Tai'an Shandong 271000, China)
The optimum procedure for anthocyanins extraction from blueberry with 0.1% HCl ethanol as solvent was discussed. Orthogonal design and single factor method were used to determine the effects of the concentration of alcohol (A), the material (B), the tradition time(C), the tradition temperature (D) as well as the wave energy (E) in water-bath method, micro-wave method and ultrasonic method. It shows that the maximum absorption wavelength of the pigment is 535 nm. The optimal conditions for water-bath, ultrasonic, and microwave extraction areA3B3C2D3,A3B2C1D3andA2B2C2E3, respectively. The above three combinations were applied to the anthocyanins extraction of three cultivars named Berkeley, Georgiagem and Northland. It shows that the ultrasonic method is better than the other two, the microwave extraction is second better, while water-bath is the last.
blueberry; anthocyanin; extraction procedure
1008-1534(2013)02-0066-07
TS264
A
10.7535/hbgykj.2013yx0115
2012-10-08;
2012-11-20
责任编辑:张士莹
河北科技大学青年基金资助项目(XL200764);河北科技大学博士科研启动基金资助项目(QD200964);河北科技大学大学生科技及创新项目
张学宁(1976-),女,河北辛集人,讲师,博士,主要从事细胞工程及其生物活性物质方面的研究。
E-mail:xueningzhang@sohu.com

