解毒消癥饮逆转氟尿嘧啶诱导的肝癌干细胞耐药的机制研究
陈旭征 黎金浓 胡丹 曹治云 廖联明 杜建
化疗耐药是肿瘤复发、转移的常见原因,探索解决化疗耐药的问题是改善化疗效果的关键。近年来科学家们在瘤体中发现了一种数目极少但具有很强肿瘤形成能力的细胞——肿瘤干细胞(cancer stem cell,CSC),这些肿瘤干细胞对常规的化疗药物不敏感,可能是肿瘤患者化疗耐药的主要原因之一。目前已经证实在前列腺癌[1]、肾癌[2]、胰腺癌[3]、肝癌[4]等瘤体中发现了CSC的存在。找寻一种有效的抑制CSC生长或诱导其分化的方法成为解决肿瘤患者化疗耐药的有效手段之一。
复方解毒消癥饮是全国名老中医、福建中医药大学杜建教授的经验方,用于消化道肿瘤围手术期辅助治疗的一种清热解毒中药,由白花蛇舌草、夏枯草、山慈菇、苦参组成。临床研究发现肝癌患者围手术期间联用该方能明显延长患者的生存率,降低肝癌的复发和转移[5]。基础研究发现该方能够下调肝癌干细胞相关因子CD133和c-kit的表达水平,可能具有抑制CSC生长的作用[6]。本文通过检测干细胞相关因子ATP结合盒转运蛋白G2(ATP-binding cassette superfamily G member 2,ABCG2)和八聚体结合转录因子4(octamer 4,Oct4)mRNA 的表达及侧群(side population,SP)细胞的比例,观察解毒消癥饮乙酸乙酯提取物(ethyl acetate extraction from Jiedu Xiaozheng Yin,EE-JXY)能否改善肝癌Huh7细胞对小剂量5-氟尿嘧啶(5- fluorouracil,5-FU)的化疗抵抗作用,从分子水平深入研究该方抗消化道肿瘤复发转移的机理。
材料与方法
一、试剂
本研究中使用的试剂包括:5-FU(250 mg/ml,天津金耀公司),高糖DMEM培养基(美国Hyclone公司),胎牛血清(美国GIBCO公司),胰蛋白酶(美国Hyclone公司),MTT(美国Invitrogen公司),Trizol(美国Invitrogen公司),反转录试剂盒(美国Promega公司),Hoechst33342染料(美国Sigma公司)、Verapamil (美国Sigma公司)和碘化丙啶(PI,南京凯基公司)。引物由上海生工公司合成。
二、细胞培养
人肝癌细胞株Huh7购自中国科学院上海生命科学研究院,采用含10﹪胎牛血清、1×105U/L的青链霉素的高糖DMEM培养基培养,置于37℃、5﹪CO2饱和湿度的培养箱(HERAcell)中培养及传代。
三、药物制备
白花蛇舌草150 g、夏枯草75 g、山慈菇75 g、苦参75 g购自香港培力药业有限公司。将药物混匀粉碎后以10倍体积的75﹪乙醇回流提取2次,每次1h,合并提取液,抽滤后减压浓缩。浓缩液以水混悬,用石油醚萃取3次后,再用乙酸乙酯萃取3次,合并乙酸乙酯萃取液,减压浓缩,真空干燥后即得EE-JXY。
四、实验方法
1.MTT法观察EE-JXY对Huh7肝癌细胞存活率的影响:调整细胞浓度为1×104个/ml接种在 96孔板,分别加入含 0,0.0625,0.125,0.25,0.5mg/ml的EE-JXY的高糖DMEM培养基100μl,干预24 h后弃去上清液,每孔加入0.5 mg/ml的 MTT 100μl,继续培养 4 h,弃上清,加入100μl DMSO终止反应。用490 nm波长的酶标仪(BioTek)检测吸光度(A),空白组调零。计算细胞存活率及半数抑制浓度(IC50)值。存活率(﹪)=A给药组/ A空白组×100﹪。以上实验重复3次,每次做8个平行复孔。
2.MTT观察EE-JXY联合小剂量5-FU对Huh7肝癌细胞存活率的影响:调整细胞浓度为1×104个/ml接种在96孔板。实验分3组:空白组、小剂量5-FU组、联合组。空白组:未给药干预,分别在培养1d和4 d后进行MTT检测;小剂量5-FU组:加入终浓度为10 μg/ml的5-FU后,分别在第1天和第4天进行MTT检测;联合组:加入终浓度为10 μg/ml 5-FU分别干预细胞24 h和96 h,同时在第0小时和72小时分别加入0.17mg/ml的EE-JXY干预24 h。MTT实验步骤同前。
3.流式细胞仪检测SP细胞比例:消化干预后的人肝癌细胞Huh7,重悬于37℃预热的含2﹪FBS的高糖DMEM培养基中,制备成单细胞悬液,调整浓度为1×106个/ml。每1ml加入终浓度为5 μg/ml的Hoechst 33342染料。同时做一管对照管,即加入Hoechst 33342染料的同时加入终浓度为50 μmol/L的Verapamil。两管同时置于37℃水浴摇床中避光振荡90min,孵育结束后,4℃离心弃上清液重悬于预冷的含2﹪胎牛血清的高糖DMEM培养基中,调整浓度为1×107个/ml。上流式细胞仪(Beckman)检测前加入终浓度为2 μg/ml的PI染液用以排除死亡细胞。Hoechst 33342在紫外光源激发下发出红蓝两种不同波长荧光,蓝光用450/20滤光片检测,红光用675LP滤光片检测。
4.聚合酶链反应(PCR)检测ABCG2、Oct4 mRNA的表达:用Trizol一步法提取细胞总RNA并检测总RNA浓度。取1 μg总RNA与oligo(dT)混合,逆转录成cDNA,引物序列见表1。PCR扩增条件为:94℃变性30 s,58℃退火30 s,72℃延伸30 s,35个扩增循环。GAPDH作为内参照。PCR产物进行1.2﹪琼脂糖凝胶电泳,电泳条带经凝胶成像系统(Bio-rad)拍照并分析。
五、统计学分析方法
结 果
一、EE-JXY抑制肝癌细胞株Huh7的增殖
随着EE-JXY给药浓度的加大和干预时间的延长,Huh7细胞的存活率逐渐降低,药物抑制率逐渐升高,呈现出明显的剂量和时间依赖。可见EE-JXY能明显抑制肝癌细胞株Huh7的增殖。经过计算,干预24 h的IC50值为0.17mg/ml(图1)。

图1 EE-JXY对肝癌细胞株Huh7增殖的影响
二、EE-JXY联合小剂量5-FU抑制肝癌细胞株Huh7的增殖
与空白组比较,小剂量5-FU和联合给药干预细胞24 h后细胞存活率分别下降到(84.54±2.88)﹪和(58.36 ±3 .52)﹪,结果有统计学差异(F=256.32,P=0.00);当小剂量5-FU和联合给药干预细胞96 h后,细胞存活率分别下降到(31.23±2.42)﹪和(25.37±0.99)﹪,结果有统计学差异(F=645.71,P=0.00,表2)。可见,给药后细胞存活率明显降低,以联合给药组下降更为显著,说明EE-JXY能显著增强低剂量5-FU抑制Huh7细胞增殖的作用。
三、EE-JXY对SP细胞化疗耐药性的影响
如图2a所示,Hoechst33342低染的位置(指示框)出现一群特殊的huh7细胞亚群,含量约为0.86﹪。当加入Verapamil抑制剂时,这群细胞的比例几乎消失(图2b)。由此,本研究认定这群特殊细胞群为SP细胞。当培养体系中加入10 μg/ml 5-FU作用24,96 h后,Huh7细胞中SP所占比例明显增加,且增加的程度有时间依赖趋势(从24 h的4.72﹪升高至96 h的12.07﹪)(图2c、2e)。当加入0.17 mg/ml EE-JXY作用24 h后,SP比例均有不同程度的下降(图2d、2f),可见EE-JXY能显著降低SP亚群的比例。

表1 ABCG2、Oct4和GAPDH引物序列

表2 EE-JXY联合小剂量5-FU抑制肝癌细胞株Huh7的增殖
四、EE-JXY下调小剂量5-FU所导致的ABCG2、Oct4 mRNA表达的上调
在培养体系中加入小剂量5-FU作用24 h后发现,huh7细胞中ABCG2、Oct4、Bmi-1 mRNA的表达水平均有不同程度的升高,说明小剂量5-FU能诱导干细胞相关因子的表达。联合组与小剂量5-FU组比较,ABCG2、Oct4 mRNA表达水平均有下降,说明EE-JXY能够下调小剂量5-FU所导致的ABCG2、Oct4 mRNA表达的上调,从而降低Huh7细胞对小剂量5-FU的化疗抵抗(图3)。
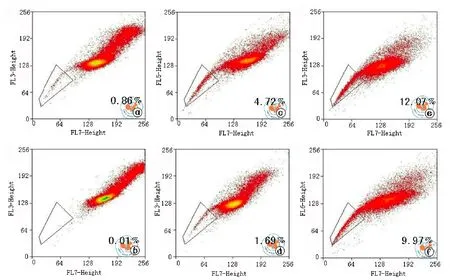
图2 EE-JXY对SP细胞化疗耐药性的影响

图3 EE-JXY对小剂量5-FU上调huh7细胞ABCG2、Oct4 mRNA的表达有抑制作用
讨 论
许多研究表明,CSC是肿瘤复发、转移及多药耐药的根源所在。目前,人们还没有在肝癌CSC中发现高特异性和敏感性的标志物,这对研究肝癌CSC的特性、功能及抗癌靶点的筛选都造成了很大程度上的困扰。近年来,学者们在肿瘤细胞群体中发现有极少的一部分细胞群可将进入细胞核的Hoechst33342荧光染料排出胞外,在荧光显微镜下观察或流式细胞仪检测时表现为不着色或者弱染,学者们称之为SP细胞。这群细胞具有CSC的许多特征,如很强的克隆形成能力和极高的致瘤率;绝大部分细胞处在G0期,可逃避杀伤DNA复制期细胞药物的作用;细胞膜上高表达ABCG2,能将化疗药物泵出,逃避化疗药物的损害等。因此,在缺乏特异敏感标志物的情况下,SP被认为是研究CSC的重要资源[7]。
近年来人们发现将常规化疗药物以小剂量、持续性的方式给药,具有理想的抗癌效果,更重要的是降低了化疗所带来的毒副反应,减低了化疗耐药性,提高了患者的生存质量[8]。然而短期持续小剂量的化疗方式仍存在着一定程度的化疗耐药,影响了化疗效果,最终还是不可避免的导致肿瘤的复发和转移。目前认为联合中草药治疗肿瘤患者,既能多靶点地抗肿瘤的生长,同时又能逆转化疗耐药,增强化疗敏感性,减轻化疗副作用,不失为一种有效的抑制肿瘤转移和复发的方式[9]。研究表明,有许多中药多靶点的作用于多个耐药相关蛋白达到逆转耐药的功效。如参麦注射液能通过部分下调细胞膜表面P-糖蛋白(P-gp)的表达,逆转白血病耐阿霉素细胞株K562/ADM的抗药性[10]。葛根素注射液能促使多药耐药蛋白(MRP)和P-gp蛋白表达水平的减少,逆转胃癌耐药细胞系SGC7901/VCR的多药耐药作用[11]。
本文研究发现,解毒消癥饮和小剂量5-FU均能明显抑制huh7细胞的增殖,将二者联合,细胞存活率明显较单用5-FU组下降,可见解毒消癥饮可增强小剂量5-FU的抗癌效果。当小剂量5-FU干预细胞24、96 h后,细胞存活率从(84.54±2.88)﹪下降到(31.23±2.42)﹪,细胞存活率下降了1倍,可是SP的比例也升高了近3倍。SP比例的显著增多表明随着化疗时间的延长,经5-FU干预后存活下来的细胞具有更强大的外排药物的能力。同时因为这些增多的SP细胞绝大多数处在细胞周期G0期,可逃避特异作用于S期的5-FU的杀伤,增加了其耐药的能力,小剂量5-FU虽然能够显著抑制huh7细胞的增殖,但其在化疗的早期,肝癌细胞就已经呈现出明显的化疗抵抗力,且随着时间的延长,化疗抵抗几率大大增加。而在有5-FU存在的培养体系中加入EE-JXY 干预24 h,SP比例明显降低,可见EE-JXY可以降低Huh7细胞对小剂量5-FU的化疗抵抗。
为进一步调查EE-JXY降低Huh7细胞化疗抵抗的原因,笔者考察了EE-JXY对Huh7化疗耐药后干细胞相关因子ABCG2、Oct4 mRNA的表达。ABCG2是ATP结合盒转运蛋白超家族的成员之一,具有ATP依赖性药物外排能力的小分子膜转运蛋白,仅表达于早期未分化的细胞表面,是一个通用的干细胞标志物[12]。SP之所以能够将化疗药物泵出细胞外,逃避化疗药物的损害,与其高表达ABCG2有密切相关。Oct4是一种转录调节因子,主要表达在胚胎干细胞和许多肿瘤细胞中,起着维持胚胎干细胞的自我更新和多向分化潜能的作用,随着细胞分化,表达逐渐下降或消失。过度表达的Oct4可调控其下游相关基因的表达,使细胞处于未分化状态,维持其自我更新的潜能,因此被认为是干细胞状态的主调节者,参与肿瘤的发生、发展[13]。有发现Oct4及ABCG2基因在肝癌干细胞中的高表达有可能与肝癌的耐药性密切相关[14]。本研究发现,经小剂量5-FU干预后,Huh7细胞中Oct4及ABCG2 mRNA表达上调,这可能是导致SP比例增多的原因之一,可见高表达的Oct4和ABCG2参与了肝癌的化疗耐药。而经EE-JXY干预后,Oct4与ABCG2 mRNA的表达水平显著下降,说明EE-JXY能通过降低小剂量5-FU诱导的高表达的Oct4与ABCG2 mRNA水平,降低SP细胞的比例,从而显著降低小剂量5-FU对肝癌Huh7细胞的化疗抵抗,这可能是解毒消癥饮降低化疗患者肿瘤复发和转移的原因之一。
1 马志方,许召良,岳亮,等.前列腺癌细胞系中干祖细胞的分选和鉴定[J/CD].中华细胞与干细胞杂志(电子版),2012,2(4):254-260.
2 朱贤鑫,孙星慧,谭建明.肾癌干细胞的研究现状[J/CD].中华细胞与干细胞杂志(电子版),2012,2(1):55-59.
3 刘俊,董维平.胰腺癌干细胞研究现状[J/CD].中华细胞与干细胞杂志(电子版),2011,1(2):196-199.
4 Chiba T,Kita K,ZhengYW,et al.Side Population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties [J].Hepatology,2006,44(1):240-251.
5 陈立武,林晶,陈文,等.中药治疗原发性肝癌III期围手术期患者42例[J].中国中西医结合杂志,2005,25(9):832-834.
6 曹治云,陈旭征,林瀛,等.中药复方对肝癌移植瘤小鼠肿瘤干细胞表面标志c-kit和CD133表达的影响[J].福建中医学院学报,2010,20(3):18-20.
7 Hu L,McArthur C,Jaffe RB.Ovarian cancer stem-like side-population cells are tumorigenic and chemoresistant[J].Br J cancer, 2010,102(8):1276-1283.
8 Huan S,Pazdur R,Singhakowinta A,et al.Low-dose continuous infusion 5- fluorouracil evaluation in advanced breast carcinoma [J].Cancer,1989,63(3):419-422.
9 柏茂树,伍治平,王熙才.肿瘤化疗辅助中药研究进展[J].现代肿瘤医学,2010,18(3):597-601.
10 谢勇,王建宾.参麦注射液对白血病细胞多药抗药性逆转作用的实验研究[J].大同医学专科学校学报,2005,25(2):3-5.
11 王利,魏品康,秦志丰,等.葛根素能够逆转裸鼠原位移植瘤的多药耐药性[J].成都中医药大学学报,2005,28(1):42-44.
12 Zhou S,Schuetz JD,Bunting KD,et al.The ABC transproter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the sidepopulation phenotype [J].Nat Med,2001,7(9):1028-1034.
13 黄灵,郜峰,张声.Oct4在肿瘤发生发展中的作用[J].国际病理科学与临床杂志,2013,33(1):78-81.
14 贾茜.肝癌干细胞筛选及Oct4、ABCG2对其耐药性影响的初步研究[D].重庆医科大学,2012.

