湘南地区烟稻轮作和不同年限烟薯套种对土壤微生物的影响
杨贤海,齐绍武,赵世浩,蒋奇晋
(湖南农业大学农学院,长沙410128)
土壤微生物是土壤生命活体的主要组成部分, 从最初定植于土壤母质上的蓝绿藻开始,直到土壤肥力的形成,土壤微生物参与了土壤发育的全过程[1]。微生物既是土壤有机质和养分转化与循环的动力,又是土壤中植物有效养分的储备库,是生物多样性与生态平衡的一个重要方面,土壤微生物的平衡发展也是预防植物病害发生的基础[2~4]。土壤中生活的微生物一方面反映了土壤中物质和能量代谢的旺盛程度,另一方面也反映了土壤的肥力状况。土壤微生物主要包括三大类群:细菌、真菌、放线菌,其活性直接影响土壤的生物化学活性及土壤的养分组成与转化,是土壤肥力的重要指标之一。本试验研究了烟稻轮作与不同年限烟薯套种对土壤微生物变化的影响,旨在为进一步解决湘南地区烟薯套种障碍提供理论依据。
1 材料与方法
1.1 试验方法
试验在湖南省江永县兰溪乡烟田进行。通过实地调查,分别取连续5年、10年、15年、18年烟薯套种以及在连续10年烟薯套种后与水稻进行烟稻轮作(CK)的5种不同轮作方式及轮作年限的土样,分别编号为 A、B、C、D、CK。
1.2 土壤采集[5]
于2012年7月6日用5点法采集烟株根际周围0~20 cm土层范围内的土样。将同一处理同一田块的采集土壤充分混匀。每个处理年限分别在3丘不同田块进行取样,用无菌自封袋包装好,带回实验室。将新鲜土壤研磨过2 mm筛,置于冰箱中4℃保存。
1.3 土壤微生物测定[6]
采用稀释平板计数法测定土壤微生物总数,细菌采用牛肉膏蛋白胨培养基,放线菌采用高氏1号培养基,真菌采用马丁氏(Martin)培养基培养,结果以每克干土所含数量表示。最终数据均为每种处理3丘田块土样的平均值。
1.4 土壤微生物量碳与微生物量氮的测定
土壤微生物量碳的测定采用重铬酸钾容量法,微生物量氮采用熏蒸提取——全氮测定法[4]。最终数据均为每种处理3丘田块土样的平均值。
2 结果与分析
2.1 烟稻轮作与不同年限烟薯套种对土壤中细菌数量的影响
已有研究结果表明,不同耕作方式下同种土壤中可培养细菌数量不同[7]。本研究选取湖南省江永县兰溪乡烟田不同年限烟薯套种和烟稻轮作土壤,进行稀释平板计数,并对结果进行统计分析(表1)。

表1 不同处理土样中可培养微生物数量
从表1中可以看出,不同种植方式及同一种植方式的不同年限种植条件下,其土壤中可培养细菌数量均不相同。其中烟稻轮作的土壤可培养细菌数量要多于烟薯套种土壤中可培养细菌的数量,且差异显著。在不同年限烟薯套种土壤中可培养细菌数量的变化趋势,为随着套种年限的延长其细菌数量先增加后减少,在连续套种10年的土壤中细菌含量最高,为9.95×104cfu/g。这也在一定程度上表明烟稻轮作可以改善烟田土壤细菌的生存环境,而烟薯套种则可使烟田土壤中细菌的生存环境发生一定程度的恶化。
2.2 烟稻轮作与不同年限烟薯套种对土壤中放线菌数量的影响
土壤中放线菌数量对于土壤代谢、调节至关重要。放线菌可产生抗生素和其它生物活性次生代谢产物。利用土壤放线菌活菌接种能够防治作物的青枯病[8]、马铃薯疮痂病[9]等。本研究选取了湖南省江永县兰溪乡烟田不同年限烟薯套种和烟稻轮作土壤,对土壤中可培养放线菌采用高氏1号平板计数,结果如表1。
从表1可以看出,不同年限烟薯套种与烟稻轮作的土壤中,可培养放线菌数量不同且均呈显著性差异。烟薯套种5年土壤中放线菌数量最低,为1.405×104cfu/g。随着套种年限的延长,土壤中放线菌的数量呈先增加后减少的趋势,在套种10年时最高,为2.393×104cfu/g。通过与水稻进行水旱轮作的耕作处理,土壤中的放线菌数量较烟薯套种10年有了显著性的增加。这表明烟稻轮作较烟薯套种能够在一定程度上改善烟田土壤中放线菌的生存环境,促进土壤中放线菌的繁殖。
2.3 烟稻轮作与不同年限烟薯套种对土壤中真菌数量的影响
土壤中某些特定微生物特别是植物病原真菌得到富集,不利于土壤中其它微生物群落的平衡,而有利于植物土传性病害的发生[10]。由于真菌数量的增加,土壤有真菌化的趋势,这是土壤地力衰竭的主要标志之一[11]。本研究选取湖南省江永县兰溪乡烟田不同年限烟薯套种和烟稻轮作土壤进行PDA平板计数,结果如表1。
从表1中可以看出,不同年限烟薯套种与烟稻轮作的土壤中可培养真菌数量不同且均呈显著性差异。在烟薯套种中随着套种年限的延长,土壤中可培养真菌的数量呈递增趋势,其中连续套种18年的土壤中真菌数量最大,为2.426×103cfu/g。通过与水稻轮作措施的实施,土壤中可培养真菌数量有了极显著的减少,其值为1.741×103cfu/g。这表明烟薯套种有造成土壤真菌化的趋势,而烟稻轮作能够在一定程度上抑制土壤真菌化。
2.4 烟稻轮作与不同年限烟薯套种对土壤中主要微生物类群变化的影响
由表2可以看出,不同年限烟薯套种与烟稻轮作的土壤中微生物组成和数量是不相同的,细菌在土壤可培养微生物总量中含量最高,为土壤可培养微生物的主要类群,放线菌次之,真菌所占比例最小。烟薯套种5年的土壤中真菌含量最高,约占微生物总量的3.04%,烟稻轮作的土样中真菌所占比例最小,约占微生物总量的1.28%。烟稻轮作处理下土壤中可培养微生物总量多于烟薯套种的处理方式。在不同年限烟薯套种中随着套种年限的延长,土壤中可培养微生物总量呈先增加后减少的趋势,在烟薯套种10年时土壤中可培养微生物总量最大,为12.53×104cfu/g。
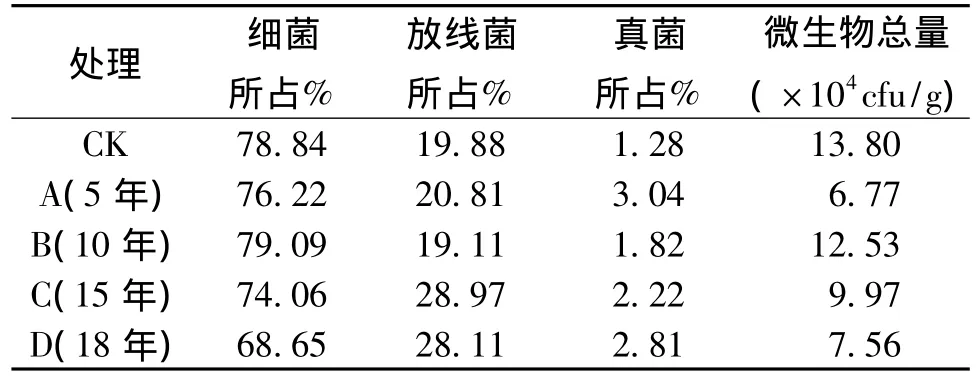
表2 土壤中主要微生物类群变化
2.5 烟稻轮作与不同年限烟薯套种对土壤中微生物量碳与微生物量氮的影响
土壤微生物生物量是土壤最活跃的成分,它与土壤资源可持续利用密切相关[12]。其大小可以表明微生物新陈代谢活动的强弱,而微生物生长与死亡的交替过程也就是养分的固定与释放过程[13]。近年来将土壤微生物生物量作为土壤健康的生物指标来评价退化生态系统的恢复进程和掌握生态系统管理等已逐渐成为研究热点[14,15]。本研究选取湖南省江永县兰溪乡烟田不同年限烟薯套种和烟稻轮作土壤进行微生物量碳与微生物量氮的测定,结果如表3。

表3 不同处理土样中微生物量碳和微生物量氮的变化
从表3可以看出,在不同处理下土壤的微生物量碳不相同且均呈显著性差异。其中微生物量碳在烟薯套种10年内呈递增趋势,10年以后呈逐年递减状态。在烟薯套种10年时其微生物量碳值达到最大,为95 mg/g。此时将种植方式改为烟稻轮作后,其土壤中微生物量碳有显著性的增加。
由表3可知,土壤中微生物量氮在烟薯套种的条件下,随着套种年限的延长呈先增加后减少的趋势,在烟薯套种10年时达到最大值,为0.048 μg/g。烟稻轮作相较烟薯套种明显使烟田土壤中微生物量氮的含量显著性增加。
3 小结与讨论
(1)本研究结果表明,同一生态烟叶种植区不同年限的烟薯套种和烟稻轮作对烟田土壤微生物数量有一定的影响。烟薯套种在10年内土壤中可培养细菌与放线菌数量均为递增趋势,10年以后则呈递减的变化趋势,但通过与水稻轮作,土壤中可培养微生物数量又明显增加。这表明烟稻轮作较烟薯套种能增加土壤中细菌与放线菌的生物学活性,丰富土壤中微生物的群落结构。在所有的处理中细菌和放线菌均为土壤中可培养微生物的主体。有研究表明,土壤中细菌和放线菌的数量与土壤中的养分含量呈正相关性[16]。因此由本研究可以推出,在湘南地区烟薯套种能够在一定程度上使土壤的营养状况发生一定程度的恶化,而烟稻轮作能在一定程度上阻止因长期烟薯套种带来的土壤肥力下降的趋势。
(2)通过本研究结果还可以得出,在烟薯套种中随着套种年限的延长,土壤中可培养真菌数量呈明显的递增状态。通过与水稻轮作,土壤中可培养真菌数量有了较为明显的减少。烟草黑胫病是一种真菌性病害,烟薯套种能够使土壤中真菌数量明显增加,而烟稻轮作能够在一定程度上抑制这种递增趋势,这表明水旱轮作较烟薯套种能够在一定程度上抑制烟草黑胫病等土传性真菌病害的流行。另外本研究还表明,烟稻轮作较烟薯套种能够降低土壤中真菌数量在微生物总量中的比例,进而有效的抑制了因烟薯套种造成的土壤真菌化的趋势,而土壤的真菌化正是土壤地力衰减的重要标志之一。因此由本研究可以推出,长期的烟薯套种能够造成土壤的肥力衰减,而烟稻轮作能在一定程度上抑制因烟薯套种造成的土壤肥力衰退,促进植烟土壤的可持续性利用。
(3)本研究结果表明,烟薯套种10年内土壤中微生物量碳与微生物量氮均呈递增趋势,在10年以后为逐年递减。烟稻轮作相较烟薯套种明显使土壤中微生物量碳与微生物量氮均增加。土壤微生物量C/N的大小可以表明微生物新陈代谢活动的强弱,微生物代谢活动的强弱又是土壤中物质循环能力大小的标志之一,土壤中物质循环能力的强弱又在一定程度上影响着土壤的可持续性利用。因此从本研究可以得出,湘南烟区烟稻轮作相较烟薯套种能在一定程度上促进植烟土壤的可持续性利用。烟稻轮作和烟薯套种对土壤中微生物量C/N的影响机理还有待于今后的进一步研究。
[1]张杨珠,谭周进.农业生产措施对土壤微生态系统的影响[M].长沙:湖南科学技术出版社,2011.17-20.
[2]Moony JH,Cushman E,Medina OE,et al.Functional Role of Biodiversity[M].John Wiley& Sons,Ltd,1996.
[3]王连君,谷思玉.烤烟连作对土壤养分的影响[J].烟草科技,2004,(9):40 -42.
[4]吴金水.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[5]姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006.5.
[6]贾新民,于泉林,郑玉龙,等.大豆连作土壤酶与土壤微生物指标的研究[J].中南林学院学报,1995,(10):31-32.
[7]李 斌,谢关林,陈若霞,等.耕作与栽培方式对瓜类土壤细菌数量及枯萎病拮抗细菌分布的影响[J].应用生态学报,2006,17(10):1937-1940.
[8]El-Abyard MS,El-Sayed MA,El-Shanshoury AR,et al.Towards the biological control of fungal and bacterial deseases of tomato using antagonistic Streptomyces spp.[J].Plant and Soil,1993,149:185 -195.
[9]刘大群,Neil A Anderson,Linda L Kinkel.拮抗链霉菌防治马铃薯疮痂病的大田试验研究[J].植物病理学报,2000,30(3):237-244.
[10]徐瑞富,任永信.连作花生田土壤微生物群落动态与减产因素分析[J].农业系统科学与综合研究,2003,19(1):33-38.
[11]封海胜,张恩苏,万书波,等.花生连作对土壤及根际微生物区系的影响[J].山东农业科学,1993,(1):13-151.
[12]封海胜,张恩苏,万书波,等.土壤微生物与连、轮作花生的相互效应研究[J].莱阳农学院学报,1995,12(2):97-101.
[13]王志明,朱培立,黄东迈,等.秸秆碳的田间原位分解和微生物量碳的周转特征[J].土壤学报,2003,40(3):446-453
[14]Schloter M,Dilly O,Munch JC.Indicators for evaluating soil quality [J].Agriculture,Ecosystems and Environment,2003,98:255 -262.
[15]Bossio DA,Fleck JA,Scow KM,et al.Alteration of soil microbial communities and water quality in restored wetlands[J].Soil Biology and Biochemistry,2006,38:1223-1233.
[16]杨 超,刘国顺,邱立友,等.不同植烟土壤微生物数量调查研究[J].中国烟草科学,2007,28(5):31 -36.

