电化学联用技术差分法研究二茂铁硫醇自组装膜氧化构型变化机制
付清丽,陈述,刘又年,向娟
(中南大学 化学化工学院,湖南 长沙,410083)
二茂铁硫醇自组装膜因其具有良好的稳定性和电化学活性而被广泛地应用于电化学修饰电极[1−2]、分子记忆装置[3]、新型电化学传感器[4−5]和生物电子器件[6]等。在电化学理论研究中,二茂铁硫醇自组装膜的单电子氧化还原过程可作为考察复杂电化学动力学的理想模型。研究二茂铁硫醇氧化还原过程电子转移和膜构型变化对应关系,可以为更深入研究电子转移相关的表面电化学反应、表面功能基团反应及分子设计提供理论指导。多年来,人们对二茂铁硫醇在金电极上的自组装单分子膜给予了极大关注。研究者们采用电化学方法[7−11]、红外反射吸收光谱(IRRAS)[12−13]、傅里叶变换红外吸收光谱[14]、椭圆偏振光谱[15]、电化学石英晶体微天平(EQCM)[12,16−21]、表面等离子体激元共振技术(SPR)[21−22]等多种技术和方法研究了二茂铁硫醇自组装膜的氧化还原机制。Chidsery等[7−8]和Creager等[9]通过电化学方法和石英晶体微天平,证实了二茂铁氧化生成的二茂铁阳离子(Fc+)与溶液中的阴离子形成“离子对”。Uosaki等[11−15]利用电化学方法和表面表征技术研究了二茂铁硫醇自组装膜在氧化还原诱导下还存在膜构型变化。Ye等[13]通过现场红外反射吸收光谱研究发现,二茂铁氧化为 Fc+阳离子,由于与带正电的金电极产生静电排斥作用,使烷基链远离金膜表面,烷基链与金膜的夹角增大,膜厚度增大;通过现场红外反射吸收光谱−石英晶体微天平联用技术研究发现:伴随着烷基链的偏转,溶剂分子会进入膜内,使膜内质量增加[12]。大量研究结果显示二茂铁硫醇构型变化存在的可能机制:(1) 烷基链远离电极表面,即烷基链与电极表面的夹角增大,膜厚度增大;(2) 二茂铁上的2个平行的Cp环绕着二茂铁−碳(Fc−C)轴发生旋转,由原来的与电极表面平行状态转变成与电极表面垂直。伴随着结构变化,自组装膜还存在显著的表面水化(氧化的二茂铁与溶液中的阴离子产生静电吸引而形成“离子对”)和膜内水化(水分子进入膜内)。最近, Yao等[21−22]用EQCM和EC-SPR技术研究表明上述2种机理同时存在,但是由于方法的限制,没有给出二茂铁硫醇氧化构型变化的详细机制及动力学分析。详细阐明自组装膜水化过程与构型变化的相互关系,对于深入理解二茂铁硫醇自组装膜的氧化还原机制和动力学过程具有重要意义。本文作者以 11-二茂铁基十一烷基-1-硫醇(FcC11SH)自组装膜为研究对象,采用EC-SPR和EQCM技术结合差分方法系统地研究二茂铁硫醇自组装膜氧化过程中的构型变化和水化过程,探讨FcC11SH自组装膜在氧化过程中的构型变化机制,为更深层次的分子设计和功能组装提供信息。
1 实验
1.1 试剂及材料
1.1.1 主要试剂
11-巯基十一羧酸(MUA)、11-二茂铁基十一烷基-1-硫醇(FcC11SH)、无水乙醇、二甲基亚砜(DMSO)、过氧化氢、高氯酸均为分析纯试剂,电解质水溶液均用二次去离子水配制。
1.1.2 金膜的制备
将 BK7载玻片在 80 ℃的 piranha溶液(V(30%H2O2):V(70% H2SO4)=3:1)中加热30 min;冷却后,用大量的二次去离子水冲洗,然后在体积比为V(H2O):V(NH4Cl):V(30% H2O2)=5:1:1的混合溶液中超声60 min,用二次去离子水冲洗后置于水中保存。镀膜前,玻片用氮气吹干,置于镀膜机(Cressington Model 108SE, Ted Pella, Inc., Redding, CA)样品台上,用真空溅射镀膜技术在载玻片上先后沉积2 nm铬和50 nm金。
1.1.3 FcC11SH自组装膜的制备
金膜在氢火焰下退火 2 min,然后浸入含 0.5 mmol/L FcC11SH/DMSO溶液,在室温下组装24 h后取出用大量的无水乙醇、二次去离子水冲洗,氮气吹干。QCM晶片用piranha溶液浸泡,清洗吹干后,按SPR金膜的相同步骤组装FcC11SH。
1.2 实验装置
EC-SPR是装置通过联用 BI1000 SPR系统和CHI440电化学工作站实现的。EC-SPR装置如图1所示。在SPR基底的棱镜安装聚四氟乙烯电化学池,电化学池的容积约为 1 000 μL,暴露的金膜面积约为0.453 cm2。组装分子的金膜既是SPR的基底, 又是电化学测试的工作电极。激光(635 nm)以一定的入射角入射到棱镜与金属的界面处发生全反射,产生消失波。在一定的条件下,消失波与表面等离子体激元发生共振,光能量被金属内的自由电子吸收,反射光达到最小值,反射光斑中出现黑线,对应于SPR共振角的最低点。然后通过光电检测器检测反射光强度,记录SPR共振角偏移曲线。实验中,待基线达到平衡后,通过电化学工作站施加电位,SPR仪同步记录SPR信号和电化学信号。SPR仪所记录的是SPR共振角随时间的变化曲线,然后转化为SPR共振角随扫描电位的变化曲线。
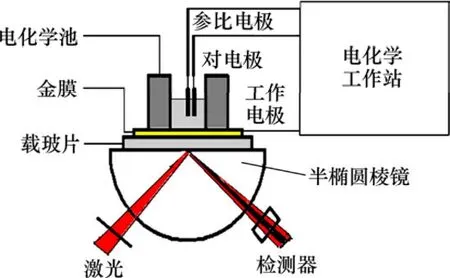
图1 EC-SPR联用装置图Fig.1 Schematic representation of EC-SPR apparatus
EQCM装置使用CHI440电化学工作站,石英晶振片为AT-cut切面,直径为5 mm,基频为9.995 MHz。EQCM电解池和振荡器线路盒置于法拉第箱中屏蔽。以分子修饰的石英晶片作为工作电极。EQCM 与EC-SPR采用相同的三电极体系,除金膜、晶振作为工作电极外,Ag/AgCl电极和铂丝分别作为参比电极和辅助电极。
2 结果与讨论
二茂铁硫醇分子通过 Au-S化学键稳定地固定在金膜的表面,分子成反式构象伸展形成高度有序、稳定性较好的二维结构。组装分子的金膜为工作电极,金电极的零电荷电位约在−0.4 V(vs Ag/AgCl),发生氧化反应时,末端的二茂铁氧化范围在 0~0.7 V(vs Ag/AgCl)。因此,相对金电极的零电荷电位,金电极表面带正电荷。Fc氧化为Fc+时,Fc+离子与带正电荷的金电极表面发生静电排斥作用,迫使 Fc+远离电极表面,从而使FcC11SH的烷基链与电极表面的夹角增大,膜厚度增加。同时,相邻的 Fc+之间也会产生静电排斥力,使二茂铁上2个平行的Cp环围绕Fc−C轴发生旋转,由原来的与电极表面平行状态转化为与电极垂直状态。此为前面提到二茂铁硫醇氧化时2种可能的构型变化机制[21],如图2所示。此外,膜内和膜外也会伴随物质的变化。一方面由于烷基链的与电极表面的夹角增大,烷基链之间形成的空腔也增大,溶剂分子更容易进入烷基链内;另一方面,Fc+与溶液中的阴离子由于静电吸引而形成离子对。QCM技术和其他联用技术已经证实了膜内和膜上的表面水化现象,并证实了表面水化程度与二茂铁硫醇的组装量密切相关。但是,关于自组装膜构型的变化和水化过程的详细机制没有阐述清楚。
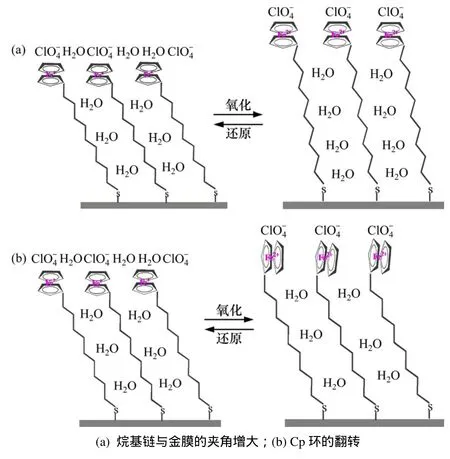
图2 FcC11SH自组装膜氧化过程构型变化的2种可能的机理Fig.2 Two possible mechanisms concerns conformational change of 11-ferrocenylundecanethiol SAMs accompanying with Fc oxidation
图 3所示为 MUA和 FcC11SH自组装膜在 0.1 mol/L HClO4溶液中的线性伏安曲线以及相应的 SPR共振角和QCM共振频率随电位变化曲线,其中MUA数据为背景信号,扫速为50 mV/s。从图3可以看出:MUA在0~0.7 V中没有明显的氧化电流以及SPR共振角和QCM共振频率偏移,因此可以确认FcC11SH线性伏安图中的氧化峰和对应的SPR和QCM响应是由Fc基团氧化引发的。线性伏安曲线上(图3(a)),0.4 V左右的峰为Fc/Fc+氧化特征峰。通过氧化峰积分计算,可得FcC11SH在金膜表面的覆盖度约为4.7×10−10mol/cm2,略大于文献[7−8]所报道的覆盖率 4.5×10-10mol/cm2。这表明FcC11SH分子在金膜表面可形成致密稳定的自组装单分子膜。从0 V正向电位扫描至0.2 V,Fc开始氧化,相应的SPR共振角Δθ和QCM共振频率Δf开始明显负移。FcC11SH氧化引起SPR共振角总偏移Δθ达到−0.021°,QCM共振频率变化Δf达−42.5 Hz。
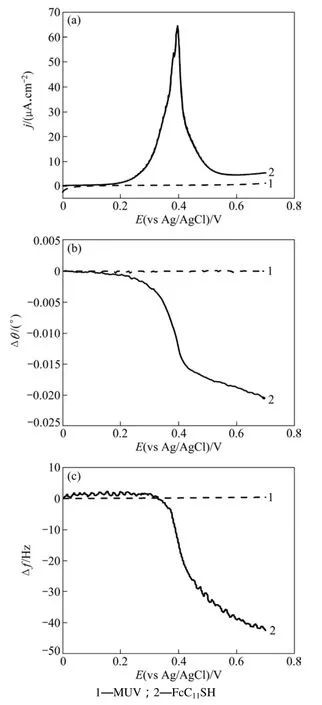
图3 金膜表面MUA和FcC11SH自组装膜0.1 mol/L HClO4溶液中的线性伏安曲线(a)及相应的SPR共振角Δθ(b)和QCM共振频率Δf(c)随扫描电位的变化(电位扫描速率为50 mV/s)Fig.3 Linear sweep voltammograms (a) of MUA SAMs and FcC11SH SAMs in 0.1 mol/L HClO4 and corresponding SPR dip shift-potential (b) and frequency-potential diagrams (c)(Scan rate is 50 mV/s)
SPR共振角的大小是 FcC11SH 自组装膜的膜厚度变化和物质折射率变化共同作用的结果。根据Lorentz-Lorenz公式和 Fresnel方程,由实验所得 Δθ可计算出 FcC11SH氧化引起的膜厚度变化约为 0.08 nm。理论计算FcC11SH烷基链倾斜角变小可引起最大0.3 nm 的膜厚度变化[14−15],而 Cp环翻转可以引起0.059 nm的膜厚度变化[14]。因此可以认为,FcC11SH的氧化必然同时引发烷基链倾斜角的变化和 Cp环的旋转。这一结论与Yao等[21−22]采用EC-SPR技术获得的研究结果一致。QCM共振频率的变化反应了电极界面的质量变化。由Δf可计算出FcC11SH氧化伴随着表面质量的增加为196 g/mol,这远大于FcC11SH膜上形成“离子对”引起的理论质量增加(100 g/mol)。这一结果表明FcC11SH的氧化伴随着溶剂分子进入膜内。Yao等[21]也用EQCM和EC-SPR技术证实了溶剂分子在自组装膜内外的物质传递,但是这一过程与构型变化的相关性仍缺乏有效的动力学分析。
由于“离子对”的形成对 SPR共振角的影响非常小[21],所以 SPR共振角的变化由烷基链的偏移、Cp环的翻转和溶剂分子进入膜内3种因素共同作用的结果。但是,仅从图3无法将这3个过程区分开来。为了清楚地研究这3个过程的关系,将得到的SPR信号Δθ和共振频率信号Δf 对时间进行差分法处理,即将所得的 Δθ和 Δf 对时间做一阶求导,得到dΔθ/dt和dΔf/dt,把对应的时间转换为电压,然后与线性伏安法图联系起来。通过分析不同电位扫描速率下,差分峰电位和电流峰电位的关系,可建立自组装膜水化过程与构型变化的相互关联,进一步完善二茂铁硫醇自组装膜的氧化机制和动力学过程。
图4所示为不同电位扫描速度下FcC11SH自组装膜在0.1 mol/L HClO4溶液中的线性伏安曲线和对应的QCM差分随电位变化曲线(dΔf/dt−E)。由图4可见:无论是快扫描速率还是慢扫描速率,频率变化速率dΔf/dt与氧化电流完全同步。QCM频率变化反应了电极表面物质质量的变化。在FcC11SH自组装膜的氧化过程中,只有膜的水化过程(包括膜表面形成离子对和水分子进入膜内)才能引起电极表面质量变化。因此这一同步现象说明:相对Fc的氧化,FcC11SH自组装膜的水化过程是一个快步骤。整个氧化过程中的质量变化受Fc的氧化速度控制。此外,由于水分子进入膜内的前提条件是烷基链远离电极表面从而提供更大的分子间空腔[21],因此,可以推断:氧化引发的烷基链偏移也是一个快速步骤。
图5所示为不同电位扫描速度下FcC11SH自组装膜在 0.1 mol/L HClO4溶液中的线性伏安曲线和对应的SPR差分随电位的变化曲线(dΔθ/dt−E)。在慢扫描速率下,FcC11SH的SPR变化速率dΔθ/dt同步于氧化电流。这说明伴随着Fc的慢速氧化,自组装膜的构型变化同步发生。然而,在500 mV/s(图5(b))的快电位扫描速率下,FcC11SH的dΔθ/dt显著滞后于氧化电流。Yao等[21]已经证明,自组装膜表面形成“离子对”对SPR共振角的影响非常小。因此,SPR共振角的变化主要由烷基链的偏移、Cp环的翻转和溶剂分子进入膜内引起的。QCM结果已经证实烷基链的偏移和溶剂分子进入膜内是快速步骤,因此,只有 Cp环的翻转是一个滞后于Fc氧化的慢速步骤。
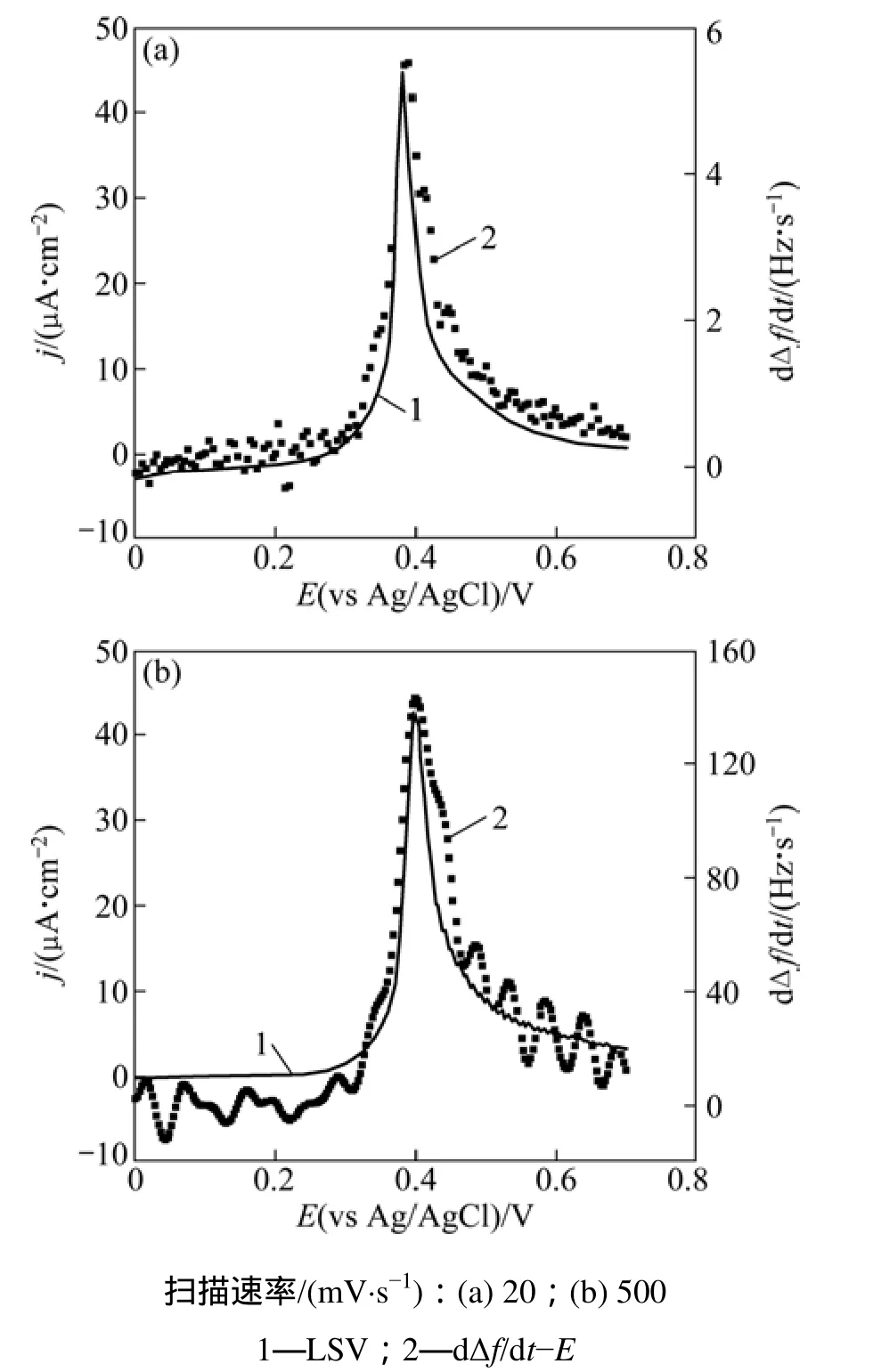
图4 金膜表面FcC11SH自组装膜在0.1 mol/L HClO4溶液中的线性伏安曲线和对应的QCM共振频率差分曲线Fig.4 Linear sweep voltammograms and corresponding differential frequency responses dΔf/dt of FcC11SH SAMs in 0.1 mol/L HClO4

图5 金膜表面FcC11SH自组装膜在0.1 mol/L HClO4溶液中的线性伏安曲线和相对应的SPR共振角差分曲线Fig.5 Linear sweep voltammograms and corresponding differential SPR responses dΔθ/dt of FcC11SH SAMs in 0.1 mol/L HClO4
3 结论
采用EC-SPR和EQCM技术结合差分方法研究了FcC11SH自组装膜氧化过程的构型变化机制。EC-SPR和EQCM结果可以证实FcC11SH自组装膜氧化还原过程中存在 2种构型变化:烷基链远离电极表面和 Cp环的翻转。同时,伴随着结构变化,自组装膜还存在显著的质量变化包括表面水化(氧化的二茂铁与溶液中的阴离子产生静电吸附而形成“离子对”)和膜内水化(水分子进入膜内)。通过比较不同电位扫描速率下dΔθ/dt−E和dΔf/dt−E峰电位与线性伏安图氧化峰电流的位置关系,可以确定:二茂铁硫醇氧化过程中,烷基链远离电极表面是个快速步骤,Cp环的围绕烷基链的翻转是个慢速步骤。伴随构型变化的自组装膜水化过程,无论是膜表面水化还是膜内水化,都是快速步骤。
[1]Napper A M, Liu H, Waldeck D H.The nature of electronic coupling between ferrocene and gold through alkanethiolate monolayers on electrodes: The importance of chain composition,interchain coupling, and quantum interference[J].The Journal of Physical Chemistry B, 2001, 105(32): 7699−7707.
[2]Sato Y, Yabuki S, Mizutani F.Electrochemiluminescence of luminol generated at self-assembled monolayer of ferrocenylalkanethiol on gold electrode[J].Chemistry Letters,2000, 29(11): 1330−1331.
[3]Yu J, Shapter J G, Johnston M R, et al.Electron-transfer characteristics of ferrocene attached to single-walled carbon nanotubes (SWCNT) arrays directly anchored to silicon (100)[J].Electrochimica Acta, 2007, 52(21): 6206−6211.
[4]Hickman J J, Ofer D, Laibinis P E, et al.Molecular self-assembly of two-terminal, voltammetric microsensors with internal references[J].Science, 1991, 252: 688−691.
[5]Peng Y, Jiang D, Su L, et al.Mixed monolayers of ferrocenylalkanethiol and encapsulated horseradish peroxidase for sensitive and durable electrochemical detection of hydrogen peroxide[J].Analytical chemistry, 2009, 81(24): 9985−9992.
[6]Willner I, Katz E.Integration of layered redox proteins and conductive supports for bioelectronic applications[J].Angewandte Chemie International Edition, 2000, 39(7):1180−1218.
[7]Chidsey C E D, Bertozzi C R, Putvinski T M, et al.Coadsorption of ferrocene-terminated and unsubstituted alkanethiols on gold:Electroactive self-assembled monolayers[J].Journal of the American Chemical Society, 1990, 112(11): 4301−4306.
[8]Chidsey C E D, Loiacono D N.Chemical functionality in self-assembled monolayers: Structural and electrochemical properties[J].Langmuir, 1990, 6(3): 682−691.
[9]Creager S E, Rowe G K.Redox properties of ferrocenylalkane thiols coadsorbed with linear n-alkanethiols on polycrystalline bulk gold electrodes[J].Analytica Chimica Acta, 1991, 246(1):233−239.
[10]de Long H C, Donohue J J, Buttry D A.Ionic interactions in electroactive self-assembled monolayers of ferrocene species[J].Langmuir, 1991, 7(10): 2196−2202.
[11]Uosaki K, Sato Y, Kita H.Electrochemical characteristics of a gold electrode modified with a self-assembled monolayer of ferrocenylalkanethiols[J].Langmuir, 1991, 7(7): 1510−1514.
[12]Ye S, Haba T, Sato Y, et al.Coverage dependent behavior of redox reaction induced structure change and mass transport at an 11-ferrocenyl-1-undecanethiol self-assembled monolayer on a gold electrode studied by an in situ IRRAS-EQCM combined system[J].Physical Chemistry Chemical Physics, 1999, 1(15):3653−3659.
[13]Ye S, Sato Y, Uosaki K.Redox-induced orientation change of a self-assembled monolayer of 11-ferrocenyl-1-undecanethiol on a gold electrode studied by in situ FT-IRRAS[J].Langmuir, 1997,13(12): 3157−3161.
[14]Viana A, Jones A, Abrantes L, et al.Redox induced orientational changes in a series of short chain ferrocenyl alkyl thiols self-assembled on gold (111) electrodes[J].Journal of Electroanalytical Chemistry, 2001, 500(1/2): 290−298.
[15]Ohtsuka T, Sato Y, Uosaki K.Dynamic ellipsometry of a self-assembled monolayer of a ferrocenylalkanethiol during oxidation-reduction cycles[J].Langmuir, 1994, 10(10):3658−3662.
[16]Damos F S, Luz R, Kubota L T.Study of poly (methylene blue)ultrathin films and its properties by electrochemical surface plasmon resonance[J].Journal of Electroanalytical Chemistry,2005, 581(2): 231−240.
[17]Sato Y, Mizutani F, Shimazu K, et al.Mass transport accompanied with electron transfer between the gold electrode modified with 11-ferrocenylundecanethiol monolayer and redox species in solution--an electrochemical quartz crystal microbalance study[J].Journal of Electroanalytical Chemistry,1997, 434(1/2): 115−119.
[18]Sato Y, Mizutani F, Shimazu K, et al.Mass transport accompanied with electron transfer between the gold electrode modified with 11-ferrocenylundecanethiol monolayer and redox species in solution-an electrochemical quartz crystal microbalance study[J].Journal of Electroanalytical Chemistry,1999, 474(1): 94−99.
[19]Shimazu K, Yagi I, Sato Y, et al.In situ and dynamic monitoring of the self-assembling and redox processes of a ferrocenylundecanethiol monolayer by electrochemical quartz crystal microbalance[J].Langmuir, 1992, 8(5): 1385−1387.
[20]Shimazu K, Yagi I, Sato Y, et al.Electrochemical quartz crystal microbalance studies of self-assembled monolayers of 11-ferrocenyl-1-undecanethiol: Structure-dependent ion-pairing and solvent uptake[J].Journal of Electroanalytical Chemistry,1994, 372(1/2): 117−124.
[21]Yao X, Wang J X, Zhou F M, et al.Quantification of redox-induced thickness changes of 11-ferrocenylundecanethiol self-assembled monolayers by electrochemical surface plasmon resonance[J].Journal of Physical Chemistry B, 2004, 108(22):7206−7212.
[22]Yao X, Yang M, Wang Y, et al.Study of the ferrocenylalkanethiol self-assembled monolayers by electrochemical surface plasmon resonance[J].Sensors and Actuators B: Chemical, 2007, 122(2): 351−356.

