COX-2基因在宫颈癌组织中表达的临床研究
李 硕,梅晶晶
(皖南医学院附属弋矶山医院 1.妇产科;2.病理科,安徽 芜湖 241001)
宫颈癌早期就可发生淋巴结转移,淋巴结转移是评估预后的一个独立因素,是决定术后是否放化疗的指标之一,但对淋巴结转移的术前评估,目前还没有特别有效的方法。近年来研究表明,COX-2除在炎症反应中起重要作用外,尚与肿瘤密切相关,它可通过刺激肿瘤细胞增殖和生长、抑制细胞凋亡、促进肿瘤血管形成、增加细胞侵袭力、抑制机体免疫功能、促进癌前病变向肿瘤转化等肿瘤的形成[1],因此在许多肿瘤组织呈COX-2高表达[2]。本研究应用免疫组织化学技术测定宫颈癌组织标本中COX-2蛋白表达水平,探讨其在宫颈癌中的表达规律,评价COX-2基因是否能成为宫颈癌术前预测盆腔淋巴结转移及预后评估的一个指标。
1 资料与方法
1.1 病例选择 均选自2009年1月~2010年12月在皖南医学院附属弋矶山医院妇产科经术前活检和(或)术后石蜡切片病理证实的宫颈癌患者组织标本。所有患者取标本前均未接受化疗或放疗,既往无其他恶性肿瘤史。正常宫颈标本均取自于该院同期因子宫肌瘤行子宫全切的正常宫颈组织(经术后病理证实)。
1.2 一般资料 患者年龄32~70岁。正常宫颈标本20例,宫颈鳞癌标本55例(其中10例宫颈标本为宫颈活检标本)。病理分级:G1(高分化)19例、G2(中分化)21例、G3(低分化)15例。按FIGO临床分期,Ⅰ期20例,Ⅱ期27例,Ⅲ期8例。
1.3 标本处理 避开坏死组织,尽量在宫颈的转化区取新鲜组织1份,生理盐水冲洗血迹后,浸入10%甲醛固定,石蜡包埋,4 μm厚度连续切片,用于免疫组化染色。
1.4 试剂和检测方法 浓缩型兔抗人多克隆COX-2抗体购自博士德生物有限公司,DAB显色,苏木精复染细胞核,按SABC法试剂盒说明操作。用PBS液代替一抗作为阴性对照。
1.5 结果判定 采用两人双盲法观察切片,用半定量积分方法判断结果。COX-2蛋白阳性定位于细胞浆(见图1、2),为棕黄色颗粒,阳性细胞≤5%为0分,6% ~25% 为 1分(+),26% ~50% 为 2分(),50%以上为3分()。
1.6 统计学方法 采用SPSS 12.0统计软件。计数资料比较用 χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 COX-2表达的分布及强度 55例癌组织中,COX-2蛋白阳性28例,阳性率为50.9%,其中(+)5例,()13例,)10例,对照组宫颈组织中未见COX-2阳性表达。
2.2 COX-2基因的表达与肿瘤病理分级的关系COX-2与肿瘤的分级有着密切的关系,在病理分级Ⅰ和Ⅱ级的阳性表达率分别为26.3%和47.6%,在Ⅲ级中其阳性表达率为86.7%。趋势χ2=11.739,P<0.05,差异有统计学意义,表明肿瘤病理分级越高,细胞分化程度越低,COX-2表达的阳性率越高,见表1。

表1 表达COX-2与肿瘤分级之间的关系Tab 1 COX-2 expression and grading of the carcinoma
2.3 COX-2基因与子宫颈癌临床分期和肿瘤淋巴结转移之间的关系 见表2。

表2 COX-2表达与子宫颈癌临床分期和肿瘤淋巴结转移之间的关系Tab 2 COX-2 expression and clinical stage of cervical carcinoma
2.4 COX-2基因与子宫颈癌肿瘤淋巴结转移之间的关系 见表3。

表3 COX-2基因与子宫颈癌肿瘤淋巴结转移之间的关系Tab 3 COX-2 expression and local lymph node metastasis in cervix carcinoma
3 讨论
子宫颈癌是妇科最常见的恶性肿瘤,过早性生活、性生活紊乱、HPV感染等因素导致宫颈癌发病逐渐趋于年轻化,且发病率有逐年上升的趋势,严重威胁着广大妇女的健康及生命。如何早期将具有潜在转移危险的患者筛选出来,给予积极治疗,是目前急需解决的问题之一。
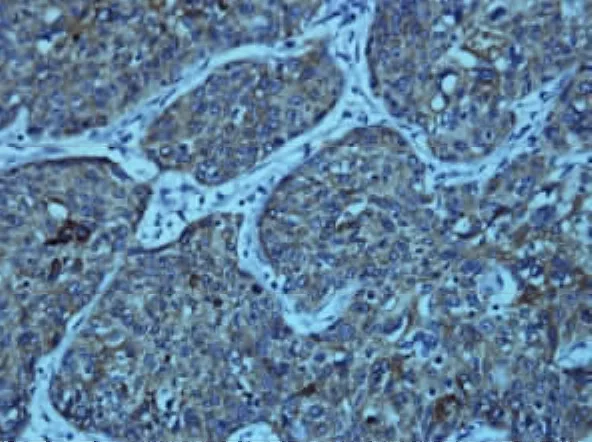
图1 Ⅱ期宫颈癌组织中COX-2蛋白的表达(SABC×400)Fig 1 Clinical stageⅡ:The expression of COX-2 protein in cervical cancer tissues(SABC×400)
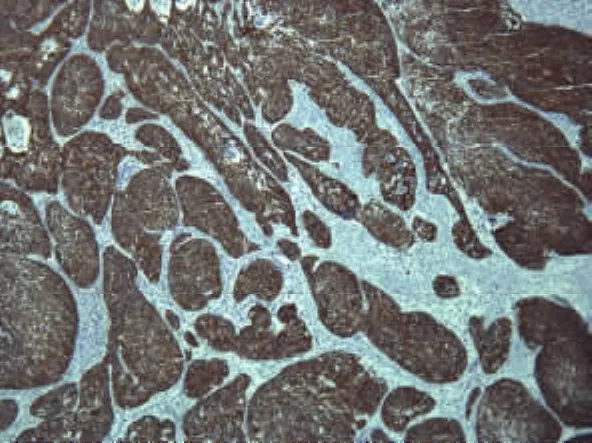
图2 Ⅲ期宫颈癌组织中COX-2蛋白的表达(SABC×400)Fig 2 Clinical stageⅢ:The expression of COX-2 protein in cervical cancer tissues(SABC×400)
环氧化酶(cyclooxy-genase,COX)又称前列腺素内过氧化物酶,是前列腺素合成过程中一个主要的限速酶。COX是膜结合蛋白,存在于核膜和微粒体膜,它有两种同工酶,即结构型 COX-1和诱生型COX-2[3]。COX-2 基因长 8.3 kb,位于染色体 1q 25.2~25.3,其编码604个氨基酸。在正常生理状态下,绝大多数正常组织中检测不到COX-2表达,它是一种诱导性即刻反应基因,只有当细胞受到刺激才能迅速诱导表达COX-2[4]。己有多种研究表明,COX-2的过高表达与肿瘤的发生密切相关。在多种肿瘤和细胞系中均发现了COX-2表达升高。由于COX-2高表达在癌前病变、原位癌时即已存在,且与正常组织相比,其表达有显著差异,所以一般认为COX-2高表达是癌症发生的早期事件,这也为COX-2抑制剂化学预防肿瘤提供了理论依据[5]。国内外研究表明,COX-2抑制剂有预防卵巢癌的发生、抑制卵巢癌细胞生长的作用[6]。
本研究显示:宫颈癌中COX-2表达的阳性率为50.9%,而G3期子宫颈癌中COX-2蛋白的阳性表达率为86.7%,高于 G1、G2的 47.6%和 86.7%。在临床分期病变中,Ⅰ~Ⅱ期的COX-2的阳性率为42.6%,Ⅲ期为100%;无淋巴结转移的COX-2蛋白的阳性率为38.6%,有淋巴结转移的COX-2蛋白的阳性率为100%。以上每两组比较差异均有显著性(P<0.05)。因此表明随着子宫颈癌癌细胞分化程度降低、临床分期增高和淋巴结转移,COX-2蛋白的阳性率愈来愈高,说明COX-2与子宫颈癌的生物学行为关系密切,可能是子宫颈癌预后的标记物之一。
近年研究表明,诱生型COX-2在多种恶性肿瘤中高表达,可促进细胞增殖、抑制肿瘤细胞凋亡、促进肿瘤新生血管形成、抑制机体免疫反应、增加转移潜能、抑制DNA修复,也可能是联系炎症与癌变的重要因素之一[7-8]。就 COX-2基因而言,在各种致癌刺激物作用下,由相对静止状态转到激活状态,直到产生过量的基因产物,最终导致肿瘤的发生、发展,在这一过程中,除转录水平调控产生过多的COX-2 mRNA外,是否存在DNA及染色体水平的调控,如基因扩增、去甲基化、基因重排等,还有待进一步研究证实。
[1]CAO Y,PRESCOTT S M.Many actions of cyclooxygenase-2 in cellular dynamics and in cancer[J].J Cell Physiol,2002,190(3):279-286.
[2]LUO WEI-REN,CHEN XIAO-YI.Research advance of the relationship between cyclooxygenase-2 and tumor[J].Cancer Research on Prevention and Treatment,2006,33(1):62 -64.
[3]VANE JR,BAKHLE YS,BOTTING RM.Cyclooxygenase 1 and 2[J].Annu Rev Pharmacol Toxicol,1998,38(5):97 -120.
[4]SANO H,KAWAHITO Y,WILDER R L,et al.Expression of cyclooxygenase-1 and-2 in human colorectal cancer[J].Cancer Res,1995,55(12):3785 -3789.
[5]MASFERRER J L,LEAHY K M,KOKI A T,et al.Antiangeogenic and Antitumor Activities of Cyclooxygenase-2 Inhibitors[J].Cancer Res,2000,60(5):1306 -1311.
[6]ROSENBERG L,PALMER J R,RAO R S,et al A Case-control Study of Analgesic Use and Ovarian Cancer[J].Cancer Epidemiol Biomarkers Prey,2000,9:933 -937.
[7]SOO R,PUTTI T,TAO Q,et al.Overexpression of cyclooxygenase in nasopharyngeal carcinoma and association with epidermal growth factor receptor expression[J].Arch Otolaryngol Head Neck Surg,2005,131(2):147 -152。
[8]DURSUN P,YUCE K,USNBUTUN A,et al.Cyelooxygenase-2 expression in cervical intraepithelial neoplasia III and squamous cell cervical carcinoma,and its correlation with clinieopathologic variables[J].Int J Gyneco Cancer,2007,17(1):164 -173.

