紫外线法对压载水中淡水藻的灭活效果
刘 澈
(1.清华大学 环境学院,北京100084;2.中国电子工程设计院,北京100840)
紫外线技术用于灭活藻类开始于20世纪90年代.1993 年研究者将紫外线用于灭活二角多甲藻[1-2],随后又 用 于 卡 盾 藻[3].我国学者也 陆 续 研 究了紫外线对铜绿微囊藻[4]、念珠藻[5]、水厂源水中的淡水藻类[6]的灭活效果,报道了紫外线辐照光催化TiO2氧化法灭活鱼腥藻[7]、H2O2与紫外线联合灭活鱼腥藻的效果[8].2001年,国际上首次报道了紫外线对铜绿微囊藻的生长抑制效果[9].2007年,Sakai等人研究了紫外线对铜绿微囊藻、多变鱼腥藻的生长抑制效果[10]和对微囊藻毒素释放的影响[11],建立数学模型,并进一步分析了紫外线对微囊藻毒素释放的影响[12].
压载水生物入侵是海洋的四大危害之一[13],国际海事组织环境保护委员会专门成立了压载水工作组并制定了《船舶压载水和沉积物控制和管理国际公约》,规定了严格的D-2 排放标准,该草案于2012年开始强制执行.由于紫外线辐射对微生物灭活的高效,不产生消毒副产物,国际上多采用过滤和紫外线辐射的组合工艺处理压载水.国内外对紫外线处理压载水中藻类灭活效果的研究报道比较少.本文依照《公约》对岸基测试试验的要求,采用准平行光束仪对8种常见的淡水藻进行紫外线辐射,黑暗环境培养5d,确定剂量反应关系,研究紫外线对它们的灭活效果及特点.
1 材料与方法
1.1 藻种及来源
试验选用4个门的8种淡水藻.硅藻门:梅尼小环藻(CyclotellameneghinianaKutz,中科院淡水藻种库(FACHB)编号为739)、谷皮菱形藻(Nitzschia palea.,FACHB 编 号 为 209)和钝脆杆藻(Fragilariacapucina,FACHB编号为1062).绿藻门:小 球 衣 藻(Chlamydomonasmicrosphaera,FACHB编号为54)、镰形纤维藻(Ankistrodesmus falcatus,FACHB 编号为18)和斜生栅藻(Scenedesmusobliquus,FACHB编号为417).蓝藻门:铜绿微囊藻(Microcystissp.,FACHB 编号为1018).隐藻门:卵形隐藻(CryptomonasovataHer,FACHB编号为472).藻种由中国科学院典型培养物保藏委员会淡水藻种库提供.
1.2 培养方法和条件
藻种培养液采用蒸馏水配制.不同藻种的培养液采用配方如下:梅尼小环藻119,谷皮菱形藻和钝脆杆藻D1,小球衣藻、镰形纤维藻和斜生栅藻SE,铜绿微囊藻BG11,卵形隐藻WC.培养液的配制、藻液的接种和培养均是在无菌条件下进行.为了保证藻液的纯度,每天用显微镜观察1次.
藻液置于人工气候箱三角瓶内培养,光照和光暗培养温度(22±0.5)°C,光照强度2 500lx,光暗周期14h∶10h.培养过程中每天用手摇动藻液6次.
藻液经紫外线辐射后,静置于生物培养箱黑暗培养,培养温度(22±0.5)°C.
藻种在指数生长期接种.选择生长良好的处于稳定生长期的藻液进行试验.试验时藻液浓度约为107~108个·L-1.
1.3 试验装置
试验所采用的准平行光束仪(北京安利斯科技发展有限公司)是按照国际紫外线协会的标准设计.选用低压汞灯作为光源,紫外线灯管安装在一个封闭的圆柱体内,在筒体的底部中央开口,下方接一段长度可以调节的内径为9.3cm 的圆管,使紫外线能够垂直到达样品的表面[14].紫外线灯管的功率为105 W,其中输出254nm 波长紫外线的功率为35 W,通过改变筒体的长度,调节到达微生物的不同紫外线强度.
1.4 紫外线辐射处理
取15mL藻液,倒入Φ70mm 培养皿中,置于电磁搅拌器上搅拌,分别经准平行光束仪100,200,300和400mJ·cm-2的紫外线剂量辐射后立即倒入棕色瓶中,静置于生物培养箱黑暗培养.试验采用紫外线强度为0.5~0.6mW·cm-2.紫外线强度用UVB型紫外线辐照计(北京师范大学科学仪器厂)测定.
紫外线剂量计算公式为

式中:D为紫外线剂量,mJ·cm-2;I为平均紫外线强度,mW·cm-2,根据国际紫外线协会提供的计算表格计算;t为辐射时间,s.
1.5 藻细胞灭活率计算
紫外线辐射藻液后黑暗环境培养5d,取1mL,用Lugol碘液固定,显微镜下血球计数板计数并计算藻细胞密度.每个样品计数3次.以未经紫外线辐射的藻液作为空白对照样,置于生物培养箱黑暗培养.
经紫外线辐射后的藻细胞会变形、破裂、内容物溢出,试验中无细胞壁或无内容物的藻细胞被认为是灭活.藻细胞灭活率计算公式为
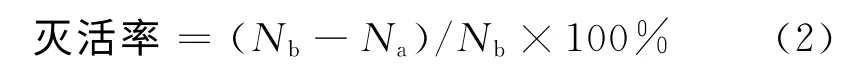
式中:Nb为辐射前藻细胞个数;Na为辐射后黑暗培养5d的藻细胞个数.
黑暗时藻细胞不能进行光合作用,会影响藻细胞的生长,黑暗对藻细胞的抑制率计算公式为
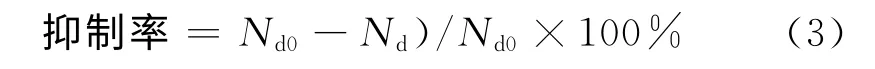
式中:Nd0为黑暗培养前藻细胞个数;Nd为黑暗培养5d后藻细胞个数.
2 结果和讨论
2.1 紫外线法对3种硅藻的灭活效果
由图1可以看出,紫外线法对3 种硅藻的灭活效果表现出显著的差异性.
梅尼小环藻在黑暗环境培养5d后藻细胞数量减少了38.8%,黑暗对藻细胞有一定的抑制作用,藻细胞需要光合作用才能生长,失去光合作用有一些藻细胞死亡.梅尼小环藻经紫外线辐射黑暗环境培养5d后,藻细胞全部沉积在血球计数板上,随着紫外线剂量的增加,藻细胞的内容物中出现了更多深褐色的凝块,细胞内容物不完整的数量也增多,更多的藻细胞内容物已经完全消失只剩下细胞壁.梅尼小环藻对紫外线和黑暗环境的共同作用比较敏感,灭活率随着剂量的增加而快速提高,在剂量为100 mJ·cm-2时的灭活率为48.1%.随着剂量继续增加,藻细胞对剂量的变化不再敏感,灭活率增加非常缓慢,在剂量为200,300和400mJ·cm-2时的灭活率分别为50.4%,51.4%和54.3%.紫外线法对梅尼小环藻具有较好的灭活效果.

图1 紫外线法对3种硅藻的灭活效果Fig.1 The inactivation effect of UC-V on three species of Bacillariophyta
钝脆杆藻在黑暗环境培养5d后藻细胞数量增加了32.5%,藻细胞对黑暗表现出很强的忍耐能力,失去光合作用仍有一些藻细胞能生长繁殖.钝脆杆藻经紫外线辐射黑暗环境培养5d后,有少量的藻细胞沉积在血球计数板底部,有的藻细胞内容物中出现了深绿色的凝块.小剂量的紫外线辐射会刺激钝脆杆藻细胞生长,藻细胞数量随着剂量的增加而增多.在紫外线辐射和黑暗环境的共同作用下,藻细胞数量明显增多,在剂量为100和200 mJ·cm-2时,藻细胞数量分别增加34.5%和39.4%.在剂量大于200mJ·cm-2时,藻细胞数量随着剂量的增加开始减少,紫外线对藻细胞的生长促进作用开始减弱,在剂量为300和400 mJ·cm-2时藻细胞数量分别增加29.8%和16.8%.在剂量小于400 mJ·cm-2时紫外线法对钝脆杆藻没有灭活效果.
黑暗环境培养5d后谷皮菱形藻细胞数量减少了10%,黑暗对藻细胞的生长有抑制作用,藻细胞需要光合作用才能生长,失去光合作用5d有少量藻细胞死亡.谷皮菱形藻经紫外线辐射黑暗环境培养5d后,大多数的藻细胞沉积在血球计数板底部,有的藻细胞内容物不完整,有的藻细胞只剩下细胞壁.谷皮菱形藻对紫外线辐射敏感,灭活率随着剂量的增加而提高,在剂量为100 mJ·cm-2时的灭活率为23.7%.随着剂量继续增加,藻细胞对剂量的变化不再敏感,灭活率增加缓慢,在剂量为200,300和400 mJ·cm-2时的灭活率分别为26.8%,32.2%和36.9%.紫外线法对谷皮菱形藻具有一定的灭活效果.
2.2 紫外线法对3种绿藻的灭活效果
由图2可以看出,紫外线法对3 种绿藻的灭活效果表现出巨大的差异性.

图2 紫外线法对3种绿藻的灭活效果Fig.2 The inactivation effect of UC-V on three species of Chlorophyta
镰形纤维藻在黑暗环境培养5d后藻细胞数量增加了20.9%,藻细胞对黑暗表现出一定的忍耐能力,失去光合作用5d有一些藻细胞能生长繁殖.经紫外线辐射黑暗环境培养5d后,镰形纤维藻有半数藻细胞沉积在血球计数板底部,细胞内容物中出现了深绿色的凝块.藻细胞对紫外线比较敏感,藻细胞数量随着剂量的增加而快速减少.由于镰形纤维藻在黑暗时生长繁殖的数量多于紫外线对藻细胞灭活而减少的数量,因此在紫外线辐射黑暗环境培养5d后藻细胞的数量仍然增加了,在剂量为100 mJ·cm-2时,藻细胞数量增加了2.2%.随着剂量继续增加,对藻细胞的生长促进作用减弱,藻细胞数量开始减少,在剂量为200mJ·cm-2时细胞数量比对照样增加0.7%.小剂量时紫外线法对镰形纤维藻没有灭活效果.在剂量大于300mJ·cm-2时对藻细胞有灭活效果,灭活率随着剂量的增加开始快速提高,在剂量为300和400mJ·cm-2时的灭活率分别为1.2%和29.5%.
黑暗环境培养5d后斜生栅藻细胞数量增加了3.7%,藻细胞对黑暗表现出一定的忍耐能力,失去光合作用仍有少量藻细胞能生长繁殖.斜生栅藻经紫外线辐射黑暗环境培养5d后,有少量藻细胞沉积在血球计数板底部,细胞颜色变暗,细胞群体不再排成一列,全部分散开.斜生栅藻对紫外线辐射非常不敏感,具有较强的抗性,随着剂量的增加,藻细胞数量减少得非常缓慢.由于在黑暗时生长繁殖的藻细胞数量多于紫外线对藻细胞灭活而减少的数量,因此在紫外线辐射黑暗环境培养5d后藻细胞的数量仍然增加了,在剂量为100和200mJ·cm-2时藻细胞数量分别增加0.7%和0.4%.剂量增加到300mJ·cm-2时,对藻细胞有灭活效果,在剂量为300和400 mJ·cm-2时的灭活率分别为0.3%和3.2%.
黑暗环境培养5d后小球衣藻细胞数量减少了53.5%,黑暗对藻细胞生长有很强的抑制作用,藻细胞需要光合作用才能生长,失去光合作用5d有半数藻细胞死亡.小球衣藻经紫外线辐射黑暗培养5d后,藻细胞全部沉积在血球计数板底部,细胞颜色变成浅绿色,随着剂量的增加,藻细胞变型更严重,有更多细胞的内容物溢出.小剂量的紫外线会刺激小球衣藻细胞生长,对藻细胞生长有促进作用,藻细胞数量随剂量的增加而增多.由于黑暗对小球衣藻细胞生长的抑制作用远大于紫外线辐射对藻细胞生长的促进作用,因此藻细胞在5d后的数量还是显著减少,在剂量为100和200mJ·cm-2时对藻细胞的灭活率分别为53.0%和49.3%.在剂量大于200mJ·cm-2时,藻细胞的数量开始缓慢减少,对藻细胞生长的促进作用开始减弱.在剂量为300 和400 mJ·cm-2时的灭活率分别为57.1%和59.7%.紫外线法对小球衣藻有较好的灭活效果.
2.3 紫外线法对铜绿微囊藻和卵形隐藻的灭活效果
如图3所示,铜绿微囊藻在黑暗环境培养5d后藻细胞数量减少了21.8%,黑暗对藻细胞生长有一定的抑制作用,失去光合作用有一些藻细胞死亡.经紫外线辐射黑暗环境培养5d后,藻细胞全部沉积在血球计数板底部.铜绿微囊藻对紫外线辐射和黑暗的共同作用十分敏感,灭活率随着剂量的增加而快速提高,在剂量为100和200mJ·cm-2时的灭活率分别为52.3%和73.4%.随着剂量继续增加,藻细胞对剂量变化不再敏感,灭活率增加缓慢,在剂量为300和400 mJ·cm-2的灭活率分别为77.3%和86.1%.紫外线法对铜绿微囊藻具有较好的灭活效果.
在黑暗环境培养5d后卵形隐藻细胞数量增加了28.4%,藻细胞对黑暗表现出很强的忍耐能力,失去光合作用5d仍有一些藻细胞能生长繁殖.卵形隐藻经紫外线辐射再黑暗培养5d后,只有少量的藻细胞沉积在血球计数板底部.卵形隐藻对紫外线辐射很不敏感,具有一定的抗性,随着剂量的增加,藻细胞数量减少缓慢.由于藻细胞在黑暗时生长繁殖的藻细胞数量远远多于紫外线对藻细胞灭活而减少的数量,因此在紫外线辐射黑暗环境培养5d后藻细胞的数量仍然增加了,在剂量为100,200,300 和400 mJ·cm-2时,藻细胞数量分别增加22.8%,18.5%,11.5%和8.6%(图3).在剂量小于400 mJ·cm-2时紫外线法对卵形隐藻没有灭活效果.
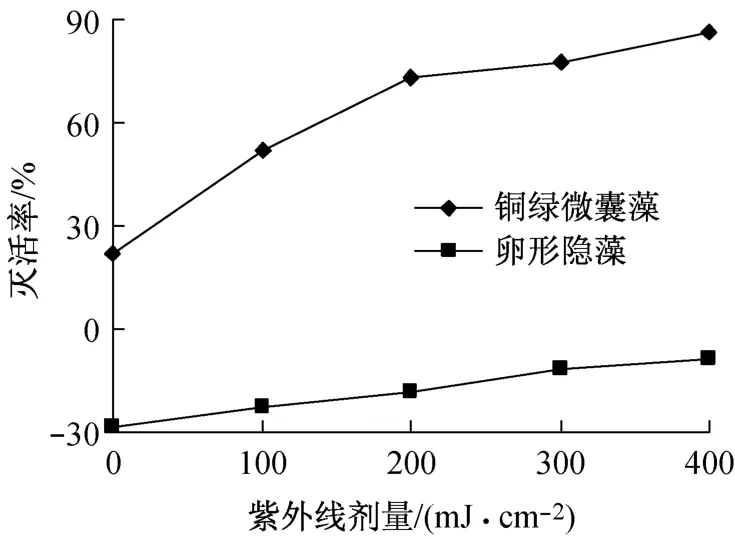
图3 紫外线法对铜绿微囊藻和卵形隐藻的灭活效果Fig.3 The inactivation effect of UC-V on Microcystis sp.and Cryptomonas ovata Her
2.4 作用效果分析
水体中的藻细胞会处于一个接受阳光适宜、对自身生长有利的深度.试验显示,经紫外线辐射黑暗环境培养5d后的藻细胞更易于沉降于血球计数板底部,并且随着紫外线剂量的增加沉降的藻细胞数量更多.这可能是由于藻细胞经紫外线照射后产生了自由基和活性氧[15-16],同时藻细胞的气囊结构受到了破坏,从而影响了藻细胞的悬浮功能.
有研究者认为个体较小而具有较大表面积与体积比的藻细胞耐受紫外线辐射的能力更强[17],而Xiong等试验研究认为,藻细胞的大小可能改变紫外线筛选作用的有效性,但细胞个体大小与敏感性之间并没有一致性关系[18].本试验8种淡水藻中镰形纤维藻和钝脆杆藻的个体大小相差不多,紫外线对镰形纤维藻的灭活率比较高,对青岛大扁藻的灭活率比较低.因此,从试验结果可以说明藻细胞个体大小可能不是影响紫外线灭活效果的原因.
从低等生物到高等生物的许多研究表明,生物体在受到辐射和化学药物的低剂量处理后往往表现出促进作用,这可能是由于生物的抗逆性起作用刺激生长.Stebbing把毒物在低浓度下出现这种增益现象是其在无毒情况下的刺激反应称为“毒物的兴奋效应”[19].紫外线UV-B辐射能促进微藻生长的现象在其它的 试验中 有 报 道[20-21],但UV-C 辐射能促进藻细胞生长的现象未见报道.本试验中小剂量的紫外线辐射能刺激钝脆杆藻和小球衣藻细胞生长,随着剂量增加藻细胞的数量也增多,当剂量大于300 mJ·cm-2时,藻细胞的数量开始缓慢减少,对藻细胞的生长促进作用开始减弱,并且随着剂量的增加,减弱的幅度也增大.
大多数藻类是专性光合自养生物,以光作为能量,还原CO2为碳水化合物而获得生物量.紫外线辐射能抑制藻细胞生长,引起叶绿素降解和光合速率下降,并进一步证实这些伤害是由于藻细胞内产生有伤害作用的活性氧(超氧阴离子自由基和过氧化氢)所致[22].本实验中钝脆杆藻和小球衣藻受到紫外线辐射,随着剂量的增加,首先表现出对藻细胞生长的促进作用,随着剂量的进一步增加,促进作用逐渐减弱.可能是因为小剂量紫外线辐射刺激使藻细胞内的活性氧含量增加,而清除活性氧的抗氧化系统也被紫外线诱导增强,所以抗氧化能力增强,藻细胞生长加快;但随着紫外线剂量的增加,活性氧在细胞体内大量积累,抗氧化系统不足以清除过量的活性氧,所以抗氧化能力下降,细胞受到氧化伤害,细胞分裂速度下降,并且随剂量的增加促进作用减弱;随着剂量的进一步增加,紫外线辐射开始对藻细胞产生了灭活作用.有的研究认为紫外线吸收化合物如MAAs(mycosporine amino acid)、黄酮醇及多胺类化合物在保护水生生物免受紫外线辐射伤害起重要的作用[23],有试验报道生物体内抗氧化系统,如抗氧化酶系统成分SOD,POD,GPX 和非酶系统成分如抗坏血酸、β胡萝卜素、GSH 等在保护细胞免受辐射方面具有重要意义[24],也有文献报道,紫外线辐射使藻细胞分泌大量多糖作为亲水性基质,将紫外线吸收色素包裹在基质中,既帮助紫外线吸收色素固定在细胞壁外,又延长了紫外线进入细胞壁的通道,部分多糖直接和紫外线色素连接成为新型紫外线吸收活性物质[25].小剂量的紫外线辐射能够刺激钝脆杆藻和小球衣藻生长,藻细胞的紫外线吸收化合物与抗氧化系统的保护机制的特殊性可能是根本原因,应从生理生化指标对它们做进一步研究.
从紫外线对梅尼小环藻、谷皮菱形藻、小球衣藻、镰形纤维藻、斜生栅藻和铜绿微囊藻的灭活效果图中的曲线趋势可以得出,当紫外线剂量超过400 mJ·cm-2时,随着紫外线剂量的增加,对这几种藻的灭活效果可能会进一步提高.当紫外线剂量超过400mJ·cm-2的某一值时,可能会刺激钝脆杆藻和卵形隐藻细胞的生长,也可能对藻细胞产生灭活作用.可以增加紫外线剂量做进一步的试验研究.
从试验结果中可以看出,紫外线辐射对淡水藻的灭活效果较差,当采用过滤和紫外线的组合工艺处理压载水时,不能依靠紫外线工艺去除藻类.紫外线和高级氧化技术(AOT)联用、紫外线和超声波联用、中压紫外线可能将会成为压载水处理技术的研究热点之一.
3 结论
(1)紫外线辐射对梅尼小环藻、谷皮菱形藻、小球衣藻和铜绿微囊藻具有一定的灭活效果,灭活率随着紫外线剂量的增加而提高.
(2)小剂量的紫外线会刺激镰形纤维藻和斜生栅藻细胞生长,藻细胞数量随剂量的增加而增多,在剂量大于300mJ·cm-2时,藻细胞的数量开始缓慢减少.
(3)紫外线剂量小于400mJ·cm-2时紫外线法对钝脆杆藻和卵形隐藻没有灭活效果.
(4)紫外线辐射对淡水藻的灭活效果较差.
(5)藻细胞个体大小不是影响紫外线灭活效果的原因,藻的种类、藻细胞壁的有无及其成分的不同可能是造成不同灭活效果的原因.
[1] Iseri Y,Kawabata Z,Sasaki M.Development of a boat equipped with UV lamps for suppression of freshwater red tide in a reservoir[J].Japanese Journal of Water Treatment Biology,1993,29(2):61.
[2] Iseri Y, Tano J, Kawabata Z,et al. Suppression of dinoflagellate Peridinium bipes bloom in a reservoir by ultraviolet radiation[C]//Proceedings of the International Conference on Hydropower.San Francisco:[s.n.]1995:25-28.
[3] Iseri Y,Nakamichi M,Miyagawa S,et al.Development of a red tide control ship equipped with a UV irradiation systempreliminary and field experiments on harmful marine algae[C]//Oceans’04 Marine Technology Society/Institute of Electrical and Electronics Engineers Techno.[S.l.]:IEEE,2004:1787-1792.
[4] 周明,董金荣,赵开弘.浸没式UV-C技术对铜绿微囊藻生长的抑制效应[J].华中师范大学学报:自然科学版,2003,37(4):549.ZHOU Ming,DONG Jinrong,ZHAO Kaihong.Inhibitory effect of the submerged UV-C radiation technology on growth ofMicrocystisaeruginosa[J].Journal of Central China Normal University:Natural Sciences,2003,37(4):549.
[5] 董金荣,周明,赵开弘.浸没式UV-C技术对念珠藻“水华”的抑制效应[J].武汉理工大学学报,2003,25(10):16.DONG Jinrong,ZHOU Ming,ZHAO Kaihong.Inhibitory effects of submerged UV-C radiation technology on Nostoc causing water bloom[J].Journal of Wuhan University of Technology,2003,25(10):16.
[6] 周明,董金荣,包广旬,等.浸没式UV-C技术用于自来水厂除藻的研究[J].华中科技大学学报:自然科学版,2004,32(6):111.ZHOU Ming,DONG Jinrong,BAO Guangxun,et al.Algakilling in water works with submerged UV-C technology[J].Journal of Huazhong University of Science and Technology,2004,32(6):111.
[7] 廖兴盛,汪星,赵开弘,等.光催化纳米TiO2治理蓝藻工艺的研究[J].武汉理工大学学报,2007,29(6):16.LIAO Xingsheng, WANG Xing,ZHAO Kaihong,et al.Research on technological process for the growth inhibition ofCyanobacteriabynanometricTiO2in photocatalysis[J].Journal of Wuhan University of Technology,2007,29(6):16.
[8] 景江,周明,汪星,等.H2O2与UV-C灭藻的协同效果研究及工程实验[J].环境科学研究,2006,19(6):59.JING Jiang,ZHOU Ming,WANG Xing,et al.Engineering experiment and investigation of effect on degradation of cyanobacteria by the combination of UV-C and H2O2[J].Research of Environmental Sciences,2006,19(6):59.
[9] Alam M D Z B,Otaki M,Furumai H,et al.Direct and indirect inactivation of Microcystis aeruginosa by UV-radiation[J].Water Research,2001,35(4):1008.
[10] Sakai H,Oguma K,Katayama H,et al.Effects of low-or medium-pressure ultraviolet lamp irradiation on Microcystis aeruginosa and Anabaena variabilis[J].Water Research,2007,41(1):11.
[11] Sakai H,Oguma K,Katayama H,et al.Effects of low or medium-pressure UV irradiation on the release of intracellular microcystin[J].Water Research,2007,41(15):3458.
[12] Sakai H,Katayama H,Oguma K,et al.Kinetics of microcystis aeruginosa growth and intracellular microcystins release after UV irradiation[J].Environmental Science &Technology,2009,43(3):896.
[13] 全球压载水管理项目中国国家项目实施小组.全球更换压载水管理项目[J].交通环保,2001,22(1):1.China National Project Team of Global Ballast Water Management Program. Global ballast water management program[J].Environmental Protection in Transportation,2001,22(1):1.
[14] Bolton J R,Linden K G.Standardization of methods for fluence(UV Dose)determination in bench-scale UV experiments[J].Journal of Environmental Engineering,2003,129(3):209.
[15] Nicole G,Darby J.Sensitivity of microorganisms to different wavelength of UV light:implications on modeling of medium pressure UV systems[J].Water Research,2000,34(16):4007.
[16] Lehtola M J,Miettinen I T,Martikainent P J,et al.Impact of UV disinfection on microbially available phosphorus,organic carbon,and microbial growth in drink water[J]. Water Research,2003,37(5):1064.
[17] Karentz D, Cleaver J E, Mitchell D L. Cell survival characteristics and molecular responses of Antarctic phytoplankton to ultraviolet-b radiation [J].Journal of Phycology,2004,27(3):326.
[18] Xiong F S,Kopecky J,Nedbal L.The occurrence of UV-B absorbing mycosporine-like amino acids in freshwater and terrestrial microalgae(Chlorophyta)[J].Aquatic Botany,1999,63:37.
[19] Stebbing A R D.Hormesis—the stimulation of growth by low levels of inhibitors[J].The Science of The Total Environment,1982,22(3):213.
[20] 刘泳,王悠,唐学玺,等.UV-B辐射对两种海洋微藻生长的影响[J].海洋水产研究,2000,21(2):22.LIU Yong,WANG You,TANG Xuexi,et al.The effect of UVB irradiation on growth of two marine microalgae[J].Marine Fisherries Research,2000,21(2):22.
[21] 田继远,唐学玺,于娟,等.海洋微藻对UV-B辐射的生理生化响应[J].海洋科学,2006,30(4):54.TIAN Jiyuan,TANG Xuexi,YU Juan,et al.The physiological and biochemical responses of marine microalgae to UV-B radiation[J].Marine Sciences,2006,30(4):54.
[22] Lesser M P.Elevated temperature and ultraviolet radiation cause oxidative stress and inhibit photosynthesis in symbiotic dinoflagellates[J].Limnology and Oceanography,1996,41(2):271.
[23] Tisseransms M,Pais Desam A Rozema.The effect of solar UV radiation on four plant species in a coastal grassland vegetation in the Netherland[J].Physiol Planta,1996,97:731.
[24] 陈拓,任红旭,王勋陵.UV-B辐射对小麦抗氧化系统的影响[J].环境科学学报,1999,19(4):453.CHEN Tuo,REN Hongxu,WANG Xunling.Influence of enhanced UV B radiation on antioxidant systems in wheat leaves[J].ActaScientiaeCircumstantiae,1999,19(4):453.
[25] Enlings M.UV-B induced synthesis of photo-protective pigments and extracelluar polysaccharides in terrestrial cyanobacteriumNostoccommune[J].Bacteriol,1997,179(6):1940.

