胶州湾表层水中低分子量有机酸的分布及特征*
刘宗丽,丁海兵*,杨桂朋
(1.中国海洋大学 化学化工学院,山东 青岛266100;2.海洋化学理论与工程教育部重点实验室,山东 青岛266100)
低分子量有机酸(LMWOAs)一般是指碳链长度不大于5的有机酸[1],往往含有一个或多个羧基,有的还带有磺酸基、亚磺酸基等其它官能团。LMWOAs有较好的水溶性、易挥发,比较常见的包括甲酸、乙酸、丙酸、乳酸、正丁酸、异丁酸、正戊酸、异戊酸、甲基磺酸、丙酮酸、三氟乙酸等。LMWOAs广泛分布于海洋、湖泊、大气、土壤等各种天然环境中[1]。海洋中的有机酸是海洋有机物的重要组成部分,它们一方面对调整海水中的pH值和碱度起重要作用[2];另一方面通过形成多种复杂的络合物增加了海水中痕量金属的溶解性[3]。此外,LMWOAs是海洋中大部分有机碳降解的中间产物[4],而且也是海底沉积物中有机物厌氧降解过程中非常重要的中间产物[5]。在沉积物中,LMWOAs还可作为氧化剂为有机碳的厌氧反应提供电子[6-7]。尽管LMWOAs在海洋环境中有着十分重要的作用,但是对于LMWOAs在海洋特别是在水体中的特征的研究,目前的文献报道十分少见。到目前为止,有关海水中有机酸的研究都是在缺氧水体中进行的,如Ho[8]等研究了卡利亚克海盆乙酸的循环,他们的分析表明,在该海盆的缺氧海水中,乙酸浓度在大多数情况下低于2μmol·L-1;Albert[7]等的研究表明,黑海缺氧海水中检测出的甲酸、乙酸、乳酸的浓度相当的高,甲酸的浓度比另外两种酸高2~4倍,达到10μmol·L-1以上;Niko Finke[6]等人通过对斯瓦尔巴特群岛北极海洋沉积物的研究发现乙酸、乳酸、丙酸和异丁酸可以为铁和硫酸盐的还原提供电子。本研究通过分析胶州湾表层海水中的LMWOAs的含量,系统研究了它们在一个受人类活动影响显著的海域的分布特征,为进一步了解它们在海洋环境的基本状况、变化规律、相关的生物地球化学过程及其在全球有机碳循环中的重要作用提供科学依据。
胶州湾位于中国山东省山东半岛南部,为伸入内陆的半封闭性海湾。胶州湾口窄内宽,东西宽15nmile,南北长18nmile(低潮位时),平均深度为7m,面积367km2,自过去的70多a以来,胶州湾的面积减少了193km2。注入胶州湾的河流有漕汶河、洋河、大沽河、墨水河、白沙河等十余条河流。随着周边区域工农业、养殖业的发展,胶州湾受到人类的影响也越来越大。本研究的研究目的在于了解胶州湾表层水中LMWOAs的水平分布、组成及探讨LMWOAs与DOC,Chl-a之间的关系,并初步探讨影响胶州湾LMWOAs的各种因素。
1 实 验
1.1 样品采集及前处理
于2010-10乘考察船采集了胶州湾区域15个站位的表层海水样品(见图1),各站位的基本参数如表1所示。
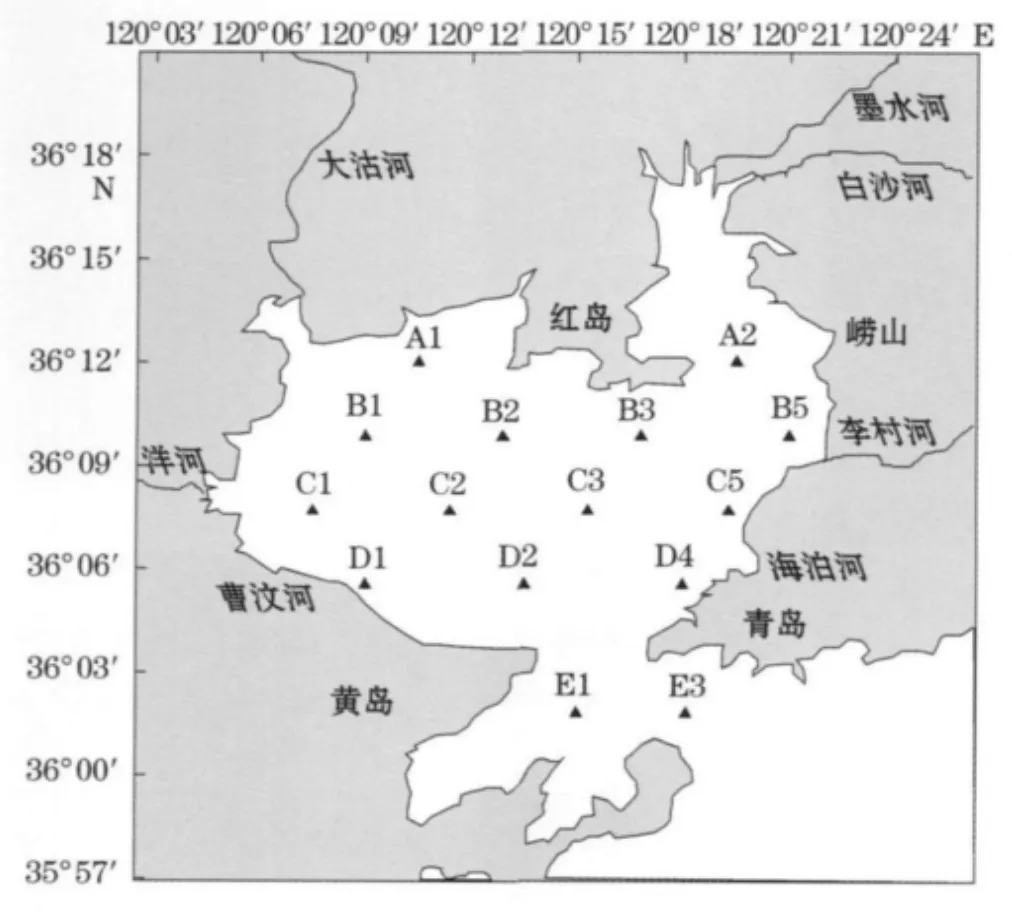
图1 2010-10胶州湾调查站位图Fig.1 Locations for sampling during the cruise in the Jiaozhou Bay in October 2010

表1 2010-10胶州湾15个站位的基本参数Table 1 Fundamental parameters at the 15stations in the Jiaozhou Bay(Cruise in Oct.2010)
表层海水样品用自制的树脂玻璃采水器采集,水样采集后紧接着用孔径为0.22μm的聚醚砜滤膜进行过滤,冷藏保存,回到到实验室立即分析。采样和分析过程中所用玻璃仪器均预先于450℃马弗炉中灼烧6 h,对于不能进行灼烧处理的容器或物品,对其进行超声处理后,先用10%盐酸洗液浸泡24h,然后依次用去离子水、MiLLi-Q水、甲醇和正己烷冲洗干净,用电热恒温鼓风干燥箱烘干后取出保存。
1.2 LMWOAs的分析
应用改进的Daniel B.Albert[9]的方法对海水样品中的LWMOAs进行定性定量分析。将2mL经0.22 μm聚醚砜滤膜过滤的水样转移至带有特氟龙瓶盖的4mL玻璃样品瓶中,加入盐酸化的吡啶缓冲液,通氮气4min,然后依次加入0.1mol·L-1的硝基代苯酚联肼(NPH,Sigma)溶液、0.3mol·L-12-二甲基氨丙基碳化二亚胺(EDC,Sigma)的缓冲液各0.2mL放置于室温下,1.5h后加入0.2mL 40%(w/v)的氢氧化钾溶液并将样品在70℃加热10min,然后用低速冷冻离心机(SC-3610,科大创新股份有限公司中佳分公司)将样品中由于钙、镁离子而产生的絮状物离心去除,取上清液100μL经高效液相色谱仪(HPLC)分析。
所用HPLC为Agilent-1100,配有在线脱气机、四元梯度泵、手动进样器(100μL)定量环、紫外检测器(400nm)及Agilent化学工作站。所用色谱柱为Agilent Eclipse×DB-C8(4.6mm×150mm×5μm)。流动相A:2.5%正丁醇,50mmol·L-1醋酸钠,2mmol·L-1氢氧化四丁铵(C16H37NO·30H2O,Sigma),2mmol·L-1溴化十四烷基甲铵(TDTMAB,Sigma),然后用磷酸将 调pH至4.5;流动相B仅为50mmol·L-1TDTMAB。洗脱程序为在5min内流动相由缓冲溶液A变为溶液B并保持20min。磷酸、正丁醇和甲醇均为HPLC级试剂,实验用水是Milli-Q水(Millipore Elix10USA)。
用此方法所可以检测出3种有机酸,保留时间依次为6.9,9.0,10.2min,分别代表乳酸、乙酸和甲酸,这3种酸的浓度通过与标准曲线比较得出。此方法的检测限、各种酸的标准曲线及线性相关系数(R2)、相对标准偏差(RSD)等如表2所示。

表2 LMWOAs分析方法的检测限、相对标准偏差、线性相关系数Table 2 The detection limit,relative standard deviation(RSD)and linear correlation coefficient of the analysis method for LMWOAs
1.3 DOC及Chl-a的分析
DOC的分析是运用高温催化氧化的方法,所用仪器为DOC分析仪(TOC-VCPH,Shimadzu公司),海水样品或标准溶液酸化后经高纯空气流除去无机碳,由玻璃注射器将水样注射入高温燃烧管(催化剂为0.5%Pt-Al2O3),工作温度固定为680℃,实验中进样量固定为50μL。有机碳在催化剂的表面高温催化氧化,氧化产物CO2由非色散红外气体分析仪测定,测定信号为峰面积,由邻苯二甲酸氢钾工作曲线直接求得DOC的浓度。样品平行测定2~3次,测定相对偏差小于2%,在空白被准确测定的条件下,方法的检测限为0.05mg C/L[10]。
Chl-a的分析是采用荧光分光光度法,取定量海水样品经Whatman GF/F玻璃纤维滤膜过滤后,用铝箔包裹滤膜于-20℃冷冻保存。分析时将滤膜用90%(体积分数)丙酮水溶液在暗处浸取24h,用Turner荧光仪进行测定[11-12]。
2 结果与讨论
2.1 胶州湾表层水中LMWOAs的浓度及水平分布
通过对2010-10胶州湾表层水中乳酸、乙酸和甲酸的定量分析(表3)表明,这3种酸的浓度变化范围分别为1.72~11.11,4.47~17.98,2.89~6.04μmol·L-1,平均浓度分别为(3.25±2.25),(12.77±2.94),(4.90±1.27)μmol·L-1。3种酸的总浓度(TOA)变化范围为18.02~24.66μmol·L-1,平均浓度为(20.95±1.95)μmol·L-1。乳酸、乙酸和甲酸占 TOA的平均比例分别为15.62%,60.97%,23.41%。总体而言,在绝大多数站位,乙酸的浓度最高,乳酸的浓度最低。Albert等[7]对黑海的调查结果表明,在黑海厌氧海水中,测到有机酸的组成与胶州湾表层海水基本相同,但甲酸的浓度最高,达到10μmol·L-1以上。我们的研究结果表明,海洋中低分子量有机酸的组成与大气降水和湖水有明显的不同,例如Xiao等[13]在博斯腾湖底泥间隙水检测到7种LMWOAs,分别为乳酸、乙酸、甲酸、丙酮酸、三氟乙酸、山梨酸和草酸,其中丙酮酸的含量最高,平均浓度为24.35μmol·L-1;章炎麟等[14]对贵州安顺雨季降水中低分子量有机酸的组成进行了研究,结果表明,降水中主要的有机酸组成为乙酸、甲酸和草酸,其中乙酸的含量最高。

表3 胶州湾表层海水中低分子量有机酸、DOC、Chl-a的浓度Table 3 Concentrations of LMWOAs,DOC and Chl-a in the surface water of the Jiaozhou Bay
胶州湾3种有机酸和总有机酸的分布如图2所示。由图2a~图2c可以看出,乳酸、乙酸、甲酸的最大值分别位于C1、D1和B3站位,浓度分别为11.11,17.98,8.37μmol·L-1,其最小值分别位于 A1、C1和C2站位,浓度分别为1.72,4.47,2.89μmol·L-1;由图2d可以看出,TOA 的最大值位于 D1站位,为24.66 μmol·L-1,最小值位于C3站位,为18.02μmol·L-1。此外,乳酸和乙酸的分布趋势相近,在胶州湾西海岸,特别是洋河和漕汶河之间的水域,这两种酸的浓度明显高于其他区域。与乳酸和乙酸相比,甲酸的分布有明显不同,较高的甲酸浓度出现在红岛以南的水域。总体而言,LMWOAs的分布大致显现出近岸高、远岸低的趋势;胶州湾东部和西部TOA的含量较高,西北部的含量较低。

图2 2010-10胶州湾表层水中乳酸、乙酸、甲酸及TOA的等值线分布图Fig.2 Horizontal distributions of lactate,acetate,formate and TOA in the surface water of the Jiaozhou Bay in October 2010
2.2 3种酸之间的相关性
对胶州湾所有调查站位表层水中乳酸、乙酸与甲酸的浓度进行线性回归(图3),结果表明:乳酸与甲酸(R=-0.011 6,P=0.967 3)、乙酸与甲酸(R=-0.202 9,P=0.468 3)之间并无相关性,但乳酸与乙酸(R=-0.749 6,P=0.001 3)有较显著相关性,可以说明乳酸与乙酸具有可能有共同的来源。从新陈代谢的角度来看,这两种酸是众多生物代谢过程的如糖酵解、无氧呼吸等的产物,而甲酸的新陈代谢则不如这两种酸普遍。乳酸和乙酸具有相关性是合理的。
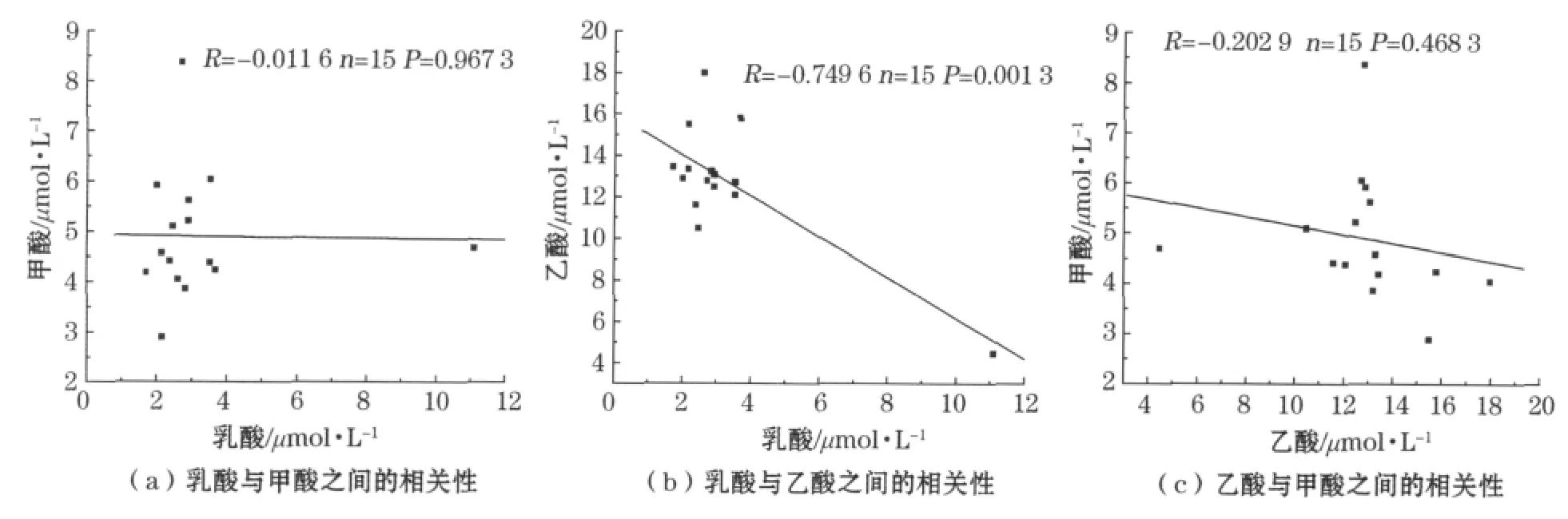
图3 胶州湾表层水中3种酸之间的相关性Fig.3 Correlations among the three organic acids in the surface water of the Jiaozhou Bay
2.3 3种有机酸来源的判定
江伟[15]等于2008年对降水中低分子量有机酸的来源进行了研究,根据气液平衡原理提出了用降水中甲酸、乙酸比值(F/A)aq判定有机酸来源方法,由于胶州湾表层水与大气之间也存在气液平衡,运用江伟等提出的公式我们可以得到胶州湾表层水有机酸来源的判定界限理论值(F/A)aq:
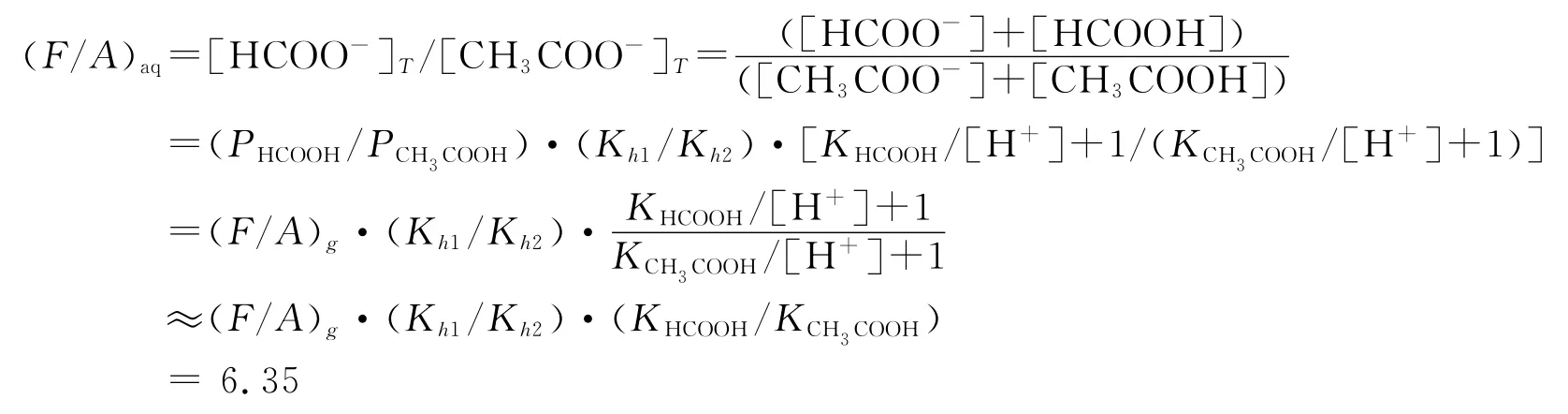
在上述公式中,Fornaro等[16]给出的大气降水有机酸来源的判定界限(F/A)g=1,KHCOOH,KCH3COOH分别为甲酸、乙酸的电离常数,各取1.77×10-4mol·L-1,1.76×10-5mol·L-1(298.15K);Kh1,Kh2分别为甲酸、乙酸的亨利常数,各取0.055mol·(L·Pa)-1,0.087mol·(L·Pa)-1(298.15K);[HCOO-]T,[CH3COO-]T分别为胶州湾表层水中甲酸、乙酸的总浓度(mol·L-1);PHCOOH、PCH3COOH分别为气相中甲酸、乙酸气体的分压(Pa);[H+]为自由氢离子浓度(mol·L-1),由现场测定的pH值求出,由于胶州湾表层水的pH在8左右,故公式可以简化算出有机酸来源的判定界限理论值(F/A)aq为6.35。当胶州湾表层水中实测的F/A>(F/A)aq时,表明有机酸主要来源于海水中有机物的降解等天然过程;当F/A<(F/A)aq时,表明有机酸主要来源于人类活动(生产及生活中污水废气的排放、贝类养殖等)[15]。利用上述的判定公式,我们可以得知胶州湾表层水中有机酸的来源(见表4),结果表明,在胶州湾15个站位中F/A全部小于(F/A)aq,可见胶州湾表层水中的有机酸主要受人类活动的影响。然而,根据Albert等[7]对黑海缺氧海水的研究结果,在一个基本没有人类影响的海区,尽管甲酸的浓度远远高于乙酸,但他们的浓度比在2~4之间,没有达到判定界限的理论值。因此应用江伟的公式直接用于判断海水中的有机酸来源是有疑问的。实际上,海水和雨水样品的一个重要不同是海水中有大量的生物活动,不断的产生和消耗各种有机酸,因而在计算判定界限理论值的时候应考虑两种酸的周转速率,也就是(F/A)aq的值应该进行调整:(F/A)aq′=(F/A)aq×(RF/RA)。RF/RA是甲酸和乙酸周转率的比值。然而,到目前为止,有关海水中这两种酸周转速率的报道十分罕见,仅在Albert[7]等的文章中提到乙酸的周转速率明显高于甲酸,也就是RF/RA小于1。(F/A)aq′的值也就应该小于6.35,并且随着样品中两种酸的周转速率的变化而变化。同Albert的研究结果相比,我们采集的胶州湾样品中甲酸和乙酸的比值都远远的小于2。尽管由于缺乏RF/RA的数据而无法求得(F/A)aq′,由于较低的(F/A)aq值,判定胶州湾表层海水中的有机酸来源于人类活动应该是合理的,也符合胶州湾的实际情况。

表4 胶州湾表层水中有机酸的来源Table 4 The sources of organic acids in the surface water of the Jiaozhou Bay
2.4 影响胶州湾表层水中LMWOAs分布的因素
胶州湾表层水中LMWOAs的浓度与分布受到微生物活动及多种生物过程的控制和影响。海洋中LMWOAs的来源十分复杂,既包括有机物降解等天然过程,也包括污染物排放、海水养殖等人为过程。早在1985年,Sansone[17]的研究表明,在Cape Lookout Bight的沉积物中,绝大多数有机酸是由较大有机分子通过发酵、降解产生的。根据对胶州湾周围环境及有机酸含量分布的分析结果表明,工业、农业、生活污水、以及工业和生活废弃物可能是胶州湾水体中有机酸的最主要的来源,人类活动在其中的影响重大。
2.4.1 向海洋倾倒疏浚物的影响
海洋倾倒区是专门用于接受港口、航道疏浚物及城市废弃物的海区,从全球来看,疏浚物是海洋倾倒废弃物中数量最大的一类,占每年向海洋倾倒废弃物的80%~90%[18]。青岛海洋倾倒区位于青岛胶州湾口外东南方(35°59′24″~35°58′39″N,120°18′00″~120°20′00″E),距离青岛市6.7km,面积约7km2,海域平均水深22m。大量倾倒疏浚物已经对海洋生态环境造成了一定程度的危害,一方面容易造成海水悬浮物浓度增大,降低水体透光性,从而直接影响生物的光合作用及降低初级生产力;另一方面,倾倒期间的大颗粒悬浮物对海洋生物呼吸器官产生堵塞,致使生物窒息死亡[19]。这样就会形成利于厌氧生物生存的环境,而LMWOAs是海洋中有机物厌氧降解过程中非常重要的中间产物[20],进而增加了有机酸的含量[21]。我们的结果表明,位于胶州湾口的E1和E3站位TOA的浓度分别为20.03和20.90μmol·L-1,这两个站位受黄海的影响更大一些,理论上来说TOA的值应该低一些,但实际上这两个站位TOA的浓度并不低,均在20 μmol·L-1以上,我们将之归结于倾倒区的影响。
2.4.2 人类陆地活动的影响
Alexander van Geen等[22]通过对美国加利福尼亚州旧金山海湾沉积物的研究表明,密集的人类活动对海湾底泥的污染有重要的影响。在本次调查中,胶州湾西北部人类居住区与海岸线之间有一定的缓冲区域,以大沽河入海口处的滩涂地带向两侧延伸属于农耕区,而胶州湾的其他沿海地区都是人口密集的人类活动区域。D1站位沿海就分布着像青岛重交沥青、青岛大炼油这样的大型化工厂,许多污染物可通过漕汶河口入湾,增加了湾内的有机酸浓度。C5站位沿岸就是青岛港。B5站位在李村河入海口外,而李村河两岸也分布着如海晶化工、有机化工厂、造纸厂、橡胶厂等诸多工厂。沧口是老工业区,曾集中了青岛市的大多数橡胶化工企业及机械钢铁等重工业。人类在这些生产活动中产生的废气、废水等,以及日常生活中产生的污水、垃圾等都可以直接或间接地通过河流排入胶州湾中,研究结果表明,TOA的最大值位于D1站位,为24.66 μmol·L-1,而位于近岸的B1,B5,C1,C5和D4站位TOA的浓度也相对较高,均在20μmol·L-1以上,而位于远岸的B2,C3以及西北部的A1站位TOA的浓度相对较小,可见这些人类活动对LMWOAs的影响较大。
2.4.3 贝类养殖的影响
Crawford等[23]对扇贝养殖区附近的深海环境调查发现,深海中沉积物的沉降量、硫化物的浓度、有机碳的含量和水浊度比非扇贝养殖区域的要高;季如宝等[24]研究了贝类养殖对海湾生态系统的影响,在贝类密集区,生物沉降作用非常明显,生物沉降将大量悬浮物搬运到底层,其中包括本应悬浮的高有机成分的较小颗粒物[25],这些有机物在底层的堆积使微生物活动加强,增加了底质对氧的需求,因而可能产生缺氧或无氧的环境[26],增强的微生物无氧代谢导致乙酸、乳酸等低分子量有机酸沉积物到水体的加速释放。从图2d可以看出,在胶州湾东西两片扇贝养殖区域TOA的浓度都比较高,例如B5,C5,D1站位TOA的浓度均在20 μmol·L-1以上,乙酸和TOA在D1站位有最大值,这可能是由于扇贝养殖为厌氧生物提供了厌氧环境的缘故。

图4 胶州湾扇贝养殖区域Fig.4 The scallop culture areas in the Jiaozhou Bay
2.5 TOA与DOC及Chl-a的相关性
2.5.1 TOA与DOC的关系
不同环境中,LMWOAs对DOC的贡献不同,Van Hees等[29]对土壤中有机酸的研究表明土壤中LMWOAs对DOC的贡献为0.9%~3.3%;Xiao等[13]对博斯腾湖底泥间隙水的研究表明LMWOAs对DOC的贡献为0.68%~17.63%;Xiao[3]等还对中国六大湖底泥间隙水中LMWOAs的垂直分布进行了研究,结果表明,间隙水中TOA与TOA/DOC(三种酸对DOC的贡献)的垂直变化趋势大致相同。我们研究结果表明,胶州湾表层水中乳酸、乙酸和甲酸对DOC的贡献范围分别为3.07%~20.23%,5.43%~21.11%和2.71%~10.55%,平均比例为6.07%,16.12%和3.04%,乙酸对DOC的贡献最大;TOA对DOC的贡献范围为19.65%~33.03%,平均比例为25.23%,LMWOAs对DOC的贡献显著。由图5a可以看出,胶州湾表层水中TOA与TOA/DOC的变化趋势大致相同,通过对所有调查站位TOA与TOA/DOC的浓度进行线性回归(图5b)结果表明,二者间存在一定的相关性(R=0.554 6,n=15,P=0.031 9),但是 TOA与DOC之间并无相关性。此结论说明TOA对DOC的总量起决定性的作用。

图5 胶州湾表层水TOA与TOA/DOC的关系图Fig.5 The relationship between TOA and TOA/DOC in the surface water of the Jiaozhou Bay
2.5.2 TOA与Chl-a的相关性
Chl-a是浮游植物进行光合作用的主要色素,同时也是表征浮游植物生物量的一个重要指标[12]。Goutx等[30]通过对地中海维勒弗朗什湾水域的研究表明高分子量有机酸(例如多元不饱和脂肪酸等)与Chl-a之间存在一定的相关性;陈岩等[12]对北黄海的研究表明海水中的游离氨基酸与Chl-a之间存在一定的相关性。通过对胶州湾表层水所有调查站位TOA与Chl-a的浓度进行线性回归(图6)结果表明,二者之间并不存在明显相关性(R=0.157 0,n=15,P=0.576 3)。可见,尽管胶州湾表层水中LMWOAs的释放和摄取受多种生物过程的控制,但由于受人类活动的影响重大,LMWOAs与Chl-a的相关性不显著。

图6 胶州湾表层水中TOA与Chl-a的相关性Fig.6 The correlation between TOA and chlorophyll-a in the surface water of the Jiaozhou Bay
3 结语
本研究通过高效液相色谱法对2012-10胶州湾15个站位获取的表层海水样品中LMWOAs进行了定性定量分析,结果表明:1)高效液相色谱能够在胶州湾表层海水中检测到3种典型的LMWOAs,分别为乳酸、乙酸和甲酸,其中乙酸的含量最高,平均浓度为(12.77±2.94)μmol·L-1,占TOA的平均比例高达60.97%,其次为甲酸,含量最低的为乳酸;2)2010-10胶州湾表层水中LMWOAs的水平分布总体呈现近岸高、远岸低的特点,可见胶州湾受人类的影响显著;3)通过有机酸来源的判定界限理论值(F/A)aq并结合两种酸的实际周转速率,可以初步推断胶州湾表层海水中的有机酸主要来源于人类活动;4)胶州湾表层水中TOA对DOC的贡献范围为19.65%~33.03%,平均比例为25.23%,可见LMWOAs对DOC的贡献显著,是DOC的重要组成部分,而且胶州湾表层水中TOA与TOA/DOC的水平变化趋势大致相同,说明TOA对DOC的总量起决定性的作用,但TOA与DOC之间并无相关性,TOA与Chl-a也缺少相关性(R=0.157 0,n=15,P=0.576 3),表明生物活动对胶州湾LMWOAs的影响并不明显。综上所述,2010-10胶州湾表层水中LMWOAs含量的水平分布规律是自然因素和人类活动共同作用的结果,其中人类的影响重大。
迄今为止,国际上对LMWOAs的研究已经做了大量的工作,但到目前为止,对LMWOAs有针对性的、系统的研究较少,在国内更是缺乏这方面的研究,还有许多空白亟待填补。就胶州湾而言,研究胶州湾LMWOAs在其水体和沉积物中的分布,在海-气界面、海水-沉积物界面、河-海界面的通量以及他们的周转率等都是需要进一步进行的工作。
(References):
[1]VAIRAVAMURTHY A,MOPPER K.Determination of low-molecular-weight carboxylic acids in aqueous samples by gas chromatography and nitrogen-selective detection of 2-nitrophenylhydrazides[J].Analytica Chimica Acta,1990,237:215-221.
[2]LOZOVIK P A.Contribution of organic acid anions to the alkalinity of natural humic water[J].Analytical Chemistry,2005,60(11):1126-1130.
[3]XIAO M,WU F C,LIAO H Q,et al.Vertical profiles of low molecular weight organic acids in sediment porewaters of six Chinese lakes[J].Journal of Hydrology,2009,365:37-45.
[4]SANSONE F J.Depth distribution of short-chain organic acid turnover in Cape Lookout Bight sediments[J].Geochimca et Cosmochimca Acta,1986,50:99-105.
[5]MUELLER-HARVEY I,PARKES R J.Measurement of volatile fatty acids in pore water from marine sediments by HPLC[J].Estuarine,Coastal and Shelf Science,1987,25:567-579.
[6]FINKE N,VANDIEKEN V,JØRGENSEN B B.Acetate,lactate,propionate,and isobutyrate as electron donors for iron and sulfate reduction in Arctic marine sediments,Svalbard[J].FEMS Microbiol Ecology,2007,59(1):10-22.
[7]ALBERT D B,TAYLOR C,MARTENS C S.Sulfate reduction rates and low molecular weight fatty acid concentrations in the water column and surficial sediments of the Black Sea[J].Deep-Sea Research,1995,42(7):1239-1260.
[8]HO T-Y,SCRANTON M I,TAYLOR G T,et al.Acetate cycling in the water column of Cariaco Basin:seasonal and vertical variability and implication of carbon cycling[J].Limnology and Oceanography,2002,47:1119-1128.
[9]ALBERT D B,MARTENS C S.Determination of low-molecular-weight organic acid concentrations in seawater and pore-water samples via HPLC[J].Marine Chemistry,1997,56:27-37.
[10]SHARP J H,BENNER R,BENNETT L,et al.Analyses of dissolved organic carbon in seawater:the JGOFS EqPac methods comparison[J].Marine Chemistry,1995,48:91-108.
[11]PARSONS T R,MAITA Y,LALLI C M.A Manual for Chemical and Biological Methods for Seawater Analysis[M].Oxford:Pergamon Press,1984.
[12]CHEN Y,YANG G P.Study on dissolved free amino acid(DFAA)in the surface water of the North Yellow Sea[J].Periodical of ocean university of China,2010,40(7):93-98.陈岩,杨桂朋.春季北黄海表层海水中溶解游离氨基酸的分布与组成研究[J].中国海洋大学学报,2010,40(7):93-98.
[13]XIAO M,WU F C,LIAO H Q,et al.Characteristics and distribution of low molecular weight organic acids in the sediment porewaters in Bosten Lake,China[J].Journal of Enviromental Sciences,2010,22(3):328-337.
[14]ZHANG Y L,LI X Q,HUANG D K,et al.Low molecular weight carboxylc acids in precipitation during the rainy season in the rural area of Anshun,west Guizhou province[J].Enviromental Science,2009,30(3):645-649.章炎麟,李心清,黄代宽,等.贵州安顺雨季降水中低分子有机酸研究[J].环境科学,2009,30(3):645-649.
[15]JIANG W,LI X Q,ZENG Y,et al.Low-molecular-weight organic acids in precipitation in Zunyi City,Guizhou province[J].Enviromental Science,2008,29(9):2425-2431.江伟,李心清,曾勇,等.贵州省遵义地区降水中低分子有机酸及其来源[J].环境科学,2008,29(9):2425-2431.
[16]FORNARO A,GUTZ I G R.Wet deposition and related atmospheric chemistry in the Sao Paulo metropolis,Brazil:Part 2-contribution of formic and acetic acids[J].Atmospheric Environment,2003,37(1):117-128.
[17]SANSONE F J.Depth distribution of short-chain organic acid turnover in Cape Lookout Bight sediments[J].Geochimca et Cosmochimca Acta,1986,50:99-105.
[18]SLEMR F,LANGER E.Increase in global atmospheric concentrations of mercury inferred from measurements over the Atlantic Ocean[J].Nature,1992,355:434-437.
[19]Can rio J,VALE C.Rapid release of mercury from intertidal sediments exposed to solar radiation:a field experiment[J].Environment Science Technology,2004,38(14):3901-3907.
[20]MUELLER-HARVEY I,PARKES R J.Measurement of volatile fatty acids in pore water from marine sediments by HPLC[J].Estuarine,Coastal and Shelf Science,1987,25:567-579.
[21]ZHENG L,CUI W L,JIA Y G.Case study on the impact of marine dumping on eco-environment in Qingdao Dumping Zone[J].Marine Environmental Science,2007,26(5):413-421.郑琳,崔文林,贾永刚.海洋倾倒导致生态环境变化实例研究[J].海洋环境科学,2007,26(5):413-421.
[22]VAN G A,LUOMA S N.The impact of human activities on sediments of San Francisco Bay,California:an overview[J].Marine Chemistry,1999,64(1-2):1-6.
[23]CRAWFORD C M,MACLEOD C K A,MITCHELL L M.Effects of shellfish farming on the benthic environment[J].Aquaculture,2003,224(1-4):117-140.
[24]JI R B,MAO X H,ZHU M Y.Impacts of coastal shellfish aquaculture on bay ecosystem[J].Journal of Oceanography of Huanghai &Bohai Seas,1998,16(1):21-27.季如宝,毛兴华,朱明远.贝类养殖对海湾生态系统的影响[J].黄渤海海洋,1998,16(1):21-27.
[25]KAUTSKY N,EVANS S.Role of biodeposition by Mytilus edulis in the circulation of matter and nutrients in a Baltic coastal ecosystem[J].Marine Ecology Progress Series,1987,38:201-212.
[26]TENORE K R,BOYER L F,CAL R M,et al.Coastal Upwelling in the Rias Bajas Northwestern Spain Contrasting the Benthic Regimes of the Rias De Arosa and De Muros[J].Journal of Marine Research,1982,40(3):701-772.
[27]DAHLB CK B,GUNNARSSON L H.Sedimentation and sulfate reduction under a mussel culture[J].Marine Biology,1981,63(3):269-275.
[28]KASPAR H F,GILLESPIE P A,BOYER I C,et al.Effects of mussel aquaculture on the nitrogen cycle and benthic communities in Kenepuru Sound,Marlborough Sounds,New Zealand[J].Marine Biology,1985,85(2):127-136.
[29]VAN H P A W,DAHLEN J,LUNDSTROM U S,et al.Determination of low molecular weight organic acids in soil solution by HPLC[J].Talanta,1999,48:173-179.
[30]GOOUTX M,SALIOT A.Relationship between dissolved and particulate fatty acids and hydrocarbons,chlorophyll a and zooplankton biomass in Villefranche Bay,Mediterranean Sea[J].Marine Chemistry,1980,8:299-318.

