联合应用CD3/CD28单克隆抗体对小鼠T淋巴瘤细胞EL4活化的影响①
娄 强 张 薇 刘广超 马远方
(河南大学医学院河南省抗体药物工程实验室细胞与分子免疫重点实验室,开封475004)
T细胞的充分活化需要双信号刺激,第一信号由TCR/CD3识别抗原提呈细胞(Antigen presenting cell,APC)表面的抗原肽-MHC复合物启动,第二信号由T细胞和APC间共刺激分子的相互作用启动,其中B7/CD28是最重要的协同刺激分子。单独的CD3抗体刺激会使T细胞失能;单独的CD28抗体也不能刺激T细胞活化[1,2]。联合应用CD3/CD28抗体研究人类和小鼠T细胞体外活化的方法一直被广泛应用。虽然许多细胞表面受体可以通过TCR增强信号,但CD28的确比其他共刺激分子更加有效。已有报导联合应用CD3/CD28抗体刺激人外周血单个核细胞(PBMC),使其在体外得到扩增活化[3],并且CD28共刺激能明显加强CD3诱导的小鼠脾脏T细胞的增殖,使IL-2的分泌量上调,并诱导T细胞信号转导通路多种基因的mRNA发生变化[4]。已知不同浓度的CD3单抗和CD28单抗、刺激的不同时间等因素均对人T淋巴细胞的增殖产生影响,第一信号(CD3单抗)呈浓度依赖性地促使T淋巴细胞增殖,浓度达到峰值(12.5 μg/ml)后,再加大浓度也不能使其作用增加;第二信号(CD28单抗)则表现为双向调节,高于或低于最佳浓度都使其刺激T细胞增殖的水平降低。T细胞单独接受抗CD3抗体24小时或抗CD28抗体16小时后,T细胞对相应的另一信号刺激呈低反应性[5]。联合应用CD3/CD28单克隆抗体对T淋巴瘤细胞活化影响的模式有待进一步探索。
EL4属于小鼠T淋巴瘤细胞系,来源于由9,10-二甲基-1,2苯并蒽诱生的C57/BL/6N小鼠T淋巴瘤细胞,曾应用于H-2抗体和CD3抗体共刺激T细胞活化的研究[6]。EL4细胞分为 PMA敏感型和PMA抵抗型,PMA抵抗型EL4细胞能够分泌IL-2,而PMA敏感型EL4细胞不分泌IL-2。评价T细胞活化最重要的因素即为细胞分泌IL-2的水平,因此可以应用PMA敏感型EL4细胞研究T细胞活化的模式。在本研究中,我们将从IL-2及细胞核转录因子的分泌、细胞增殖与细胞周期三个方面分析EL4细胞的活化能力。
1 材料与方法
1.1 细胞和试剂 小鼠淋巴瘤细胞EL4(购自北京鼎国昌盛生物技术有限责任公司)为悬浮生长,用DMEM基础培养基(Gibco)加入10%无支原体胎牛血清FBS(浙江天杭生物科技有限公司),于37℃、5%CO2培养箱中培养。维持细胞浓度在0.1×106~1×106个/ml之间,2~3天换液一次。
1.2 EL4细胞的活化及其细胞因子IL-2的诱生96孔酶标板放入超净台中紫外照射半个小时以上。将抗CD3(sc-18871,Santa cruz)和 CD28抗体(sc-12727,Santa cruz)用PBS稀释至不同浓度包被其中,4℃过夜,将抗体吸出,PBS洗一遍,拍干孔内液体,加入EL4细胞 (2×105个/200 μl),PMA 组无需包被,将PMA(50 ng/ml)直接加入到细胞培养液中即可,37℃、5%CO2培养 24、48、72 小时分别收集细胞培养上清。
1.3 EL4细胞分泌IL-2水平的ELISA检测 按Mouse IL-2 sunnyELISA试剂盒(购自联科生物技术有限公司)说明测定IL-2的含量。准备所有的试剂盒标准品,洗液洗板两次,浸泡板条15分钟,每孔加入50 μl样本稀释液,15分钟内加入标准品、样品和对照品,加入50 μl检测抗体,室温孵育3小时,洗板6次,加入100 μl过氧化物酶,室温孵育45分钟,洗板6次,加入100 μl显色底物,避光,室温孵育10~30分钟,加入100 μl终止液,30分钟内,在450 nm波长检测OD值。Varloskan Flash多功能酶标仪(Thermo 3001)测定EL4细胞培养上清中IL-2的含量。
1.4 细胞增殖实验 按细胞增殖与毒性检测试剂盒7Sea-CCK-8(上海七海复泰生物科技有限公司)说明测定EL4细胞活化前后增殖情况。细胞的活化方法同上,此时加入IL-2单克隆抗体(sc-34797,Santa cruz)刺激组(50 μg/ml)。每孔接种4 000个细胞(200 μl/孔),37℃、5%CO2培养24、48、72 小时后,每孔加入20 μl 7Sea-CCK-8溶液,在细胞培养箱内继续孵育1~4小时,用多功能酶标仪测定450 nm处的吸光度。
1.5 细胞周期实验 按细胞周期与凋亡检测试剂盒(上海七海复泰生物科技有限公司)说明检测CD3/CD28抗体或PMA刺激对EL4细胞周期的影响。1 000 r/min离心5分钟沉淀细胞后,用1 ml预冷的PBS重悬,再用1 000 r/min离心5分钟沉淀细胞,加入1 ml预冷的70%乙醇轻轻混匀,4℃固定过夜,1 000 r/min离心5分钟沉淀细胞后,用1 ml预冷的PBS重悬,再用1 000 r/min离心5分钟沉淀细胞,加入碘化丙啶染色液0.5 ml,轻轻混匀重悬细胞,37℃避光温育30分钟后,上流式细胞仪检测。
1.6 RNA的提取 收集细胞,加入1 ml Trizol(Invitrogen),充分混匀用来破碎细胞,加入三氯甲烷(洛阳昊华化学试剂厂)200 μl,15~30℃放置2分钟,13 000 r/min,4℃离心15分钟。取上清加入无水乙醇1 ml,混匀,13 000 r/min,4℃离心15分钟,弃上清。加入75%酒精(DEPC水配制)1 ml,洗涤离心10分钟,倾去上清,用吸水纸吸干残余酒精,加入约50 μl DEPC水混匀,58℃ 10分钟,加入 DNA裂解酶,37℃ 15分钟,75℃ 5分钟,最后加入RNA酶抑制剂(康为世纪),紫外分光光度计(DU640,Beckman Coulter)测RNA的浓度。
1.7 cDNA的合成 逆转录试剂盒(康为世纪)RNA 模板 1 ng ~ 5 μg,5 × RT buffer 4 μl,0.1 mol/L,DTT 2 μl,dNTP mix(10 mmol/L)1 μl,随机引物(100 μmol/L)1 μl,super RT(200 U/μl)1 μl,无RNA酶 DEPC水补足至总体系为20 μl。42℃、50分钟,70℃、15分钟,紫外分光光度计测cDNA的浓度,置-20℃或-80℃冻存备用。
1.8 Real time PCR反应 将 cDNA样品稀释为200 ng/μl加入 1 μl,2 × SYBR Green Real time PCR Master Mix(TOYOBO)10 μl,10 × Plus 溶液 2 μl,上下游引物(均为 10 μmol/L)2.4 μl,RNase-Free water 4.6 μl,每管 20 μl反应体系,每个样品 3 个复孔。置于实时定量PCR仪(corbett research RG-6000)进行PCR反应,设置程序为:95℃ 5秒,55℃10秒,72℃ 15秒,扩增40个循环,收集荧光。计算每组每个基因的ΔCt,再按公式:ΔΔCt=ΔCt(组2)-ΔCt(组1),计算两组中每个基因的 ΔΔCt,通过 2-ΔΔCt计算组2与组1对应基因的表达差异。
1.9 统计学方法 采用SPSS13.0统计软件进行t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 CD3/CD28抗体在不同浓度及不同时间点刺激EL4分泌IL-2水平(pg/ml)比较 小鼠淋巴瘤细胞EL4在未受到任何刺激的情况下分泌IL-2的水平很低,经抗CD3(25 μg/ml)抗体和抗CD28(2 μg/ml)抗体刺激48小时后,EL4分泌IL-2的水平显著升高(62.54 ±2.19)pg/ml,P <0.05,见表1。
2.2 联合应用CD3/CD28抗体对EL4细胞增殖的影响 采用CCK-8法观察了CD3/CD28抗体对EL4细胞增殖的影响。CD3/CD28抗体作用于EL4细胞至72小时时,随着CD3/CD28抗体浓度的增加,对细胞增殖的促进作用逐渐增强。同时加入IL-2抗体并不影响EL4细胞的增殖(图1)。

表1 联合应用CD3/CD28单克隆抗体对EL4细胞分泌IL-2(pg/ml)的影响Tab.1 Influence of combined application of CD3/CD28 monoclonal antibody on IL-2(pg/ml)secreted by EL4 cells
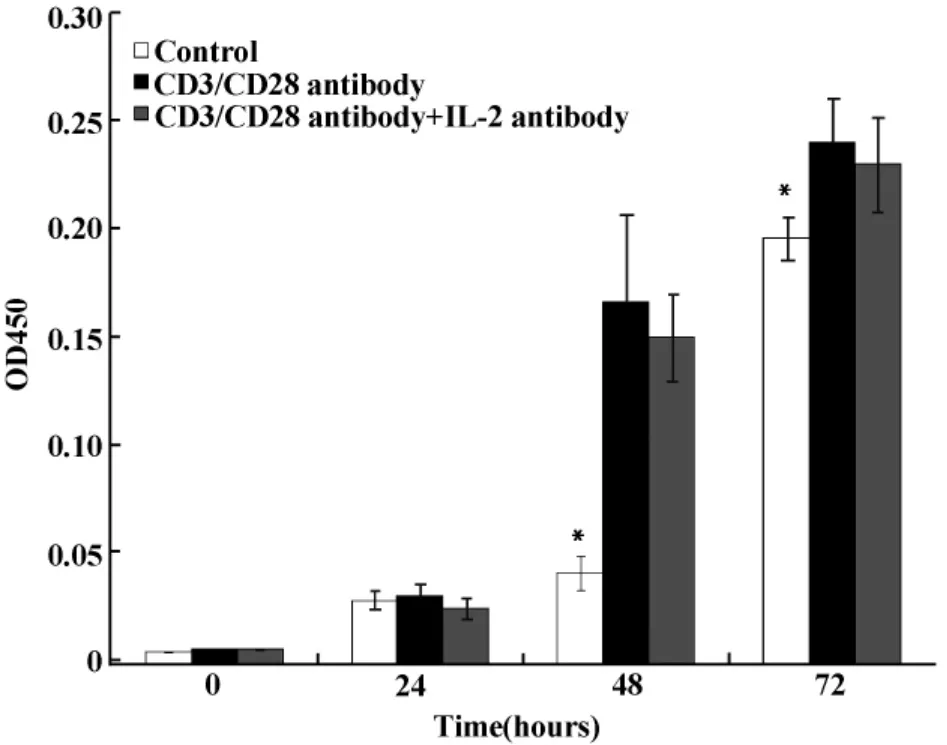
图1 IL-2抗体及联合应用CD3/CD28单克隆抗体对EL4细胞增殖的影响Fig.1 Effect of IL-2 antibody and combined application of CD3/CD28 monoclonal antibody on EL4 cell proliferation
2.3 联合应用CD3/CD28抗体对EL4细胞周期的影响 CCK-8法显示EL4细胞经过CD3/CD28抗体刺激后,增殖能力显著增加(P<0.05),进而通过流式细胞仪检测CD3/CD28抗体对EL4细胞周期的影响。CD3/CD28抗体刺激组与未刺激组相比,EL4细胞周期未出现明显的G1期阻滞(图2)。

图2 联合应用CD3/CD28单克隆抗体对EL4细胞周期的影响Fig.2 Effect of combined application of CD3/CD28 monoclonal antibody on EL4 cell cycle

图3 联合应用CD3/CD28单克隆抗体对EL4细胞IL-2及核转录因子NF-κB,NF-AT表达的影响Fig.3 Effect of combined application of CD3/CD28 monoclonal antibody on the expression of IL-2 and nuclear transcription factors NF-κB, NF-AT in EL4 cells
2.4 联合应用CD3/CD28抗体刺激对EL4细胞IL-2及核转录因子基因表达影响的定量分析 为探讨CD3/CD28抗体介导的IL-2调节的分子机制,在EL4细胞培养体系中联合加入抗CD3/CD28单克隆抗体,通过竞争性PCR定量检测其对IL-2 mRNA及转录因子NF-κB和 NF-AT的影响。结果表明,抗CD3/CD28抗体可明显促进 IL-2、NF-κB和 NF-AT mRNA 合成(P <0.05,图3)。
3 讨论
在本研究中,我们发现包被CD3/CD28抗体于细胞培养板上刺激T淋巴瘤EL4细胞活化的效果比在培养液中加入可溶性CD3/CD28抗体更明显。这可能是由于EL4细胞接触的包被CD3/CD28抗体有限,从而更容易刺激细胞增殖;并且,包被CD3抗体可能使EL4细胞表面CD3分子交连,使其胞内区互相靠近,胞内区的ITAM(免疫受体酪氨酸活化基序)易于被蛋白酪氨酸激酶(PTK)磷酸化,进而刺激EL4细胞的活化。CD3抗体通过激活多种蛋白酪氨酸激酶,再经一系列信号传递激活转录因子调节基因表达,使细胞活化[7]。CD28通过 PI3K、Grb2、A-SMase、PKC-θ等多种信号分子传递活化信号,亦可通过Itk、MPK等传导活化抑制信号,从而调控T细胞的活化、增殖等作用。已知多种细胞因子参与T细胞增殖和分化过程,包括IL-2、NF-AT、NF-κB 等[8,9],未激活 T 细胞仅表达低亲和力 IL-2R,而激活的T细胞可表达高亲和力IL-2R并分泌IL-2。通过自分泌及旁分泌作用,IL-2与T细胞表面IL-2R结合,介导T细胞增殖和分化[10,11]。我们发现CD3/CD28单克隆抗体共刺激EL4细胞明显增加IL-2及核转录因子的表达,为进一步评价EL4细胞作为研究T细胞活化的模型细胞提供了重要的参考价值,也对T细胞活化信号转导通路的研究有重要意义。
联合应用CD3/CD28单克隆抗体活化人PBMC[12]、人T细胞、小鼠脾脏细胞及EL4细胞等不同的细胞需要抗体刺激的浓度不同,这可能与细胞对抗原提呈细胞提呈不同抗原反应的能力不同有关。如果游离的CD3单抗浓度过大,可能导致由CD3抗体导致的CD3受体交连后传递抑制信号,细胞结合过多CD3抗体不但不会刺激T细胞,而且会导致细胞凋亡。我们发现,单纯应用CD3单抗或者CD28单抗刺激EL4细胞后,不能显著促进IL-2的分泌,而联合应用CD3/CD28单抗能够明显刺激EL4细胞分泌IL-2。EL4细胞经过CD3/CD28抗体刺激后,增殖能力显著增加,而细胞周期却不受明显影响,这可能是因为EL4细胞本身属于无限增殖状态的细胞系,其不需要成熟为分化完全的细胞,也不需要参与免疫应答。
本研究中应用的小鼠T淋巴瘤EL4细胞株自身不分泌作为T细胞活化标志的IL-2,与原代T细胞相比不需要细胞分离分选等提取过程,可以更方便的应用于体外T细胞的活化的研究;另外,EL4细胞在未受到任何刺激的情况下分泌IL-2的水平很低,经联合应用CD3/CD28抗体刺激后,分泌IL-2的水平显著升高,所以认定未经抗体刺激的EL4细胞为非活化的T细胞,为T细胞体外增殖活化及信号转导通路研究提供了细胞模型。
1 Abe R,Vandenberghe P,Craighead N et al.Distinct signal transduction in mouse CD4+and CD8+splenic T cells after CD28 receptor ligation[J].J Immunol,1995;154(3):985-997.
2 Sansom D M,Wilson A,Boshell M et al.B7/CD28 but not LFA-3/CD2 interactions can provide‘third-party’co-stimulation for human T-cell activation[J].Immunology,1993;80(2):242-247.
3 Garlie N K,LeFever A V,Siebenlist R E et al.T cells coactivated with immobilized anti-CD3 and anti-CD28 as potential immunotherapy for cancer[J].J Immunother,1999;22(4):336-345.
4 周俐斐,陈峰阳,李晓誉et al.CD3/CD28共刺激调节T细胞多重信号转导通路的基因mRNA表达[J].中国免疫学杂志,2012;28(5):393-414.
5 王顺友,孙 雨,马宝骊.抗CD3、CD28单抗对人T淋巴细胞共刺激作用的影响因素[J].上海免疫学杂志,1999;19(4):229-231.
6 Brams P,Claesson M H.T-cell activation.I.Evidence for a functional linkage between class I MHC antigens and the Tc-Ti complex[J].Immunology,1989;66(3):348-353.
7 Cantrell D.T cell antigen receptor signal transduction pathways[J].Annual Review Immuno,1996;14:259-274.
8 Northrop J P,Ho S N,Chen L et al.NF-AT components define a family of transcription factors targeted in T-cell activation[J].Nature,1994;369(6480):497-502.
9 Livolsi A,Busuttil V,Imbert V et al.Tyrosine phosphorylation-dependent activation of NF-kappa B.Requirement for p56 LCK and ZAP-70 protein tyrosine kinases[J].Eur J Biochem,2001;268(5):1508-1515.
10 Waldmann T A.The IL-2/IL-2 receptor system:a target for rational immune intervention [J].Immunology Today,1993;14(6):264-270.
11 Cantrell D A,Smith K A.The interleukin-2 T-cell system:a new cell growth model[J].Science,1984;224(4655):1312-1316.
12 骆 群,吕 明,于 鸣et al.抗CD28抗体协同刺激增强抗CD3抗体体外激活T淋巴细胞并降低TGF-β的表达[J].中国实验血液学杂志,2006;14(3):547-551.