环境污染物As及SHP2D61G/+激活对小鼠成纤维母细胞miRNA表达谱的影响
崔花芹,汪心怡,陈 吉,陈 卓,赵 华,瞿成奎,3,汪思应
(1.安徽医科大学基础医学院,合肥 230032;2.安徽医科大学临床学院,合肥 230032;3.Case Western Reserve University,Cleveland,USA,44106)
近年来,我国肿瘤发病呈现明显的高发早发趋势,怀疑系环境污染及基因突变相互作用的结果。一方面环境污染通过引发基因突变致癌,另一方面,基因突变的机体可能对环境污染更加敏感而易发生肿瘤。环境污染物有很多种,其中包括因采矿、废气污染、污水灌溉及使用重金属制品导致的重金属污染[1]。根据流行病学调查,我国水源污染物中砷和镉排在首位。重金属污染物主要通过氧化应激,激活 NF-κB、AP-1、HIF-1 等的信号分子及氧化损伤造成基因突变,导致细胞恶性转化,促发肿瘤,基因突变也可能通过信号途径异常活化及遗传不稳定性导致细胞恶性转化促发肿瘤[2]。但这些仅仅初步解释了肿瘤高发的一些问题,对于肿瘤早发并没有答案。我们推断:环境污染促发基因突变,而携带基因突变的细胞或机体对环境污染更加敏感,可能是促进肿瘤早发的主要原因。我们前期研究已经发现SHP-2激活突变的细胞在重金属污染物诱导下,更容易发生恶性转化,携带SHP-2激活突变的小鼠在环境因素诱导下更易发生肿瘤[3]。SHP-2是一个含有两个SH2结构域的酪氨酸磷酸酶,在各组织中广泛表达,被激活时,活化的蛋白通过酪氨酸磷酸化位点与SH2结构域结合或C端的2个酪氨酸位点磷酸化活化结合自身的SH2结构域发挥活性[4,5],影响NF-кB、JAK-START、PI3K 等信号途径。已经发现SHP2多种激活突变参与多种肿瘤的发生发展[6-8]。但激活突变SHP2与环境污染污染物联合协同作用的机制不清,阐明之有助于解决肿瘤高发和早发问题。但肿瘤发生的分子机制很复杂,其中miRNA是新近发现的可能参与包括肿瘤在内的多种疾病发生发展的主要分子之一,miRNA也就是通常所说的微小核糖核甘酸,是一类非编码的单链RNA,大约含有18~25个核苷酸[9]。研究发现,它主要是通过与靶mRNA的3’-UTR区完全或部分结合从而使靶基因降解或沉默,进而影响肿瘤的发生和发展,发挥了类似于癌基因或抑癌基因的作用,同一个miRNA可能同时调控几个不同的mRNA,同一个mRNA也可以受到几个不同的miRNA的调节,类似于基因密码子的匹配机制,因此,人体内大约有30%的蛋白受到miRNA的调控,在细胞内形成了一个非常大的网络[10],MiRNA的发现为肿瘤的研究提供了一个新视野,很多研究发现,microRNAs与肿瘤细胞的增殖、凋亡及迁移等都有着密切的关系[11],miRNAs异常表达可能参与了环境因素促发肿瘤的过程。因此,本研究为了初步探测miRNAs在肿瘤形成中的作用,建立了环境及基因突变的MEFs细胞,基因芯片技术检测砷处理48h后的MEFs细胞和SHP2D61G/+突变的MEFs细胞的miRNA表达谱,探讨miRNAs表达变异情况,并选取两个变异趋势随砷处理和基因突变一致的两个 miRNA做 RT-PCR检测,发现mmu-miRNA-100的表达随处理递减;mmu-miRNA-1907的表达随处理递增,为我们进一步研究miRNA在致瘤中的机制做准备。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
DMEM、FBS(均为 GIBCO公司生产,美国)、三氧化二砷(为Sigam公司生产,美国)、RT-PCR试剂盒、引物(为上海吉玛公司生产,中国上海)、总 RNA提取试剂 和Trizol(为Invitrogen公司生产,美国)、倒置显微镜(Olympus IX71,日本)、CO2恒温培养箱(Thermos公司,美国)。
1.1.2 实验动物
SPF级C57BL/6品系SHP2D61G/+小鼠,6周龄,雌/雄,体重18~20 g,美国 Case Western Reserve大学瞿成奎教授赠送,由安徽医科大学动物中心繁育【SCXK(皖)2011-002】,在安徽医科大学实验动物中心无特定病原体(specific-pathogen free,SPF)的饲养间【SYXK(皖)2011-007】饲养,所有实验操作程序均经过实验动物研究所实验动物使用管理委员会批准(LLSC211-002)。
1.2 方法
1.2.1 细胞培养
MEFs细胞以DMEM+10%FBS培养,培养基内含100IU/mL青霉素和链霉素,细胞在5%CO2,37℃恒温细胞培养箱内培养。
1.2.2 MEFs细胞建立及永生化
取雌雄小鼠合笼交配,第二天早上观察雌鼠的阴道口,若有阴道栓表明已怀孕0.5 d,待胚胎6.5 d后解剖雌鼠,在超净台操作,以高压灭菌的PBS清洗分离胚胎,制备胚胎组织块,分别接种不同的培养皿,细胞在10%FBS的DMEM培养基中,37℃,5%CO2培养24 h,SHP2+/+MEF即组织周围伸展生长出的细胞,留取细胞继续培养并以SV40T抗原进行永生化备用;SHP2D61G/+MEFs细胞制备方法类似:取雌雄SHP2D61G/+小鼠合笼交配,同样的分离6.5 d的胚胎,制备组织块接种不同的细胞培养皿,并且留取部分组织做基因型鉴定,根据基因型鉴定结果留取SHP2D61G/+的MEFs细胞,继续培养并以SV40T抗原进行永生化备用。
1.2.3 重金属化合物As2O3处理MEFs细胞
美国是教育强国,其药学教育也处于世界领先地位,美国的药学教育研究一直为其他国家所借鉴。在英国教育升学组织(Quacquarelli Symonds,QS)2018年公布的世界药学与药理学学科前300名中,有70所美国高校上榜[1]。本文通过对近5年的《美国药学教育杂志》进行文献统计,了解其主要研究内容、研究现状及研究方法,为我国高等药学教育研究的发展提供参考与借鉴。
取1×106对数期生长的MEFs细胞接种于75 cm2培养瓶,待细胞贴壁后,以 0.5 μmol/L As2O3处理48 h,以PBS洗三遍,加胰酶消化细胞,待细胞变圆后加入细胞培养基终止消化,吹打细胞后收集至离心管中900 r/min离心,弃上清,以PBS冲洗三次。以Trizol试剂盒提取细胞及组织总RNA,1 mL的Trizol裂解1×107个细胞,之后,在1 mL的Trizol中加入 200 μL 氯仿,震荡 10 s,冰置 3 min,4℃,12000 r/min离心10 min,小心吸取上层水相至1.5 mLEP管中,加等量或稍多的异丙醇,轻轻颠倒混匀3 次,冰置10 min,4℃,12000 r/min 离心10 min,弃上清,加75%乙醇,4℃,7500 r/min离心15 min,弃上清,75%乙醇重复洗涤一次,弃上清,室温晾约5 min,加入约50 μL DEPC水冰上溶解,紫外分光光度计测定其浓度,-80℃保存。
1.2.4 miRNA芯片杂交分析
因为miRNA仅含有二十个碱基左右,特异性很高,因此,每个miRNA需用两条引物才能识别,每条引物只能识别miRNA序列的一半,一条引物携带标示序列Tag,另一条引物携带T7启动子序列,只有两条序列都与miRNA完全匹配才能形成RNA/DNA杂合体。之后,以磁珠分离出RNA/DNA杂合体,在T4连接酶的作用下,连接为一个DNA片段再转录,转录的RNA序列再与含有不同miRNA序列的膜杂交,加入含有辣根过氧化物酶HRP的亲和素反应,最后加入发光底物进行测定。
1.2.5 聚合酶链式反应RT-PCR
以吉玛提供的 MiR-RT primers引物、2 μL RNA、4 μL RT Buffer、0.75 μL dNTP、0.2 μLMMLV或AMV、DEPC水配成20 μL反应体系,反应条件为16℃,30 min,42℃,30 min,85℃,10 min,逆转录产物保存在-20℃。逆转录产物稀释3~4倍后取2 μL 或4 μL 作为模板,作体系为20 μL 或40 μL 的PCR反应,20 μL体系的反应混合物包含2×PCR Buffer 10 μL、miR specific Primer set(5 μM)0.35 μL、miRNA RT product、2 μL、Taq DNA polymerase(5 u/μL)0.2 μL、加 ddH2O 至 20 μL。反应条件为:95℃变性3 min后,95℃,12 s,62℃,50 s,40 个循环,5%TAE琼脂糖凝胶电泳检测。
1.2.6 统计分析
SPASS13.0统计软件对数据进行方差分析,数据采用均数±标准差(±S)表示,每个试验指标均重复3次,数据进行方差分析,以P<0.05为差异显著。
2 结果
2.1 miRNA芯片杂交分析 As2O3对 SHP2+/+MEFs细胞miRNA表达谱的影响
2.2 miRNA芯片杂交分析As2O3对SHP2D61G/+MEFs miRNA表达谱的影响
收集 0.5 μmol/L As2O3处理 48 h的 SHP-2D61G/+突变的 MEFs细胞,提取总 RNA,做 miRNAs芯片杂交分析,观察miRNAs表达谱变化情况,筛选出表达差异明显者,并选取二十个变异明显的miRNAs做前期报道,如图2所示,20个miRNA表达出现明显变化,且变异亦皆在两倍以上。
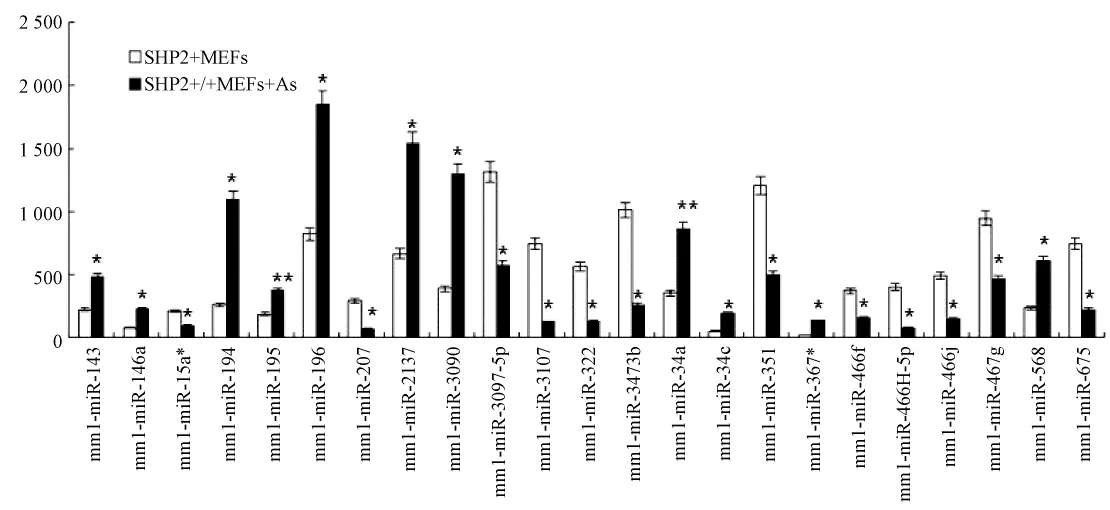
图1 miRNAs表达谱芯片杂交分析结果Fig.1 The result of miRNAs expression profiling of SHP2+/+MEFs
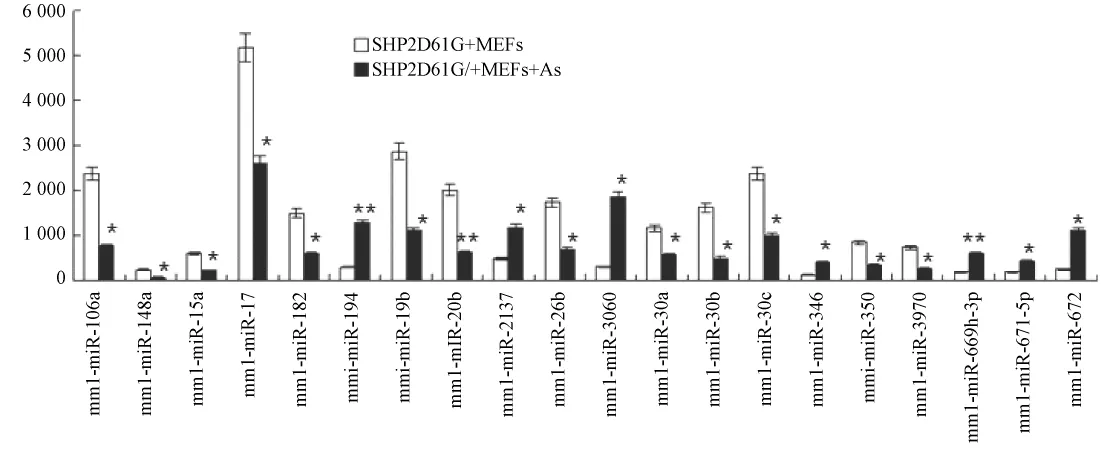
图2 miRNAs表达谱芯片杂交分析结果Fig.2 The result of miRNAs expression profiling of SHP2D61G/+MEFs
2.3 受环境因素和基因因素影响一致的miRNAs
在对miRNAs表达谱进行分析的过程中发现有的miRNA在三氧化二砷诱导和基因突变影响下出现一致的变化,如图3,在 SHP2+/+MEFs、SHP2+/+MEFs+As、SHP2D61G/+MEFs、SHP2D61G/+MEFs+As四种细胞中mmu-miR-100表达递减,mmu-miR-1907表达递增。
2.4 聚合酶链式反应RT-PCR检测mmu-miRNA-100和mmu-miRNA-1907表达
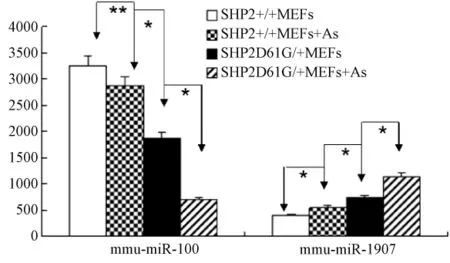
图3 miRNAs变异趋势分析Fig.3 The analysis of miRNAs trend
提取 SHP2+/+MEFs、SHP2+/+MEFs+As、SHP2D61G/+MEFs、SHP2D61G/+MEFs+As 四种细胞的总RNA,不同的引物扩增 mmu-miR-100和 mmumiR-1907,以5%的琼脂糖凝胶电泳拍照分析,如图4,mmu-miRNA-100 表 达 在 SHP2+/+MEFs、SHP2+/+MEFs+As、SHP2D61G/+MEFs、SHP2D61G/+MEFs+As四种细胞中表达递减,mmu-miRNA-1907表达递增。
3 讨论
肿瘤是近几年的一个研究热点,是一类严重威胁人类健康的疾病,全世界每年有癌症病人约4500万,新发病例1300万,每年因癌症死亡的约800万,我国的癌症发病率居世界第二[12]。肿瘤从本质上说是细胞的基因失去对正常生长和凋亡控制导致的异常增生,据卫生部统计显示,我国恶性肿瘤发病率一直呈上升趋势,患病人数不断增加,且有年轻化的趋势,对人类健康的危害极大,因此,探讨肿瘤发生机制是医学研究领域的一个热点问题。
诸多研究表明,肿瘤发生是环境因素和遗传因素共同作用的结果,其中环境因素主要包括环境污染和不良生活习惯等,环境因素中的某些有害物质如重金属污染物、尼古丁和酒精等可通过诱发机体的氧化应激,产生大量氧自由基,损伤细胞遗传物质,激活体内某些信号途径,导致细胞的异常增殖和凋亡障碍[13,14]。随着现代化进程的加速,环境污染日益严重,人们的面临的生活压力和生活习惯也发生了重大变化,致使肿瘤发病率不断提高,但肿瘤早发的原因并不清楚,我们推断:一方面环境污染通过促进基因突变致瘤,另一方面基因突变的机体或对环境因素更加敏感,可能是导致肿瘤发病人群年轻化的主要原因,对于探讨肿瘤发生发展的机制意义重大。
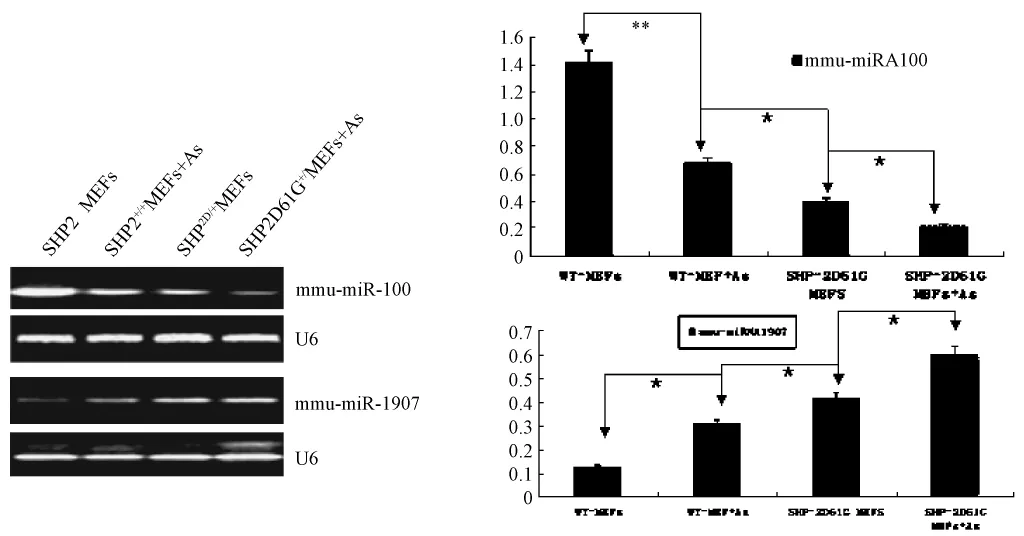
图4 RT-PCR结果分析Fig.4 The results of RT-PCR analysis
MicroRNA是人类基因组计划实施以来作为基因非编码序列一员受到最多关注的一个,最早发现的 miRNA 是在线虫中的 let-4和 let-7[15,16]。自被发现以来,诸多研究者通过实验研究发现上千种miRNA。MiRNA表达上具有阶段性和组织特异性,这种特异性对机体正常生长发育起到重要调节作用,对发挥其自身的调控作用也意义重大[17],研究表明,它与多种肿瘤的发生密切相关,如白血病、乳腺癌、宫颈癌等[18]。MiRs主要是通过与靶 mRNA的3’-UTR区完全或部分互补结合从而使靶基因降解或沉默,进而影响肿瘤的发生和发展,发挥了类似癌基因或抑癌基因作用。MiRs与多条信号通路密切相关,比如重要的抑癌基因P53,又如细胞抗凋亡BCL-2蛋白家族等[19]。在我们的研究中,首先是以miRNA芯片杂交技术筛选出数十种变异明显的miRNA,并分析变化趋势,有的miRNA在SHP2+/+MEFs、SHP2+/+MEFs+As、SHP2D61G/+MEFs、SHP2D61G/+MEFs+As四种细胞中呈现一致的变化趋势,如 mmu-miR-100表达逐渐减少、mmu-miR-1907表达逐渐增多,通过RT-PCR实验验证得到的结果与芯片杂交分析结果一致,验证了芯片杂交结果的可靠性。
三氧化二砷处理的 SHP2+/+MEFs细胞和SHP2D61G/+MEFs细胞中变化趋势一致的两个miRNA(mmu-miRNA-100、mmu-miRNA-1907),其生物学功能在国内外文献中都尚未报道,这是我们寻找参考资料的一个难点,同时也是我们研究的一个创新所在,我们将通过生物学信息预测及荧光素酶报告基因等方法寻找其作用靶点,探讨它们所参与的信号通路,进一步了解它们在细胞增殖、凋亡、迁移和侵袭等生物学行为中发挥的作用。此外,我们将探讨这两个miRNA在临床病人癌组织相对癌旁组织中的表达差异,对其在人类肿瘤发生中的作用进行验证,阐明它们在肿瘤形成、发展中的作用及机制,使得本文的研究有所新发现。
[1] 重金属污染综合防治分析.中国投资研究网.2012[2012-09-14].http://baike.baidu.com/view/282970.htm.
[2] Veuger StephanyJ.,DurkaczBarbara W. Persistence of unrepaired DNA double strand breaks caused by inhibition of ATM does not lead to radio-sensitisation in the absence of NF-κB activation[J].Discover Ref doc,2011,10(2):235 -244.
[3] Siying Wang,Wen-Mei Yu,Wanming Zhang,et al.Noonan syndrome/leukemia-associated gain-of-function mutations in SHP-2 phosphatase (PTPN11)enhance cellmigration and angiogenesis[J].J.Biol.Chem.,2009,284(2):913 -920.
[4] Zhong-Qing Shi,Carmen R.Sunico,et al.Lipton S-nitrosylated SHP-2 contributes to NMDA receptor-mediated excitotoxicity in acute ischemic stroke[J].PNAS,2013,110(8):3137-3142.
[5] Dan Xu,Siying Wang,Wen-Mei Yu,et al.A germline gain-offunction mutation in Ptpn11 (Shp-2)phosphatase induces myeloproliferative disease by aberrant activation of hematopoietic stem cells[J].Blood,2010,116(18):3611 - 3621.
[6] Grossmann KS.The tyrosine phosphatase Shp2 in development and cancer[J].Cancer Res,2010,106:53 - 89.
[7] Bouyain S,Watkins DJ.Identification of tyrosine phosphatase ligands for cont-actin cell adhesion molecules[J].Commune Integer Biol 2010,3(3):284 -286,.
[8] Serra V,Scaltriti,L Prudkin,et al.PI3K inhibition results in enhanced HER Signaling and acquired ERK dependency in HER2-over-expressing breast cancer[J].Oncogene,2011,30,2547-2557.
[9] 王海林,刘嘉琳,宗园媛,等.Mir-106b对阿尔茨海默病昼夜节律调控的初步研究[J].中国比较医学杂志,2010,20(4):19-23.
[10] David P.Bartel.MicroRNAs:Target Recognition and Regulatory Functions[J].Cell.,2009,136,(2):215 – 233.
[11] Carlo M. Croce. CausesandconsequencesofmicroRNA dysregulation in cancer[J].Nature Reviews Genetics,2009,10:704-714.
[12] Ne Long, Malcolm Moore, Wanqing Chen, et al. Cancer Epidemiology and Control in North-East Asia-Past,Present and Future[J].Asian Pacific Journal of Cancer Prevention,2010,10:107-148.
[13] Zdenko Herceg,Thomas Vaissière.Epigenetic mechanisms and cancer:An interface between the environment and the genome[J].Epigenetics,2011,6(7):804 -819.
[14] JE Klaunig,LM Kamendulis,BA Hocevar.Oxidative stress and oxidative damage in carcinogenesis[J].Toxical Pathol,2010,38:(1)96-109.
[15] Shruti,K.Shrey,R.Vibha.MicroRNAs:Tiny sequences with enormous potential[J].Biochemical and Biophysical Research Communications,2011,407,(3),15:445 – 449.
[16] Pai-Sheng Chen,Jen-Liang Su,Shih-Ting Cha,et al.MiR-107 promotes tumor progression by targeting the let-7 microRNA in mice and humans[J].J Clin Invest.,2011,121(9):3442–3455.
[17] Joshua T.Mendell,Eric N.Olson.MicroRNAs in Stress Signaling and Human Disease[J].ell,2012,148(6):1172 – 1187.
[18] Thaliana Farazi, Jessica I Spitzer, Pavel Morozov, et al.miRNAs in human cancer[J].The Journal of Pathology,2011,223,(2):102–115.
[19] 刘鹏,王晓映,高宁,等.G蛋白偶联受体激酶5在稳定表达α—Synuclein的SHSY5 Y细胞中的基因表达调控功能[J].2010,20(2):6 -11.

