用典型植物监测环境中有机氟污染物的可行性
张 鸿,陈清武,姚 丹,柴之芳,沈金灿
1)深圳大学物理科学与技术学院,深圳518060;2)深圳大学生命科学学院,深圳518060;3)天津科技大学食品工程与生物技术学院,天津300457;4)中国科学院高能物理研究所,北京100049;5)深圳出入境检验检疫局食品检验检疫技术中心,深圳518045
全氟化合物 (perfluorinated chemicals,PFCs)指碳链上氢原子全部被氟取代后形成的一类人造疏水疏油性有机氟化物.PFCs因其优良的表面活性被广泛用于防污剂、乳化剂和涂料等领域,随着全氟辛烷磺酸盐 (perfluorooctane sulfonate,PFOS)、全氟辛酸 (perfluorooctanoic acid,PFOA)被增列入持久性有机污染物 (persistent organic pollutants,POPs)黑名单[1],PFCs成为全球优先控制的污染物.PFCs可与植物蛋白结合并蓄积,如PFOA和PFOS可富集于小麦等,并在作物和水土间运移[2].植物扎根于土壤,暴露于大气,不迁移回避,环境污染物可经根部吸收、干湿沉降以及表皮或气孔吸收等途径进入植物体[3],因此,典型植物可用于指示环境中某类污染物的暴露风险[4].
为探究典型植物对环境中PFCs的指示作用,应用高效液相色谱-质谱联用 (high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)技术分析了苔藓、樟树、马尾松、唐菖蒲、地衣、苜蓿、银桦和杜鹃8种植物鲜叶中13种PFCs的残留水平,从中选择残留水平高且残留种态丰富的苔藓为典型植物;进而应用循环中子活化分析 (cyclic neutron activation analysis,CNAA)与HPLC-MS/MS相结合的方法,研究了深圳市宝安、南山、福田、罗湖、盐田和龙岗6区12个位点苔藓中总氟 (total fluorine,TF)、可萃取有机氟(extractable organic fluorine,EOF)和PFCs,旨在通过苔藓评价深圳市PFCs残留分布特征,探讨苔藓指示环境中PFCs暴露风险的可行性.
1 材料与方法
1.1 主要仪器和试剂
应用微型中子源核反应堆(深圳大学核技术研究所)和高纯锗γ谱仪 (GMX35190,Ortec)分析TF和EOF总量;应用HPLC-MS/MS联用仪 (Agilent 1100-API 3000,美国 AB公司)分析 PFCs种态;实验用甲醇(美国Baker J T公司)、甲基叔丁基醚 (methyl tert-butyl ether,MTBE;美国Sigma公司)、甲酸(美国Dikma公司)和醋酸铵(美国Dikma公司)为色谱纯,氨水 (纯度为25%,比利时Acros公司)和四丁基硫酸氢铵(tebrabutylammonium hydrogen sulfate,TBA;纯度>99%,美国百灵威公司)为优级纯;水为18.2 MΩ·cm的超纯水;标样为茶叶标准参考物质 (GBW10016,地球物理地球化学勘查研究所)、氟化钾基准物质 (纯度>99%,比利时Acros公司)和购自加拿大Wellington公司的PFCs混合外标与内标.13种PFCs混合外标用甲醇逐级稀释为5、10、20、40和60 μg/L 5个质量浓度,用于HPLC-MS/MS标准工作曲线.8种混合内标用甲醇稀释至200 μg/L,备用[5].
1.2 样品采集与制备
苔藓、樟树、马尾松、唐菖蒲、地衣、苜蓿、银桦和杜鹃共8种植物的鲜叶采集于2010年3~4月深圳市仙湖植物园;深圳市宝安、南山、福田、罗湖、盐田和龙岗6区12个位点 (图1)的苔藓(硬叶羽苔:Plagiochila asplenioides(L.)Dum.)采集于2011年11月10~17日,每份样品鲜质量约300 g.采集的样品经超纯水清洗后冷冻干燥至恒重,粉碎后放入聚丙烯瓶,室温下干燥器中保存备用.称取约20 mg苔藓粉末,热封于聚乙烯薄膜袋后再热封于跑兔管中,待CNAA分析TF;取约1 g苔藓粉末于50 mL离心管中,加入30 mL 0.1 mol/L的碱甲醇溶液,摇床振荡16 h后离心15 min(25℃,5 000 r/min),上清液转移至另一50 mL离心管,残渣加入10 mL甲醇,重提2次,合并上清液,氮吹浓缩至5 mL,取1 mL热封于聚乙烯管后,再热封于跑兔管中,待CNAA分析EOF.准确称取约1 g植物粉末于50 mL离心管中,加10 ng PFCs混合内标和30 mL 0.1 mol/L的碱甲醇溶液,依EOF相同流程萃取.合并的上清液用氮吹至干,加入5 mL超纯水、5 mL 0.5 mol/L的TBA、10 mL 0.25 mol/L的K2CO3和20 mL MTBE,摇床振荡30 min后,离心15 min(25℃,5 000 r/min),醚相移至另一50 mL离心管,水相用15 mL MTBE重提2次,合并醚相,氮吹至干,甲醇定容至1 mL,HPLC-MS/MS分析PFCs种态.
图1 深圳市6区12位点苔藓采样分布图Fig.1 Distribution of moss sampling sites in Shenzhen
1.3 分析
CNAA 在9 ×1011n·cm-2·s-1中子通量下,照射时间(ti)=测量时间(tc)=30 s,冷却时间(td)=等待时间 (测量结束到下次照射的时间间隔,tw)=2 s,循环7次.测量1 633 keV处20F的γ能峰.Gamma Vision(ORTEC)采集谱图,WinSpan(2010)解谱,TF和 EOF分别以茶叶标参 (GBW10016,57 μg/g)和 KF标准溶液 (50 μg/mL)为标准,相对法定量.
HPLC使用Agilent Eclipse XDB C18(2.1 mm×150 mm ×3.5 μm)分析柱,进样体积20 μL;MS/MS使用API3000三重四极杆串联质谱系统,选择电喷雾负离子化和负离子扫描多反应监测模式,内标法定量.HPLC-MS/MS分析条件与PFCs目标化合物的质谱参数详见文献[5].
1.4 质量控制和保证
CNAA分析条件下,TF空白本底和EOF空白流程的γ谱图均未见1 633 keV能峰,同时,苔藓样品GammaVision谱图显示,其Na和F质量浓度比值≤5,低于Na和F干扰的比值下限 (≥8),故源自本底和苔藓中23Na(n,α)20F的干扰可忽略.基于3 m(bDc)1/2/sDc(m为F的质量;bDc为本底计数;sDc为1 633 keV能峰计数),苔藓中TF和EOF的检测限分别为 0.58 μg 和 0.20 μg.
为控制外源性污染,PFCs分析均采用经甲醇淋洗后的聚丙烯器皿,同时进行全程空白实验,空白基质为碱甲醇反复提取后的苔藓粉末残渣,所有结果均为扣除空白基质后的数据.PFCs分析流程在10 μg/kg加标质量分数水平下,13种PFCs回收率范围为78%~122%,变异系数范围为1.5%~17%,符合美国EPA的要求(100±40)%.在5~80 μg/L质量浓度范围内,13种PFCs线性相关系数(R2)在0.990 7~0.999 7之间,检测限范围为0.01~0.65 ng/L,满足分析要求.
2 结果和讨论
2.1 PFCs典型植物的筛判及环境意义
基于PFCs易与生物体内蛋白质结合并蓄集的特点,选择分布广泛、叶片寿命长兼顾富氟、或富含蛋白质的唐菖蒲、苜蓿、银桦、杜鹃叶片以及具POPs指示作用的苔藓[6]、地衣[7]、樟树[8]、马尾松[9]为研究对象,13种 PFCs的分析结果 (表1,以干质量计)显示,8种植物叶片中总PFCs残留水平呈苔藓≫地衣>马尾松、苜蓿>唐菖蒲>杜鹃、银桦、樟树的分布.就检出的11种PFCs而言,PFCs单体残留水平及检出率普遍以苔藓最高,表明相同环境条件下,苔藓富集PFCs的能力位居8种植物之首,其原因应与苔藓独特的结构密切相关.苔藓无茎、叶的分化,没有维管束组织和真正的根,全靠从大气及干湿沉降中获得水分和营养,其叶片的腹背两面均无蜡质表层,气孔无法闭合始终开启,加之气孔孔径 (7 ~30 μm ×1 ~6 μm)[10]允许PM10和PM2.5等大气颗粒物及超细颗粒物进入,利于大气中污染物的吸收,令苔藓体现出富集环境中PFCs的显著优势.地衣和苔藓虽同为大气污染物的指示植物,但地衣是由真菌和藻类组成的共生植物,真菌对PFCs的降解作用[11],可能是地衣中PFCs残留显著低于苔藓的重要原因.而唐菖蒲、苜蓿、银桦、杜鹃、樟树和马尾松6种植物鲜叶中PFCs残留量低于苔藓、地衣的原因,应与其叶片随季节更迭脱落及其叶片气孔随光照、温湿度等条件变化而开闭,致PFCs富集时间受限,以及叶片表面均覆盖着蜡质表层,不利于疏水疏油的PFCs吸附与吸收有关.
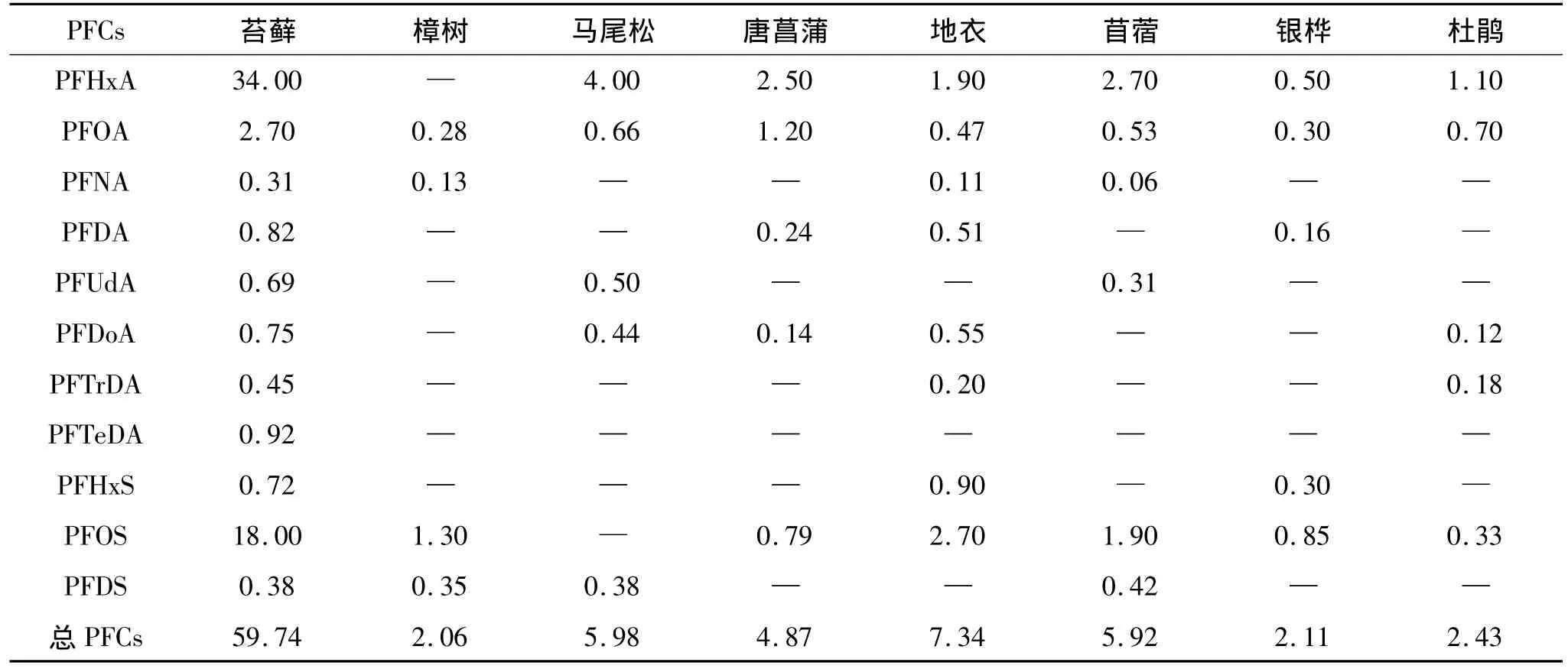
表1 八种植物叶片中PFCs残留水平 (干质量)Table 1 Residue levels of PFCs in eight plant leaves(dry weight) 单位:μg/kg
生物指示物指能通过典型症状或可衡量的反应揭示污染物存在与否的生物体或生物反应.许多对污染物敏感的植物都可以作为环境污染的生物指示物.利用植物对污染物的生物富集作用,通过分析污染物的含量来判断污染状况也正是生物指示物最广泛的应用之一.苔藓具有富集PFCs的优势,2~5年的生命期及在热带、温带和寒带的广泛分布使苔藓的采集不受季节和地域限制,适合监测环境中的PFCs.此外,苔藓作为生物指示物,不存在采样器对于电力和监测站布点的依赖,因此,可实现郊野环境的监测.
表2 苔藓中TF、EOF和IF质量分数(±s)(干质量,n=3)Table 2 Contents(dry weight,n=3)of TF,EOFand IF in moss(±s)单位:mg/kg
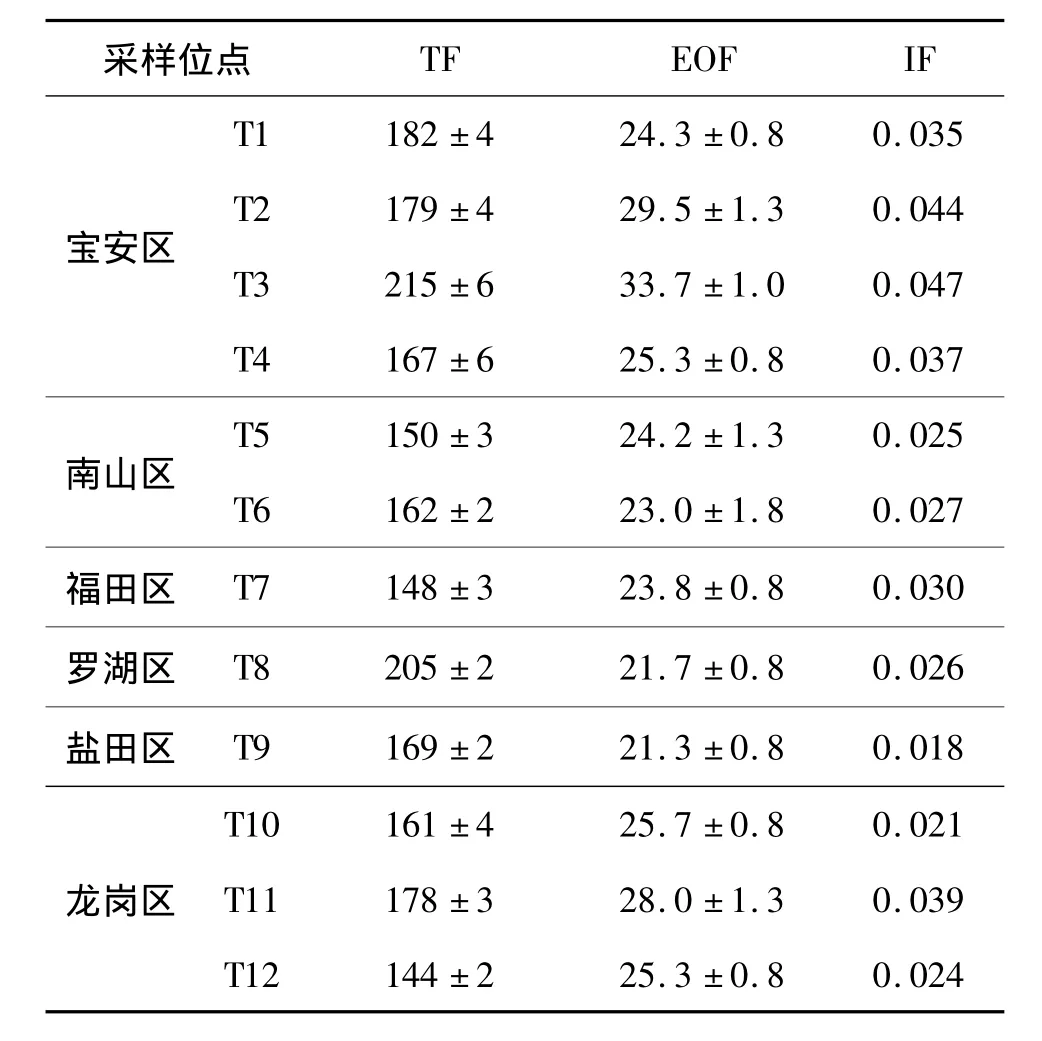
表2 苔藓中TF、EOF和IF质量分数(±s)(干质量,n=3)Table 2 Contents(dry weight,n=3)of TF,EOFand IF in moss(±s)单位:mg/kg
采样位点TF EOF IF宝安区T1 182 ±4 24.3 ±0.8 0.035 T2 179 ±4 29.5 ±1.3 0.044 T3 215 ±6 33.7 ±1.0 0.047 T4 167 ±6 25.3 ±0.8 0.037 T5 150 ±3 24.2 ±1.3 0.025南山区T6 162 ±2 23.0 ±1.8 0.027福田区T7 148 ±3 23.8 ±0.8 0.030罗湖区T8 205 ±2 21.7 ±0.8 0.026盐田区T9 169 ±2 21.3 ±0.8 0.018龙岗区T10 161 ±4 25.7 ±0.8 0.021 T11 178 ±3 28.0 ±1.3 0.039 T12 144 ±2 25.3 ±0.8 0.024
2.2 苔藓中TF、EOF和可鉴别F的分布规律
深圳市6区12个位点苔藓中TF、EOF和可鉴别氟 (identified fluorine,IF,即以氟计量的总PFCs)的分析结果 (表2,以干质量计)显示,TF、EOF和IF的质量分数范围分别为144~215、21.3~33.7和 0.018~0.047 mg/kg,EOF占 TF的13.4%~16.5%,表明无机氟为苔藓中氟的主要存在形态,与茶叶中氟的形态分布[12]相符;而IF仅占EOF的0.08%~0.15%,表明苔藓中≥99.8%的EOF仍属未知,尚待进一步研究.苔藓中TF、EOF和IF三者间spearman相关分析结果显示,IF与EOF呈正相关(P<0.05),表明苔藓中PFCs和EOF来源相似.
2.3 苔藓中PFCs残留特征与环境指示作用

表3 苔藓中PFCs的残留水平Table 3 Residue levels of PFCs in moss 单位:μg/kg
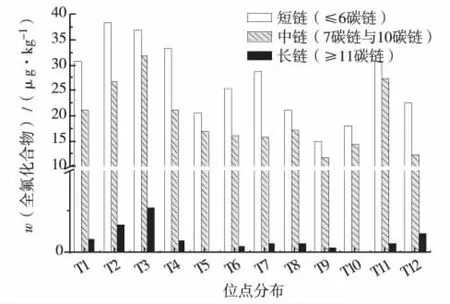
图2 苔藓中短链 (≤6碳链)、中链 (介与7碳链与10碳链)和长链 (≥11碳链)PFCs的残留分布Fig.2 Residue distribution of short-,medium-and long-chain PFCs in moss
深圳市12个位点苔藓中PFCs的残留水平 (表3,以干质量计)显示,苔藓中高残留、高检出的PFCs集中于中短链PFCs(≤10碳链),残留水平呈短链PFCs(≤6碳链) >中链PFCs(介于7碳链与10碳链)≫长链PFCs(≥11碳链)的分布(图2).PFHxA、PFOS和PFOA被100%检出,三者之和占总PFCs的88% ~99%,为苔藓中PFCs主要残留种态,与蔬菜和谷物中PFCs残留特征[13]相符.检出率≥50%的7种PFCs聚类分析结果进一步指出,PFOS(R2=0.460 3)、PFHxA(R2=0.345 8)和PFOA(R2=0.319 6)可作为利用苔藓评价环境中PFCs污染状况的典型种态.此外,苔藓中PFCs种态间spearman相关分析结果显示,PFOS、PFOA和PFHxA两两间呈显著正相关(P<0.01),表明苔藓中PFOS、PFOA和PFHxA具有相似的来源,这与大气及干湿沉降中PFCs的残留特征[14]相符.由于苔藓样品主要采自公园,受PFCs污染源的直接影响较小,故苔藓中PFCs残留特征及其典型残留种态PFOS、PFOA和PFHxA间的正相关关系,主要与苔藓依赖干湿沉降、露水和大气获取营养及水分密切相关.首先,PFCs相关产品的生产和使用过程会产生和排放全氟磺胺、全氟磺酰胺类PFCs前体物质,这些物质和中长链PFCs可进一步降解形成PFOS和PFOA[15],造成干湿沉降和大气中PFOS和PFOA的高残留及其正相关关系;其次,大气中挥发性氟聚醇 (fluorotelomer alcohols,FTOHs),如2-全氟己烷-乙醇、2-全氟辛基-乙醇等,可经植物代谢降解为PFOA[16],而PFOA受紫外线辐照或在光照条件下,可进一步降解形成PFHxA[17-18],进一步解释了苔藓中PFOA和PFHxA的高残留及其正相关关系.至于长链PFCs,因其挥发性和水溶性相对较弱,不易释放进入大气和水体,加之长链PFCs趋于降解为更稳定的中短链PFCs,环境本底较低,是致苔藓中长链PFCs检出率及残留水平均较低的原因.
深圳市宝安、南山、福田、罗湖、盐田和龙岗6区12个位点苔藓中PFCs残留水平的差异显示,最大值为71.54 μg/kg,出现在宝安区T3位点,最小值为26.99 μg/kg,位于盐田区T9位点.宝安区(T1、T2、T3和T4)及龙岗区T11位点苔藓中PFCs残留总量显著高于其他位点(P<0.01).研究指出,添加PFCs尤其是PFOA乳化剂的氟聚合物是汽车制造、服装皮革、半导体和微电子等产业的惯例[19],而宝安区众多的服装、电器和制造行业,以及距龙岗T11位点不足1 km的志达工业园内清洗、润滑和防污等表面活性剂的应用引起的PFCs排放所造成的污染,是导致宝安和龙岗T11位点苔藓中PFCs残留总量较高不容忽视的原因.此外,宝安区苔藓中较高的总PFCs残留还应与其地理位置与气侯条件有关.首先,宝安区位于深圳市西北,地处珠江和东宝河入海口交汇处西岸 (图1),北邻服装鞋袜、电器电子等产业高度密集的“世界工厂”广东省东莞市,由于东宝河是东莞与深圳两市工农业和生活污水的重要排放河道,而珠江流经广州入海,受PFCs污染物自上游向下游转移的影响,区域PFCs环境背景值较高;其次,据深圳市和东莞市气象局《2011年气候公报》,深圳盛行东南风,东莞盛行东北风,由于宝安区位于两市下风口,区域外PFCs输入显著;再次,大气中PFCs含量与气温成正相关[20],高温利于挥发性FTOHs类PFCs进入大气,由于深圳西部全年气温高于东部约1℃[21],也导致宝安区苔藓中PFCs残留水平较高.至于其他位点苔藓中PFCs残留则主要受PFCs相关产品使用更新所产生生活垃圾和污水等间接排放影响,主要表现为人口密度较高的南山区(T5和T6)、福田区 (T7)和罗湖区 (T8)苔藓中PFCs残留总量高于人口密度相对较低的龙岗区 (T10和T12),而盐田东部华侨城一带属远离工业区,人口稀疏且尚未开发的自然山地,与其对应的T9位点苔藓中总PFCs残留也最低.值得指出的是,深圳市环境监测中心站对宝安、南山、福田、罗湖、盐田和龙岗6区大气中PM10和PM2.5的监测结果显示,2011年下半年空气污染指数[22]与深圳市6区12个位点苔藓中PFCs残留水平的分布相符.可见,利用苔藓中PFCs的残留水平指示区域环境中PFCs的污染状况及其暴露风险是可行的.
结 语
在相同环境条件下,苔藓蓄积PFCs的能力显著高于地衣和马尾松、苜蓿、唐菖蒲、杜鹃、银桦及樟树叶.苔藓中氟化物以无机氟为主,EOF为辅,绝大部分EOF仍有待鉴别.苔藓中PFCs主要残留种态为PFOS、PFOA和PFHxA,三者之和占总PFCs的88% ~99%.基于深圳市宝安、南山、福田、罗湖、盐田和龙岗6区12个位点苔藓中PFCs残留水平的变化,解析深圳市环境中PFCs的分布特征及其成因,表明利用苔藓监测环境中PFCs污染物水平、指示其暴露风险是可行的.
/References:
[1] Wang Yawei,Cai Yaqi,Jiang Guibin.Research processes of persistent organic pollutants(POPs)newly listed and candidate POPs in Stockholm Convention [J].Scientia Sinica Chimica,2010,40(2):99-123.(in Chinese)王亚韡,蔡亚岐,江桂斌.斯德哥尔摩公约新增持久性有机污染物的一些研究进展 [J].中国科学:化学,2010,40(2):99-123.
[2] Stahl T,Heyn J,Thiele H,et al.Carryover of perfluorooctanoic acid(PFOA)and perfluorooctane sulfonate(PFOS)from soil to plants[J].Archives Environment Contamination and Toxicology.2009,57(2):289-298
[3] Collins C,Fryer M,Grosso A.Plant uptake of non-ionic organic chemicals[J].Environmental Science and Technology,2006,40(1):45-52.
[4] Bohme F,Welsch-Pausch K,Mclachlan M S.Uptake of airborne semivolatile organic compounds in agricultural plants:field measurements of interspecies variability [J].Environmental Science and Technology,1999.33(11):1805-1813.
[5] Chen Qingwu,Zhang Hong,Chai Zhifang,et al.Residue characteristics and distributions of perfluorinated compounds in surface seawater along Shenzhen coastline [J].Environment Science,2012,33(6):1795-1800.(in Chinese)陈清武,张 鸿,柴之芳,等.深圳市沿岸表层海水中全氟化合物的残留特征及其分布规律 [J].环境科学,2012,33(6):1795-1800.
[6] Galuszka A.Distribution patterns of PAHs and trace elements in mosses Hylocomium splendens(Hedw.)B.S.G.and Pleurozium schreberi(Brid.)Mitt.from different forest communities:A case study.south-central Poland [J].Chemosphere,2007,67(7):1415-1422.
[7] Ockenden W A,Steinnes E,Parker C,et al,Observations on persistent organic pollutants in plants:implications for their use as passive air samplers and for POP cycling [J].Environmental Science and Technology,1998,32(18):2721-2726.
[8] Shi Shuangxin,Zeng Liangzi,Zhou Li,et al.Polybrominated diphenyl ethers in camphor bark from speedy developing urban in Jiangsu Province[J]. Evironmental Science,2011,32(9):2654-2660.(in Chinese)史双昕,曾良子,周 丽,等.江苏经济高速发展城市香樟树皮中的多溴联苯醚 [J].环境科学,2011,32(9):2654-2660.
[9] Zhao Y L,Yang L M,Wang Q Q,et al.Modeling persistent organic pollutant(POP)partitioning between tree bark and air and its application to spatial monitoring of atmospheric POPs in mainland China[J].Environmental Science and Technology,2008,42(16):6046-6051.
[10] Hao Fushun.Zhiwu Qikong Shengwuxue[M].Zhengzhou:Henan University Press,2009:1-6.(in Chinese)赫福顺.植物气孔生物学 [M].郑州:河南大学出版社,2009:1-6.
[11] Wang N,Bogdan S B,Buck R C,et al.Fluorotelomer alcohol biodegradation:direct evidence that perfluorinated carbon chains breakdown [J].Environmental Science and Technology,2005,39(19):7516-7528.
[12] Hideki H,Tadahiro N,Toshihiro M,et al.Determination of the chemical form of fluorine in tea infusions by19F-NMR [J].Bioscience,Biotechnology and Biochemistry,1992,56(9):1474-1475.
[13] Haug L S,Salihovic S,Jogsten I E,et al.Levels in food and beverages and daily intake of perfluorinated compounds in Norway [J].Chemosphere,2010,80(10):1137-1143.
[14] Maria I B,Olga P,Joaquim B,et al.Determination of per-and polyfluorinated substances in airborne particulate matter by microwave-assisted extraction and liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2011,1218(30):4847-4855.
[15] Kert R R,Elisabeth M-L J,Richard G L,et al.Aerobic biotransformation and fate of N-ethyl perfluorooctane sulfonamidoethanol(N-EtFOSE)in activated sludge [J].Environmental Science and Technology,2008,42(8):2873-2878.
[16] Wang N,Szostek B,Buck R C,et al.Fluorotelomer alcohol biodegradation-direct evidence that perfluorinated carbon chains breakdown [J].Environmental Science and Technology,2005,39(19):7516-7528.
[17] Hori H,Yamamoto A,Hayakawa E.Efficient decomposition of environmentally persistent perfluorocarboxylic acids by use of persulfate as a photochemical oxidant[J].Environmental Science and Technology,2005,39(7):2383-2388.
[18] Park H.Photolysis of aqueous perfluorooctanoate and perfluorooctane sulfonate [J].Revue Roumaine DE Chimie,2010,55(10):611-619.
[19] Angela Yuchen Lin,Sri C P,Chaochun Lo,et al.The impact of semiconductor,electronics and optoelectronic industries on downstream perfluorinated chemical contamination in Taiwanese rivers [J].Environmental Pollution,2009,157(4):1365-1372.
[20] Jahnke A,Ahrens L,Ebinghaus R,et al.Urban versus remote air concentrations of fluorotelomer alcohols and other polyfluorinated alkyl substances in Germany [J].Environmental Science and Technology,2007,41(3):745-752.
[21] 深圳市气象局.2011年深圳市气侯公报[EB/OL].(2012-01-01)[2012-12-21].http://www.szmb.gov.cn/article/QiHouYeWu/qhgcypg/qhgb/2012/01/01/4efee117675c6.html.Meteorological Bureau of Shenzhen Municipality.Shenzhen Climate Bulletin of 2011[EB/OL].(2012-01-01)[2012-12-21].http://www.szmb.gov.cn/article/Qi-HouYeWu/qhgcypg/qhgb/2012/01/01/4efee117675c6.html.
[22] 深圳人居环境委员会.2011年空气质量报告[EB/OL].(2012-11-01 ~2012-11-30)[2012-12-21].http://www.szhec.gov.cn/pages/szepb/kqzl/kqzlrbByDay-List.jsp#.Committee of Shenzhen Residential Environment.Air Quality Report of 2011[EB/OL].(2012-11-01 ~2012-11-30)[2012-12-21].http://www.szhec.gov.cn/pages/szepb/kqzl/kqzlrbByDayList.jsp#.

