北京市密云县野栖鼠感染田鼠巴贝西虫的检测*
王振生 王小梅 窦相峰 李 旭任海林 刘 娟 卜玲毅 王 恒**
(1. 中国医学科学院基础医学研究所,北京协和医学院基础学院病原生物学系,北京 100005;2. 北京市疾病预防控制中心,北京 100013)
巴贝西虫是经过蜱媒传播的人兽共患寄生原虫,有近100种巴贝西虫在野生或家养动物种群中广泛传播,主要侵染牛、马、羊、犬以及鼠等哺乳动物,哺乳动物宿主感染巴贝西虫后会造成体温升高、溶血性贫血、血红蛋白尿,严重感染病例可造成死亡。巴贝西虫病流行呈世界性,流行范围较广的主要包括分布在欧洲各国的分歧巴贝西虫Babesiadivergens和分布在北美洲的田鼠巴贝西虫,前者以牛为重要保虫宿主,流行面积最广,对畜牧业危害严重,后者以感染野栖鼠为主(Vannieretal., 2012)。除此之外还有牛巴贝西虫B.bovis、犬巴贝西虫B.canis及马巴贝西虫B.equi的局部流行。在我国,巴贝西虫感染分布广泛,近年来在新疆(简子健等, 2011)、青海(马利青等, 2012)、浙江(姜理平等, 2012)、云南等多个省份的哺乳动物体内都检测到巴贝西虫病原体。分歧巴贝西虫和田鼠巴贝西虫均可感染人体,主要是通过蜱媒叮咬(Kjemtrupetal., 2000; Walsh, 2013)或输血感染(Saito-Itoetal., 2000; Kimetal., 2007),患者临床症状轻重各异,根据个体的免疫功能强弱,其虫血症有较大范围的波动。近年来在我国人体感染巴贝西虫病例逐渐增多(王惠萱, 2012; 姚立农等, 2012)。野栖鼠是田鼠巴贝西虫重要的保虫宿主,其感染状况在一定程度上反应了蜱媒分布情况及巴贝西虫病在野生动物宿主种群内的流行状况。北京周边地区是野栖鼠及蜱媒分布的重要区域(李建民等,2002;吕燕宁等,2011),但其所传播病原体分布及流行情况缺乏文献资料。本文就北京市密云县辖区野栖鼠巴贝西虫感染状况进行初步检测及虫种分析,为进一步大规模筛查该虫在北京周边地区流行情况提供基础性资料。
1 材料和方法
1.1 野栖鼠捕捉及组织DNA提取
2012年6月于北京市密云县辖区坡地通过夹夜法对野栖鼠进行捕捉,使用中型鼠夹,在同一自然生境中布放,每日下午4~6时成行布放鼠夹,夹距5 m,行距20 m,共布放100只,次晨7~9时收回,连续布放3日,捕捉的鼠生物学分类后,无菌采集心、肺脏组织液氮保存,同时心脏取血制作薄血涂片。采用基因组提取试剂盒(上海生工,上海)进行基因组DNA样本提取。
1.2 吉姆萨染色及镜检
薄血涂片样本作好标注并自然晾干后,加甲醇固定1 min,再次晾干后于血液样本表面覆盖吉姆萨染色液染色30 min,清水冲掉染液,晾干后100×油镜下观察。
1.3 聚合酶链式反应(PCR)扩增及产物测序
根据Armstrong (1998)等人的报道,针对田鼠巴贝西虫核糖体小亚基编码基因的特异性片段设计上下游PCR引物,P1 5′-AATACCCAATCCTGACACAGGG-3′, P2 5′-TTAAATACGAATGCCCCCAAC-3′,PCR反应体系:50 μL,分别为10×buffer 5 μL,2.5 mol/L dNTP MIX 2 μL,2 mol/L MgSO4溶液 2 μL,Taq聚合酶 1.5 μL (宝生物,大连),上下游引物P1、P2各1 μL, 模板3 μL,加双蒸水补齐至50 μL体系。 反应条件:94℃预变性 5 min;94℃ 45 s,55℃ 45 s,72℃ 45 s,40个循环;72℃延伸10 min。使用ATCC来源的田鼠巴贝西虫Peabody mjr株作为阳性对照,PCR产物进行1%琼脂糖电泳,1 μg/mL溴化乙锭(Ethidium bromide,EB)染色5 min并在312 nm紫外光下观察条带。扩增产物经过琼脂糖凝胶电泳进行分离,切取产物条带后使用凝胶回收试剂盒(上海生工,上海)进行纯化回收,将纯化片段送上海生工生物公司用其上游引物P1进行Sanger测序。
1.4 DNA序列分析和进化树构建
将测序获得的序列信息提交到NCBI 核酸序列数据库,同时使用在线BLAST工具进行核酸序列比对,批量获得高度同源性序列,选取中国及周边国家采集并提交的田鼠巴贝西虫虫株序列及其他巴贝西虫虫种序列作为参考数据,采用邻位法(Neighber-Joining method)构建进化树。序列分析使用DNAMAN version7.0软件,构建进化树使用Mega5.2软件,其中bootstraps值为1 000。
2 结果
2.1 镜检巴贝西虫病原体
将15只野栖鼠从20~34进行编号并生物学分类,其中社鼠6只,黑线姬鼠Apodemusagrarius6只,小家鼠Musmusculus3只,相应薄血涂片在油镜下观察,发现23号社鼠血涂片可见疑似巴贝西虫感染。镜下可见虫体蓝染,位于红细胞内,呈圆形或椭圆形,直径在2~3 μm之间,中心有空泡不染色,胞质未见疟色素样颗粒,感染率为1.85%(图1),镜下未见巴贝西虫典型的马耳他十字样形态。
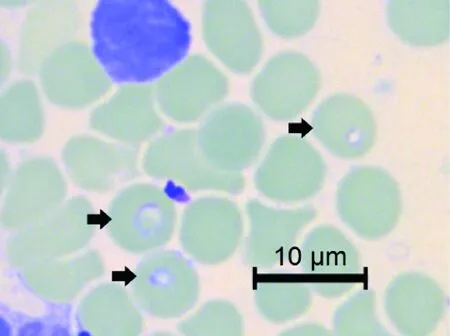
图1 23号鼠薄血涂片(吉姆萨染色,×1 000)(箭头标注为巴贝西虫感染红细胞)Fig.1 Thin blood smear of No.23 rodent (Giemsa’s stain,×1000)(Arrows indicate the Babesia infected erythrocytes)
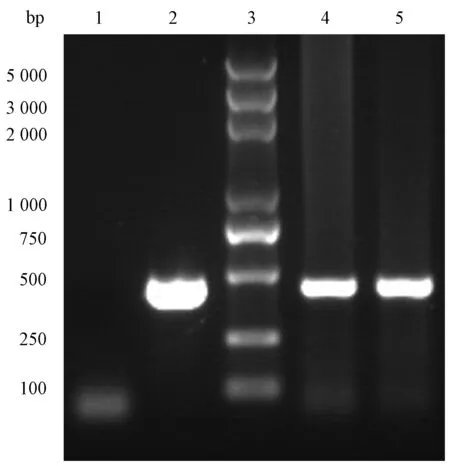
图2 PCR实验检测23号鼠心、肺样本内巴贝西虫特异DNA片段Fig.2 PCR test detects the specific segments of Babesia parasite genome in samples of heart and lung tissues from No.23 rodent1:阴性对照;2:田鼠巴贝西虫Peabody mjr株阳性对照;3:DNA分子标志物;4:心组织样本;5:肺组织样本。1: Negative control; 2: Positive control for Babesia microti Peabody mjr strain; 3: DNA molecular markers; 4: Sample of No.23 rodent’s heart; 5: Sample of No.23 rodent’s lungs.
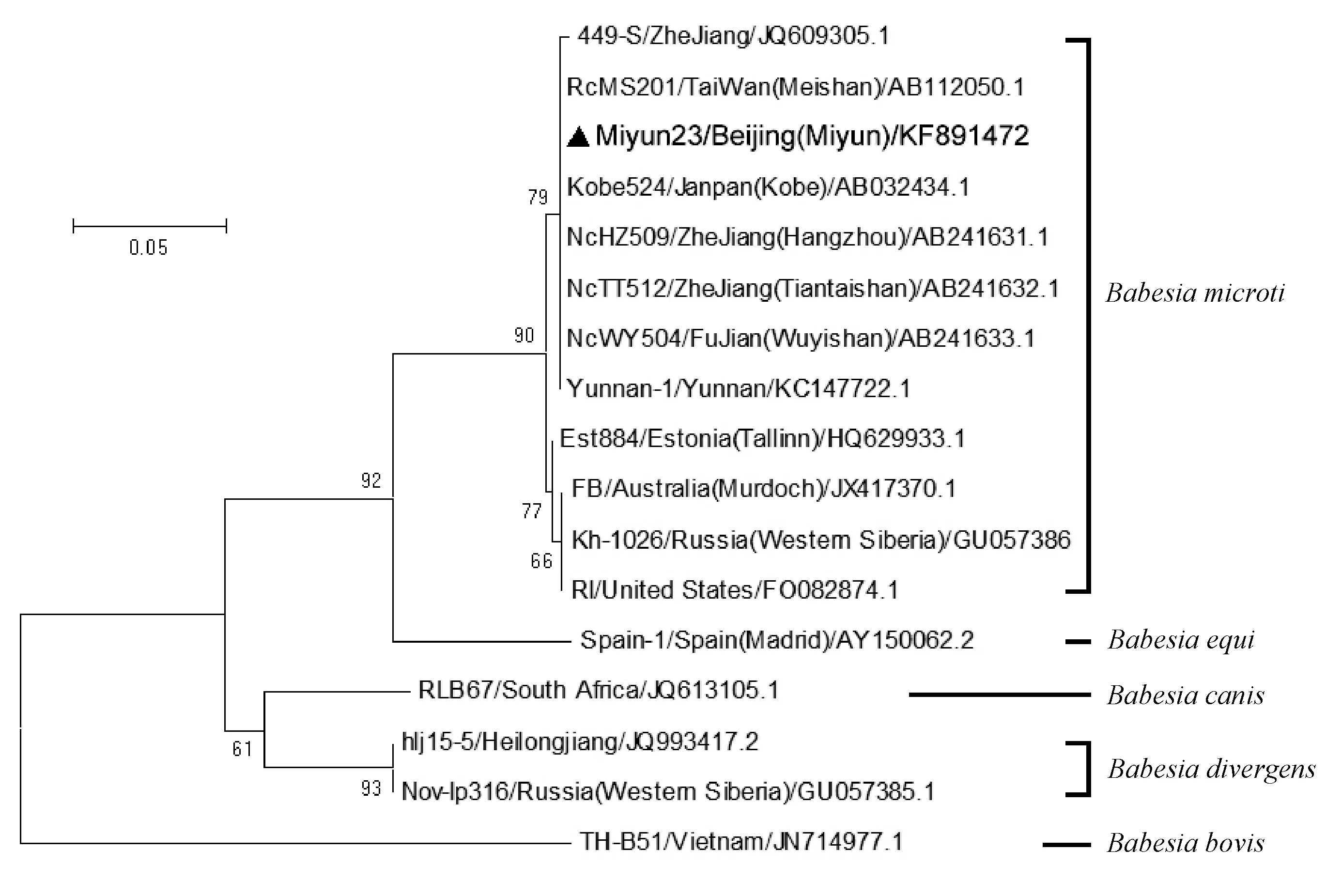
图3 基于邻位法构建的巴贝西虫核糖体小亚基特异片段进化树Fig.3 Phylogenetic tree of specific segment of ribosomal small subunit based on Neighbor-Joining method449-S:田鼠巴贝西虫中国浙江株B. microti strain isolated in Zhejiang Province, China;RcMS201:田鼠巴贝西虫台湾眉山地区株B. microti strain isolated in Meishan mount of Taiwan Province, China;Kobe524:田鼠巴贝西虫日本神户株B. microti strain isolated in Kobe City, Japan;NcHZ509:田鼠巴贝西虫中国浙江杭州株B. microti strain isolated in Hangzhou City of Zhejiang Province, China;NcTT512:田鼠巴贝西虫中国浙江天台山株B. microti strain isolated in Tiantai mount in Zhejiang Province, China;NcWY504:田鼠巴贝西虫中国福建武夷山株B. microti strain isolated in Wuyi mount in Fujian Province, China;Yunnan-1:田鼠巴贝西虫中国云南株B. microti strain isolated in Yunnan Province, China;Est884:田鼠巴贝西虫爱沙尼亚塔林株B. microti strain isolated in Tallinn City, Estonia;FB:田鼠巴贝西虫澳大利亚莫道克株B. microti strain isolated in Murdoch university of Australia;Kh-1026:田鼠巴贝西虫俄罗斯西西伯利亚株B. microti strain isolated in Western Siberia area, Russia;RI:田鼠巴贝西虫美国株B. microti strain isolated in United States;Spain-1:马巴贝西虫西班牙马德里株B. equi strain isolated in Madrid, Spain;RLB67:犬巴贝西虫南非株B. canis strain isolated in South Africa;hlj15-5:分歧巴贝西虫中国黑龙江株B. divergens strain isolated in Heilongjiang Province, China;Nov-lp316:分歧巴贝西虫俄罗斯西西伯利亚株B. divergens strain isolated in Western Siberia area, Russia;TH-B51:牛巴贝西虫越南株B. bovis strain isolated in Vietnam。
2.2 PCR鉴定虫种特异序列
对23号鼠的心、肺样本内含有的巴贝西虫虫种特异性片段进行PCR扩增,目的片段大小为420 bp,用实验室内传代的田鼠巴贝西虫Peabody mjr株作为阳性对照,琼脂糖凝胶电泳显示心肺样本均能检测特异性扩增的目的片段(图2),提示样本中存在巴贝西虫病原体。
2.3 进化树构建及虫种同源性分析
经过测序获得373 bp有效的虫种特异序列信息(提交于NCBI核酸序列数据库GenBank,序列名称:Miyun23,序列号:KF891472),为了进一步明确该巴贝西虫虫种的同源性,通过与GenBank公开序列进行同源性对比进行分析,显示该序列与牛巴贝西虫、犬巴贝西虫、分歧巴贝西虫同源性均低于60%,与马巴贝西虫的同源性为80.5%,说明该巴贝西虫种与上述虫种存在差异。进一步对比发现,该序列与来自美国的田鼠巴贝西虫RI分离株(Cornillotetal., 2012)、俄罗斯Kh-1026分离株(Raretal., 2010)、澳大利亚的FB分离株(Senanayakeetal., 2012)以及爱沙尼亚的Est884分离株(Katarginaetal., 2012)DNA序列同源性达98%以上,提示该虫种生物学分类属于田鼠巴贝西虫种,少量碱基序列的差别可能是虫株之间差别所致,分析发现该序列与鼠来源的田鼠巴贝西虫中国浙江NcHZ509株、福建NcWY504株、台湾眉山地区RcMS201株的核酸系列同源性为100%(Saito-Itoetal., 2008),同时与日本学者Saito-Ito等人报道的临床感染病例样本中分离得到神户Kobe524株的DNA序列同源性也为100%(Saito-Itoetal., 2000)(图3),说明此次检测到的北京市密云株与上述田鼠巴贝西虫属于同一虫株。序列对比发现该序列与中国云南Yunnan-1分离株同源性接近100%仅存在1个碱基的差异,提示中国境内流行的田鼠巴贝西虫虫株虽然同源性很高,但依然存在多样性。
3 讨论
自1957年欧洲报道世界第一例人体巴贝西虫病确诊病例以来,全世界范围内已经发现数百例巴贝西虫感染患者,由于巴贝西虫感染的自愈特征,实际感染率更高。我国境内巴贝西虫在哺乳动物体内感染的情况较为普遍,1944年洪式闾报道了重庆一例疑似疟原虫病例,后被确认为是我国巴贝西虫感染首例记录(瞿逢伊, 2007),近年来我国报告的巴贝西虫感染病例逐年增多(苏关关等, 2002; 王惠萱, 2012; 姚立农等, 2012),巴贝西虫临床感染逐渐被人们所认识。
鉴别巴贝西虫感染依赖于有效的检测技术,薄血涂片法及聚合酶链式反应检测具有简便、高效的特点,成为首选。综合采用这两种手段对巴贝西虫进行检测,将取得较好的结果。镜下观察可以有效缩窄病原体的可能范围,但由于巴贝西虫的红细胞寄生阶段与疟原虫红内期的环状体阶段形态极其相似,所以缺乏经验的工作人员往往难以区分。通过PCR检测巴贝西虫特异性片段能够有效地弥补薄血涂片检测的这一不足,其核糖体小亚基特异编码片段的扩增足以排除疟原虫感染的可能。因此两种检测手段的配合使用加大了巴贝西虫感染检测的准确性。
北京地理环境复杂,处于太行山脉,燕山山脉和华北平原三级地势交接处,客观提供了蜱媒及巴贝西虫野栖动物宿主赖以生存的地理环境(陈泽等,2008; 李建民等,2002),但巴贝西虫有效传播的可能性缺乏文献数据的支持。此次对北京市密云县捕获的15只野栖鼠进行了检测,其中1只社鼠确定为巴贝西虫感染阳性,提示北京郊区可能存在巴贝西虫的广泛流行。经过序列对比及同源进化分析发现该虫株核糖体小亚基编码基因的虫种特异性序列与中国浙江、福建、台湾等地田鼠巴贝西虫分离株相应序列完全一致(Saito-Itoetal., 2008),日本学者报道该虫株曾造成人体感染(Saito-Itoetal., 2000)。北京地区人口密集,生产生活节奏较快,人类活动范围逐年扩展,与蜱媒接触的机会不断增加,北京郊区田鼠巴贝西虫的感染可能成为向人群传播的潜在威胁。本文首次报道密云县野栖鼠存在巴贝西虫感染的情况具有重要流行病学意义,该数据提示有必要针对北京市周边田鼠巴贝西虫流行状况进行深入调查,加强北京地区临床疑似病例的筛查力度,为更科学地作好这一区域巴贝西虫感染的防控工作提供有力的数据支持。

