水红花子总黄酮的超声波提取及抗氧化性研究
张雁南,刘 刚,宋文爽
(吉林工程技术师范学院食品工程学院,吉林长春 130052)
黄酮类化合物(Falconoid),又称生物类黄酮(Bioflavoniod),早期是指具有乙-苯基吡喃酮结构的一类黄色素,现指具有色酮环与苯环为基本结构的一类化合物的总称[1]。黄酮类化合物广泛存在于植物中,是植物长期自然选择过程中产生的次级代谢产物[2]。黄酮类化合物具有抗氧化[2]、抗肿瘤[2]、抗糖尿病及其并发症[2]、抗病毒[1]等多种生物活性。黄酮类化合物广泛应用于医药、食品等领域,在食品中的可用作抗氧化剂、甜昧剂等[2],医药方面用于开发抗心血管病药物、抗肝脏毒素药、止咳平喘药等[1]。
水红花子为蓼科(Polygonaceae)蓼属(Polygonum)桃叶蓼组植物红蓼Polygounum orientale L.的干燥成熟果实[3]。药理研究报道水红花子具有抗肿瘤、抑菌、利尿作用,现代临床新用治疗肝硬化、乙型肝炎、抗凝血[3]。水红花子主要含有槲皮素、花旗松素等数种黄酮类成分[4]。
黄酮类化合物传统提取方法有有机溶剂提取、热水提取、碱性水或碱性稀醇提取、系统溶剂提取法等[5],新型提取技术有超声波提取法、微波提取法、酶解法、超临界流体萃取法、半仿生提取法等[5]。目前,关于水红花子总黄酮提取工艺研究的报道较少,本文进行了水红花子总黄酮的超声波提取及抗氧化性研究,旨在为水红花子功能成分的应用和生产提供数据依据。
1 材料与方法
1.1 材料与试剂
水红花子,采自长春市郊,除杂,于40℃干燥箱中干燥至恒重,粉碎后过40目筛。
95%(v/v)乙醇、亚硝酸钠、硝酸铝、氢氧化钠、硫酸亚铁、水杨酸、双氧水(均为分析纯,北京化工厂);芦丁标准品(纯度≥98%,中国药品生物制品检定所)。
1.2 仪器与设备
LK-400A型粉碎机(上海超亿制药机械设备有限公司);SHZ-DⅢ循环水真空泵(北京市永光明医疗仪器厂);FA2204B电子天平(上海精密科学仪器有限公司);UV2000紫外可见分光光度计(尤尼柯(上海)仪器有限公司);KQ-100DB型数控超声波清洗器(昆山市超声仪器有限公司);DHG-06-100B型电热恒温箱(武汉海声达仪器设备有限公司);DZKW-S-4电热恒温水浴锅(北京市永光明医疗仪器厂)。
1.3 方法
1.3.1 样品总黄酮提取液的制备和总黄酮含量的测定
以芦丁为标准样品,参照文献[6]进行标准曲线的绘制和样品提取液中总黄酮含量测定,得标准曲线方程y=0.0111x+0.0567,R2=0.9998。
精密称取水红花子粉末5.00g,加入乙醇溶液室温下浸泡一定时间后,在一定条件下超生波辅助提取一定时间,过滤,定容至250mL,精密吸取0.5mL样品提取液,测定吸光度,计算样品提取液中总黄酮的含量。

1.3.2 羟自由基(·OH)清除率测定[7-9]
向150mL的锥形瓶中依次加入浓度为6mmol·L-1的FeSO4溶液和H2O2溶液各30mL,混匀,加入6mmol·L-1水杨酸溶液45mL,37℃水浴下反应15min,然后在波长510nm处测定其吸光度A0;取5支比色管,依次向其中加入以上的测定体系7mL,之后分别向5支比色管中加入水红花子总黄酮提取液0.2、0.4、0.6、0.8、1.0mL,加蒸馏水定容到10mL,摇匀,在37℃水浴中反应15min,再于波长510nm处分别测定其吸光度Ax,以下式计算羟自由基清除率。

1.3.3 试验设计
1.3.3.1 单因素试验
基础条件:5.00g水红花子粉末、乙醇浓度55%(v/v)、料液比1:12(g·mL-1)、提取温度40℃、功率100W、提取时间30min、提取次数1次、浸泡2h。
各因素水平:乙醇浓度35、45、55、65、75、85、95%(v/v);提取温度20、30、40、50、60、70、80℃;超生波功率40、50、60、70、80、90、100W;提取时间5、10、20、30、40、50、60min;料液比1:6、1:9、1:12、1:15、1:18、1:21、1:24、1:27(g·mL-1);提取次数1次、2次、3次、4次;浸泡时间0、2、4、6、8、12、16、20、24h。
1.3.3.2 正交试验设计
根据单因素试验结果,选择对水红花子总黄酮提取效果影响较大的4个因素,进行L9(34)正交试验优化水红花子总黄酮的提取工艺。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对水红花子总黄酮提取量的影响

图1 乙醇浓度对总黄酮提取量的影响
由图1可知,水红花子总黄酮提取量随着乙醇浓度的增加呈现先上升后下降的趋势,在乙醇体积分数55%时提取量最大。因此选择乙醇浓度45%~65%(v/v)作为优化范围。
2.1.2 提取温度对水红花子总黄酮提取量的影响
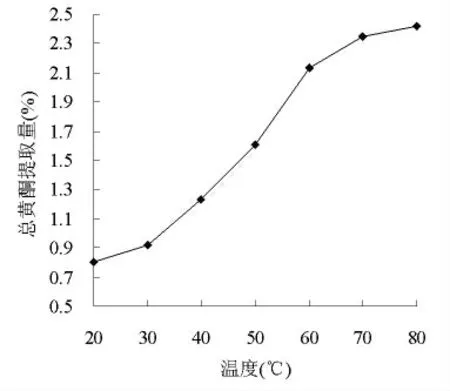
图2 提取温度对总黄酮提取量的影响
由图2可知,水红花子总黄酮的提取量随着温度的提高而增加,因此提高温度有利于总黄酮的提取。但是温度过高,一方面使其中的活性成分易受到破坏,杂质的溶出量增加,给后续操作带来不便,成本费用增大;另一方面造成溶剂损失[10]。本文使用的超声波清洗器最大操作温度为80℃,综合考虑,选择60~80℃作为提取温度的优化范围。
2.1.3 超声波功率对水红花子总黄酮提取量的影响

图3 超声波功率对总黄酮提取量的影响

图4 提取时间对总黄酮提取量的影响
由图3可知,总黄酮的提取量随超声波功率的增加而增加,因此超生波清洗器功率调整到最大功率100W为宜。
2.1.4 提取时间对水红花子总黄酮提取量的影响
从图4可知,提取时间30min之后水红花子总黄酮提取量增加缓慢,选择30~50min为提取时间的优化范围。
2.1.5 料液比对水红花子总黄酮提取量的影响
由图5可知,水红花子总黄酮提取量随着料液比的减小而增大,料液比降到1:18(g·mL-1)以下后,随提取剂用量的增加总黄酮提取量增加不大,因此选择1:15~1:21(g·mL-1)为料液比优化范围。
2.1.6 提取次数对水红花子总黄酮提取量的影响

图5 料液比对总黄酮提取量的影响

图6 提取次数对总黄酮提取量的影响
由图6可知,提取4次的提取量为2.01%,认为提取4次总黄酮提取完全。提取2次后,总黄酮提取量增加不大,提取2次的提取量为1.87%,占提取4次的总提取量的93%,再增加提取次数会浪费溶剂、浪费时间,因此确定提取次数为2次较为适宜。
2.1.7 浸泡时间对水红花子总黄酮提取量的影响

图7 浸泡时间对总黄酮提取量的影响
由图7可知,对原料先浸泡一定时间再超声波辅助提取,有利于黄酮类化合物的溶出,水红花子粉末浸泡16h时总黄酮提取量最大,继续延长浸泡时间杂质溶出量增加,干扰测定,曲线呈现下降趋势,因此浸泡时间选择在16h较适宜。
2.2 水红花子总黄酮提取工艺条件的优化
在超生波功率100W、浸泡2h、提取1次的条件下,进行L9(34)正交试验,正交试验因素水平见表1,正交试验结果见表2。

表1 正交试验因素水平表
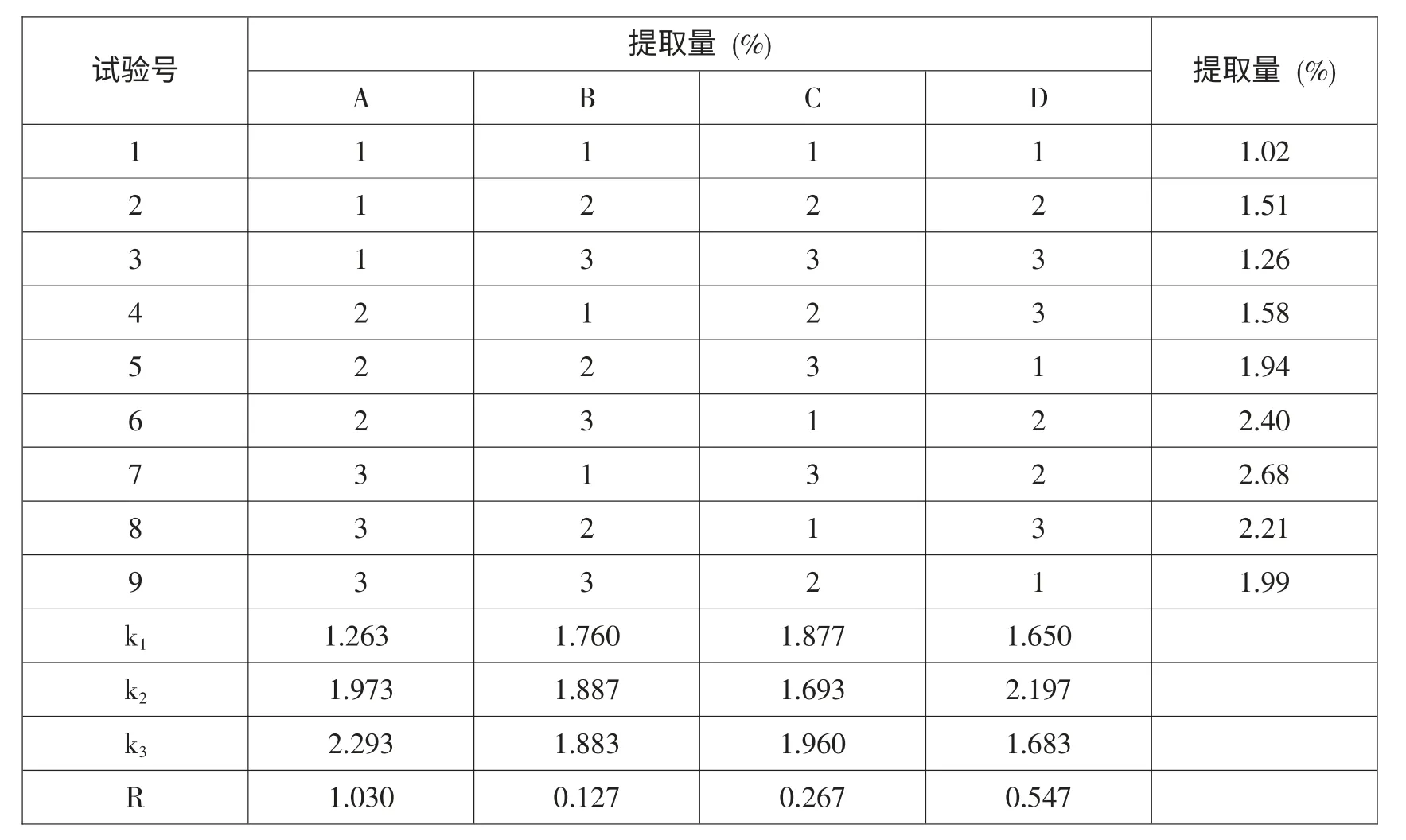
表2 L9(34)正交试验结果
由R可知,4因素对水红花子总黄酮提取效果的影响程度是A>D>C>B。比较k值大小得出最佳提取工艺条件为A3B2C3D2,此条件下提取1次的提取量为2.89%,大于表2中A3B1C3D2条件下的2.68%,因此确定水红花子总黄酮的最佳提取工艺条件为浸泡16h、超声功率100W、乙醇浓度55%(v/v)、提取温度70℃、料液比1:18(g·mL-1)、超声波辅助提取时间40min、提取2次,最佳条件下总黄酮的提取量为6.14g/100g。
2.3 羟自由基(·OH)清除率的测定
取5g水红花子粉末,在最佳提取工艺条件下提取总黄酮,提取液定容至250mL,稀释2倍,按照1.3.2节方法测定水红花子总黄酮对羟自由基(·OH)的清除率。由图8可知,水红花子总黄酮具有清除羟自由基(·OH)的能力。

图8 总黄酮对·OH的清除作用
3 结论
超声辅助提取技术(UAE)是利用超声波的强振动、高加速度、强空化效应、强搅拌作用来缩短天然产物有效成分进入溶剂的时间,加快提取过程,提高提出率,并有效避免高温对有效成分的破坏[11]。本文采用超生波辅助法提取水红花子总黄酮,利用正交试验确定最佳工艺条件为浸泡16h、超声波功率100W、乙醇体积分数55%、提取温度70℃、料液比1:18(g·mL-1)、超声波辅助提取时间40min、提取2次。羟自由基是已知最强的氧化剂,对细胞和组织的破坏作用最大[7],本文的抗氧化实验表明,水红花子总黄酮提取物对羟自由基(·OH)具有清除作用。
[1]耿敬章,冯君琪.黄酮类化合物的生理功能与应用研究[J].中国食品添加剂,2007(4):62-65.
[2]陈晓慧,徐雅琴.黄酮类化合物生物活性及在食品中的应用研究[J].食品工程,2006(3):12-14.
[3]翟延君,张淑荣,郝宁,等.水红花子研究概况[J].辽宁中医学院学报,2005,7(3):226-227.
[4]谢周涛,何再安,楼一层,等.水红花子黄酮类成分的HPLC指纹图谱研究[J].中药材,2006,29(10):1026-1028.
[5]陈丛瑾,黄克瀛,李德良,等.植物中黄酮类化合物的提取方法研究概况[J].生物质化学工程,2007,41(3):42-46.
[6]古丽娜尔·夏依马尔旦.几种中草药中总黄酮含量的测定[J].新疆师范大学学报,2009,28(1):67-69.
[7]王蓓蓓,牛付阁,段玉峰.高良姜与大高良姜总黄酮抗氧化活性比较研究[J].食品科学,2011,32(7):117-120.
[8]杨润亚,明永飞,王慧.无花果叶中总黄酮的提取及其抗氧化活性测定[J].食品科学,2010,31(16):78-82.
[9]靳菊清,丁冬宁,边晓丽.银杏叶多糖的化学及清除羟自由基作用[J].西安医科大学学报,2000,21(5):417-419.
[10]刘春花,高金锋,王鹏科,等.超声波法提取苦荞黄酮的工艺研究[J].西北农业学报,2009,18(1):281-284.
[11]杨昱,白靖文,俞志刚.超声辅助提取技术在天然产物提取中的应用[J].食品与机械,2011,27(1):170-174.

