针刺对离心运动性骨骼肌过度使用损伤的治疗研究
张学林 史冀鹏 高晓娟 周越 李俊平 王瑞元
1 曲阜师范大学体育科学学院(曲阜273165)
2 东北师范大学体育学院 3 郑州大学体育系
4 北京体育大学运动人体科学学院
过度使用损伤(overuse injury)是骨骼-肌肉系统长期受到重复应力、无足够时间恢复造成慢性损伤(chronic injuries)的结果,包括肌肉、神经、肌腱、韧带、关节、软骨、血管和椎间盘多处劳损部位,通常出现疼痛、麻木、无力等症状[1]。过度使用损伤是常见运动或职业骨骼-肌肉系统疾病,运动员及白领、蓝领工作者备受其害[2-8],严重干扰了日常工作和生活。
研究表明,骨骼肌超微结构损伤累积引起过度使用损伤,其机制主要是骨骼肌重复运动或过度使用导致骨骼肌超微结构损伤累积,进而造成肌束膜结构变化。肌束膜结构变化挤压了骨骼肌中的神经和血管结构,导致神经和血管结构损伤,最终造成骨骼肌过度使用损伤[9]。另有研究表明,针刺能快速恢复离心运动引起的骨骼肌超微结构损伤[10]。本实验采用张学林等[9]建立的离心运动引起的骨骼肌过度使用损伤动物模型,观察针刺是否通过恢复骨骼肌超微结构损伤,进而减轻肌束膜损伤程度,并进一步缓解骨骼肌神经纤维和血管所受的张力,最终治愈骨骼肌过度使用损伤,研究针刺对骨骼肌过度使用损伤的治疗效果。
1 材料与方法
1.1 实验动物及饲养条件
健康雄性Sprague-Dawley(SD)大鼠18只,体重(220±6.9)g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2006-0009。于北京体育大学科研中心动物实验室饲养、训练,动物使用许可证号:SYXK(京)2008-0009。大鼠分笼饲养,每笼3~4只,环境温度21~22℃,12 h光照/12 h黑暗交替,自由饮食(北京维通利华实验动物技术有限公司提供饲料)。大鼠训练前在屏障式动物房适应环境1周,期间未对大鼠进行急性或耐力训练。
1.2 实验设计和运动训练方案
运动方式:大鼠在动物跑台作下坡跑离心运动。
实验方案:18只雄性SD大鼠适应环境1周后,随机分成安静对照组 (C组,n=6)和训练组 (n=12)。两组饲养条件相同,安静对照组不进行离心运动。训练组大鼠适应性训练1周,跑台坡度、跑速和训练时间分别为:第 1、2 天 0°、16 m/min、10 min,第3、4 天-5°、16 m/min、15 min,第 5 天-10°、16 m/min、30 min;第6、7天休息。1周后进行4周正式训练,每周训练5天,周六、周日休息。跑台坡度、跑速和训练时间分别为:第 1 周-16°、16 m/min、60 min,第 2 周-16°、20 m/min、60 min, 第 3 周-16°、20 m/min、90 min,第 4 周-16°、20 m/min、90 min。
训练组第4周末次训练后,12只大鼠随机分成1周自然恢复组(1RG组,n=6)和1周针刺恢复组(1RAG组,n=6),1RG组大鼠不进行任何干预恢复措施,自然恢复1周;1RAG组大鼠1周恢复期内,每天用0.25 mm×25 mm的毫针斜刺两侧股四头肌,留针2 min。
1.3 标本取样
1周恢复后即刻取材。称重,用戊巴比妥钠(65 mg/kg)麻醉,冰浴下(冰盘)暴露大鼠后肢肌肉,取同侧股四头肌深层股中间肌(研究表明,离心运动导致了深层慢肌纤维损伤[11]),快速去除多余脂肪和结缔组织,再把股中间肌肌腹横切成三段,每段长5 mm,其中两段用冰浴(4℃)的3%戊二醛固定(0.1 mol磷酸缓冲液稀释,pH 7.2)过夜,以备透射电子显微镜和扫描电子显微镜观察;另一段用液氮预冷的异戊烷快速冷冻,之后放于-80℃超低温冰箱保存,用于免疫组化分析,观察骨骼肌结缔组织胶原纤维沉积变化和骨骼肌肌束膜、肌内膜胶原纤维浓度变化。本实验动物标本取材、免疫组化分析于北京体育大学骨骼肌实验室完成;透射电子显微镜和扫描电子显微镜观察于中国农业大学生命科学研究中心电镜实验室完成。
1.4 测试指标及方法
1.4.1 透射电子显微镜观察骨骼肌超微结构变化
取3%戊二醛固定的股中间肌,用0.1 mol磷酸缓冲液冲洗,之后用1%锇酸(0.1 mol磷酸缓冲液)后固定,再用0.1 mol磷酸缓冲液冲洗。后用丙酮系列脱水,环氧树脂Spurr包埋,LEICAUC6I型切片机纵切超薄切片,用醋酸双氧铀、柠檬酸铅双染色。JEM-1230透射电子显微镜观察全部6个样本的骨骼肌超微结构变化,包括线粒体结构和骨骼肌肌节结构变化。每个样本在×6000放大倍数下寻找损伤部位,随机选取10张在×15000放大倍数下拍摄的电子显微镜数码影像。骨骼肌超微结构变化量化采用 Dennett等[12]的方法(略作修改),用得分分值量化骨骼肌超微结构变化。评分标准为:肌膜下出现线粒体聚积且大小不一得1分;Z线水纹状、肌原纤维之间出现脂褐素或降解小体,符合其中任何一项得2分;线粒体肿胀、横跨两个Z线或呈晶格状,符合其中任何一项得3分。上述得分分值在同一样本中可累加,由此得出骨骼肌超微结构变化分值。
1.4.2 扫描电子显微镜观察骨骼肌神经、血管结缔组织结构变化
取3%戊二醛固定的股中间肌,0.1 mol磷酸缓冲液冲洗,在液氮内垂直断裂,之后用1%锇酸(0.1 mol磷酸缓冲液)后固定,再用0.1 mol磷酸缓冲液冲洗。乙醇系列脱水,醋酸异戊酯置换,临界点干燥(HITACHI HCP-2),离子溅射(EIKO IB-3)后,用扫描电子显微镜(HITACHI S-3400N)观察骨骼肌横断面胶原纤维沉积、神经结构和血管结构变化,以及纵断面胶原纤维结构变化。参考Dennett等[12]量化骨骼肌超微结构变化的标准,本实验自定骨骼肌神经、血管结构变化量化标准。采用得分分值量化非参数的骨骼肌神经和血管结构变化。评分标准为:骨骼肌神经束结缔组织破坏、神经纤维形状变化,符合其中任何一项得2分;血管闭锁、纤维化得2分。上述得分分值在同一样本中可累加,由此得出骨骼肌神经和血管结构变化分值。
1.4.3 免疫组化方法染色骨骼肌collagenⅠ——观察骨骼肌胶原纤维沉积
取冻存的股中间肌,用冷冻超薄切片机((Leica,Nussloch,Germany), 于-22℃把样本横切成厚 8 μm的薄片,置于载玻片上,风干大约30 min。用丙酮固定10 min后,磷酸缓冲液 (10mM磷酸钠,pH7.5,0.9%氯化钠)冲洗3次,每次5 min,之后用甲醇稀释的3%H2O2孵育30 min,淬灭内源性过氧化物酶活性;再用5%山羊血清孵育20 min,纸巾去除多余的封闭血清;用兔多克隆抗体大鼠collagenⅠ一抗(1∶200,Abcam)孵育 2 h,而阴性安静对照组用磷酸缓冲液替代一抗,用磷酸缓冲液冲洗3次,每次5 min,之后再用VECTASTAINABC (卵白素-生物素-过氧化物酶复合体法)试剂(Vectastain PK4001)孵育30 min,再用磷酸缓冲液冲洗3次,每次5 min。
DAB(3,3’-二氨基联苯胺)过氧化物酶底物试剂盒显色(Vectastain SK-4100)。严格按照试剂盒操作程序,滴加氯化镍,使collagenⅠ呈灰黑色显色,显色时间为10 min,用水冲洗5 min,终止显色;用苏木素精液复染(Vectastain H-3404),使肌核呈紫蓝色,显色30 s,用水龙头水冲洗直到无色;75%、85%、90%、95%(两次)、100%(两次)系列乙醇脱水,每梯度 2 min;二甲苯透明,4次,每次 2 min;风干后,用封片剂(Vectastain H-5000)封片。
用奥林巴斯IX71倒置电子显微镜 (日本),于10×20放大倍数下,选取collagenⅠ免疫组织化学每个样本4角和中央5个视野区域,用图像分析软件Image-Pro Plus 6.0读取骨骼肌collagenⅠ光密度值,量化collagenⅠ表达量。
1.5 统计学分析
所有数据用SPSS16.0统计软件包处理,数据用平均值±标准差 (±s)表示,显著性水平为P<0.05。①比较三组骨骼肌组织结构变化的统计学差异,采用多个独立样本的非参数检验的kruskal-Wallis H法分析统计学差异,多组比较后总体有差异,直接进行两两独立样本t检验。②单因素方差分析(ANOVA)比较三组骨骼肌collagenⅠ表达量的统计学差异,当方差齐性时,用Tukey post-hoc检验;当方差不齐性时,用Dunnett T3检验。
2 结果
2.1 骨骼肌超微结构
安静对照组骨骼肌超微结构排列整齐,肌纤维内线粒体有规律地排列在Z线两侧(图1A,白色箭头);肌膜下线粒体聚积,但大小均一(图2A,白色箭头)。进一步放大显微镜倍数发现,肌纤维内线粒体与肌浆网之间最近位点出现高电子密度小体,表明线粒体与肌浆网通过这一小体结合)(图3A,黑色箭头)。
4周下坡跑离心运动后,1周自然恢复组骨骼肌结构呈现病理性变化,与安静对照组相比有显著性差异(P<0.001)(表1)。1周自然恢复组骨骼肌超微结构紊乱,出现大面积肌原纤维降解、Z线消失、肌浆网肿胀、空泡现象(图1C、E,黑色箭头);肌膜下大量线粒体聚积,大小不一或形状异常,有巨大的线粒体(图2C,白色星号),也有非常小的线粒体(图2C,黑色箭头),个别线粒体呈同心圆状(图2B,白色箭头;图2$,白色星号),线粒体结构异常;肌纤维内线粒体变大、变圆,此类线粒体嵴稀少,且与线粒体纵轴平行,横跨两个Z线(图1G,黑色箭头;图1H,白色箭头),甚至出现类似晶格状形状(图1G,白色箭头;图1$)的严重的线粒体结构病变。
1周针刺恢复组骨骼肌超微结构变化与1周自然恢复组相比有显著性差异(P<0.01)(表1)。1周针刺恢复组结构、形态特征表现为:⑴骨骼肌超微结构排列较为整齐,肌原纤维降解面积减少 (图1B、D);⑵肌膜下大量线粒体聚积,与1周自然恢复组不同,针刺组肌膜下线粒体大小均一、电子密度大(图2D,白色箭头),且靠近肌膜的肌原纤维之间出现大量高电子密度的线粒体(图2F,白色箭头)[1周自然恢复组肌膜下线粒体没有向肌纤维内迁移的现象(图2E)],可能是肌膜下线粒体迁移至肌纤维内,进而进行能量供应和肌节重塑;⑶肌纤维内出现大量电子密度非常高的线粒体(图1B、D,白色箭头),无肿胀等形态异常(图1F,白色箭头)。线粒体在肌原纤维之间排列规律,呈现三种方式(图3C、D、E、F):①几个线粒体聚集在一起,或呈典型的小簇状 (图3C、D,白色箭头),或成排纵向位于肌原纤维之间(图3D,黑色箭头),或成排纵向位于肌膜内侧(图3C,黑色箭头);②线粒体在I带,不时见到在I带与肌原纤维呈横向(图3E、F,白色箭头)或纵向排列的线粒体(图3E,黑色箭头);③高电子密度的线粒体整齐定位于I带,分布在Z线两侧 (图3F,白色箭头)。放大显微镜倍数发现,高电子密度线粒体旁边出现高电子密度肌浆网(图3B,黑色箭头;图3$,白色星号),可能是新合成的三联体,且线粒体与肌浆网距离最近位点出现高电子密度小体(图3B,白色箭头;图3$,白色箭头),表明高电子密度线粒体与新合成的三联体结合。

图1 透射电子显微镜下观察三组骨骼肌超微结构变化(n=6)

图2 透射电子显微镜观察三组骨骼肌肌膜下线粒体结构变化(n=6)

图3 1周针刺恢复组骨骼肌纤维内线粒体排序特点(n=6)
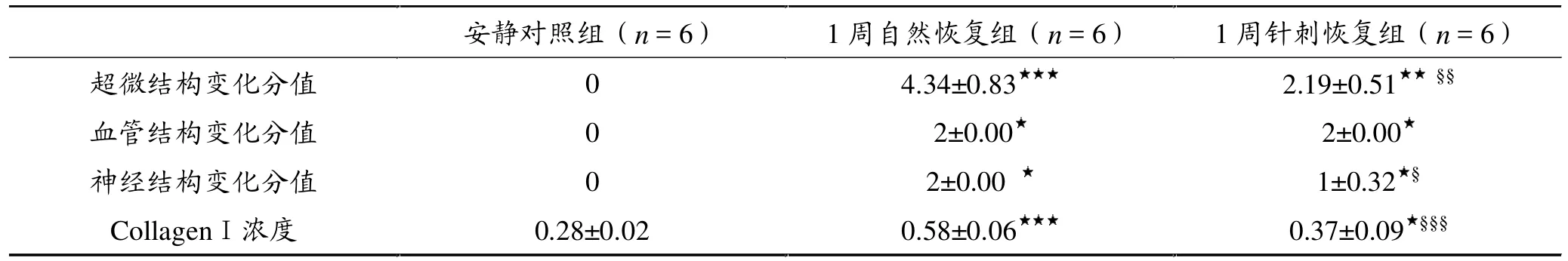
表1 三组骨骼肌组织结构变化分值和collagenⅠ浓度比较
2.2 骨骼肌肌膜结构变化
1周自然恢复组骨骼肌肌膜呈楔状损伤(wedge-shaped defect),即肌膜局部呈三角形状“delta”损伤(图4A,黑色箭头),1周针刺恢复组骨骼肌肌膜未发现楔状损伤(图4B,黑色箭头)。

图4 透射电子显微镜观察骨骼肌肌膜损伤变化(n=6)
2.3 骨骼肌神经纤维结构变化
1周自然恢复组骨骼肌神经组织结构发生变化,与安静组相比有显著性差异(P<0.05)(图5和表1)。安静对照组骨骼肌神经束膜结构完整,无胶原纤维增生(图5A,白色箭头),神经束内神经纤维排列整齐,呈圆柱体形状,中间为轴突,周围为髓鞘,结构完整,无挤压变形(图5A,白色星号)。1周自然恢复组骨骼肌神经束结构发生变化,神经束结构变形,神经束膜周围被胶原纤维蛋白包围(图5C,白色箭头),神经束膜内神经纤维结构变形,中间轴突、髓鞘呈现被挤压的痕迹,轴突较安静对照组小,髓鞘变厚,呈不规则形状(图5C,白色星号)。
1周针刺恢复组骨骼肌神经束膜结构变化与1周自然恢复组骨骼肌相似,神经束膜结构损伤 (图5D,黑色箭头),但神经束内个别神经纤维损伤结构已恢复,呈圆柱体状,圆润的轴突外包裹髓鞘 (图5D,白色箭头)。
2.4 骨骼肌血管结构变化
1周自然恢复组和1周针刺恢复组骨骼肌组织血管结构发生变化(图5和表1)。安静对照组骨骼肌组织血管结构完整,血管壁和管腔清晰可见,无淤血现象,周围无胶原纤维增生(图5B,白色星号)。1周自然恢复组和1周针刺恢复组骨骼肌血管结构发生变化,与安静组比较呈显著性差异(P<0.05)(表1),血管周围胶原纤维增生,呈纤维化现象(图5E、F,黑色箭头),血管闭锁,血管壁发生皱缩,管腔内被红细胞堵塞,呈圆盘状的红细胞清楚可见(图5E、F,白色星号),表明血管严重受损。
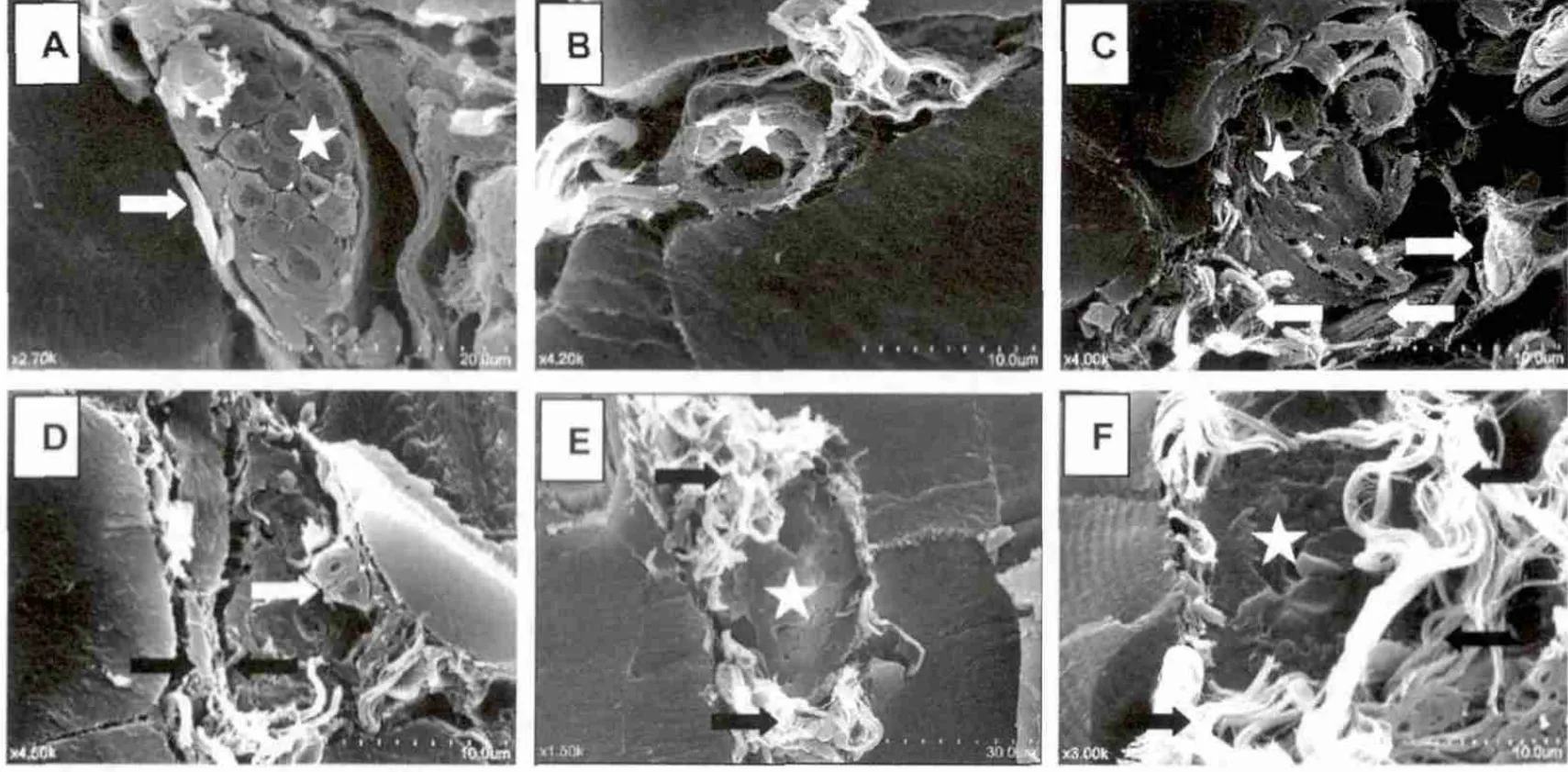
图5 扫描电子显微镜观察三组骨骼肌神经和血管结构变化(n=6)
2.5 骨骼肌肌内膜和肌束膜结构变化
安静对照组骨骼肌横切面肌内膜和肌束膜厚度一致,胶原纤维排列整齐,纤维丝粗细均匀、纹理清晰,胶原纤维束之间纤维丝虽有交叉衔接,但有规律,无相互缠绕的零乱现象(图6A,白色箭头;图6$);纵切面肌束膜胶原纤维呈卷曲、波浪状(图6B,白色箭头)。1周自然恢复组骨骼肌横切面肌束膜厚度增加,胶原纤维丝纹理凌乱,增生、沉积症状明显(图6C,白色箭头);纵切面肌束膜胶原纤维增生,胶原纤维丝紊乱(图6G,白色星号),且出现粗大胶原纤维索(图6E、G,白色箭头),表明肌束膜受力程度增加。1周针刺恢复组骨骼肌横切面肌束膜厚度小,胶原纤维沉积少,胶原纤维层胶原纤维纹理较清晰,走向清楚(图6D,白色箭头);纵切面肌束膜胶原纤维未见粗大胶原纤维索,胶原纤维丝走向清晰 (图6F、H)。

图6 扫描电子显微镜观察骨骼肌胶原纤维沉积变化(n=6)
2.6 骨骼肌collagenⅠ表达
1周自然恢复组骨骼肌collagenⅠ表达与安静对照组比较呈显著性差异 (P<0.001),1周针刺恢复组骨骼肌collagenⅠ与安静对照组比较呈显著性差异 (P<0.05),1周针刺恢复组骨骼肌collagenⅠ表达与1周自然恢复组比较有显著性差异 (P<0.001)(图7和表1)。1周自然恢复组骨骼肌肌内膜collagenⅠ表达少,但肌束膜厚度明显增加,大量collagenⅠ沉积,沿着厚度增加的肌束膜两侧,出现厚度增加的肌内膜,或者肌细胞死亡后被collagenⅠ替代,明显的肌束膜及其周围肌细胞损伤的症状(图7C)。1周针刺恢复组骨骼肌collagenⅠ在肌内膜和肌束膜表达均增加,肌束膜厚度增加减少,肌束膜周围无肌内膜厚度增加,或者死亡的肌细胞被collagenⅠ替代的现象(图7D)。
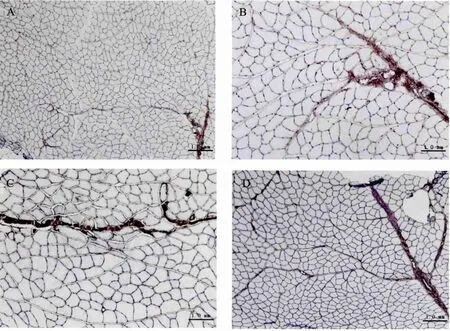
图7 免疫组化观察三组骨骼肌collagenⅠ增生(n=6)
3 讨论
3.1 针刺对离心运动性骨骼肌过度使用损伤的治疗作用
本实验发现,自然恢复组骨骼肌过度使用损伤症状严重,表现为骨骼肌超微结构病理性变化、骨骼肌神经和血管结构损伤、肌束膜胶原纤维沉积。针刺有效治疗了骨骼肌过度使用损伤症状,表现为快速恢复了骨骼肌超微结构的病理性变化,肌原纤维降解面积减少;线粒体结构异常现象不但减少,而且线粒体数量增加;骨骼肌神经束内损伤的神经纤维得以修复;大幅下调骨骼肌collagenⅠ浓度,极大减弱了肌束膜胶原纤维沉积。而针刺并不能恢复已损伤的骨骼肌血管结构。
针刺恢复骨骼肌超微结构损伤、下调collagenⅠ浓度,在骨骼肌和机体其他组织有类似研究结果[13-15],表明本实验中的针刺效应与其他研究结果相符。但本实验有新发现,针刺导致骨骼肌线粒体数量大幅增加,一方面是肌膜下线粒体大量聚积,聚积程度超过非针刺恢复组,且针刺组肌膜下线粒体电子密度高、大小均一,区别于非针刺组肌膜下聚积的线粒体结构异常,即大小不一,电子密度降低;另一方面是针刺组骨骼肌纤维内以及肌膜下聚积的线粒体内侧肌纤维内发现大量新合成的线粒体,非常有秩序的排列,呈现三种排列方式:⑴几个线粒体聚集在一起,或呈典型的簇状,或成排纵向位于肌原纤维之间或肌膜内侧;⑵位于I带的线粒体与肌原纤维呈横向或纵向排列;⑶整齐地定位于I带,分布在Z线两侧。这与骨骼肌发育期间的线粒体分布非常相似[16]。研究证实,骨骼肌损伤修复机制与骨骼肌生长发育机制相同[17]。这提示针刺治疗骨骼肌过度使用损伤与线粒体数量增加有关。
3.2 针刺治疗离心运动性骨骼肌过度使用损伤的机制
研究证实,骨骼肌发育期间,增生的线粒体可以在胞浆中迁移,迁移至Z线时与肌浆网结合,一方面抑制肌浆网Ca2+火花,稳定胞浆中Ca2+浓度,另一方面定位于Z线两侧,再通过遮蔽蛋白(obscurin)永久地锚靠于肌原纤维[16,18-20],起到促进肌节合成的作用。1周针刺恢复组骨骼肌肌膜下大量线粒体聚积,靠近肌膜内侧,以及肌纤维内出现大量线粒体,可能是肌膜下线粒体向肌纤维内部迁移的结果,且线粒体排列形态与与骨骼肌发育期间的线粒体分布非常相似。在高倍放大镜下进一步观察,发现高电子密度的线粒体旁边出现高电子密度的肌浆网,两者之间最近位点出现高电子密度小体,提示新合成的线粒体与新合成的肌浆网(三联体)结合。另有研究发现,剧烈运动或离心运动引起肌浆网自发性Ca2+火花或Ca2+漏现象[21],而针刺能快速下调骨骼肌离心运动后过载的胞浆Ca2+浓度[22]。这提示针刺可能通过某种未知机制促进肌膜下和肌原纤维间线粒体数量增加,进而加速与新合成的肌浆网(三联体)结合,阻止肌浆网Ca2+漏,稳定胞浆Ca2+浓度,改善损伤肌原纤维再生或重塑过程。本研究针刺组肌膜无楔状损伤支持了上述观点。针刺恢复组肌膜和基质膜未发现楔状损伤,而非针刺恢复组发现肌膜和基质膜呈楔状损伤。楔状损伤(wedge-shaped defect),即肌膜局部三角形状“delta”损伤[23],是胞浆 Ca2+过载诱发了线粒体大量活性氧生成,造成肌膜脂质和蛋白氧化损伤[24]。针刺引起线粒体与肌浆网结合抑制Ca2+漏,稳定了胞浆Ca2+浓度,解释了肌膜没有楔状损伤的原因。非针刺恢复组骨骼肌肌膜呈楔状损伤,可能是胞浆Ca2+过载导致线粒体生成活性氧过量的缘故。
恢复骨骼肌超微结构将使肌膜和基质膜受力程度减少,缓解其损伤程度。 依据张力整合学说[25,26],肌细胞内骨架蛋白、肌膜和肌膜外基质是张力整合体,当外力施加于肌细胞时,肌细胞内骨架结构改变以缓解肌膜受力程度,免受损伤。长期离心运动时,骨骼肌细胞内改变的超微结构没有时间重新组装,导致肌细胞内超微结构损伤累积,导致肌内膜、肌束膜胶原纤维沉积,以及骨骼肌内神经和血管结构损伤,发生离心运动性骨骼肌过度使用损伤。针刺快速恢复了骨骼肌超微结构变化,进而抑制了肌内膜、肌束膜胶原纤维增生。本研究中,非针刺恢复组骨骼肌collagenⅠ表达大幅增加,针刺恢复组collagenⅠ表达大幅度下调。观察免疫组化图片,非针刺恢复组骨骼肌肌束膜明显增加,collagenⅠ大量沉积,且在肌束膜周围出现肌内膜collagenⅠ沉积以及死亡的肌细胞被胶原纤维替代的现象。而针刺恢复组骨骼肌肌束膜厚度基本恢复,collagenⅠ沉积少,表明针刺通过恢复骨骼肌超微结构变化,缓解了肌束膜损伤程度,减轻了collagenⅠ沉积,治疗了离心运动引起的骨骼肌过度使用损伤。
4 总结
针刺通过快速恢复骨骼肌超微结构病理性变化,大幅度下调肌束膜collagenⅠ浓度,极大程度减弱了肌束膜胶原纤维沉积,修复损伤的神经纤维,有效治疗了离心运动引起的骨骼肌过度使用损伤症状,针刺效应与线粒体数量增加有关。
[1]Barbe MF,Barr AE,Gorzelany I,et al.Chronic repetitive reaching and grasping results in decreased motor performance and widespread tissue responses in a rat model of MSD.J Orthop Res,2003,21(1):167-176.
[2]Soprano JV.Musculoskeletal injuries in the pediatric and adolescent athlete.Curr Sports Med Rep,2005,4 (6):329-334.
[3]BahrR.No injuries,butplenty ofpain? On the methodology for recording overuse symptoms in sports.Br J Sports Med,2009,43(13):966-972.
[4]d'Hemecourt P.Overuse injuries in the young athlete.Acta Paediatr,2009,98(11):1727-1728.
[5]NordanderC,Ohlsson K,Akesson I,etal.Risk of musculoskeletal disorders among females and males in repetitive/constrained work.Ergonomics,2009,52 (10):1226-1239.
[6]Junge A,Engebretsen L,Mountjoy ML,et al.Sports injuries during the Sμmmer Olympic Games 2008.Am J Sports Med,2009,37(11):2165-2172.
[7]Cutlip RG,Baker BA,Hollander M,et al.Injury and adaptive mechanisms in skeletal muscle.J Electromyogr Kinesiol,2009,19(3):358-372.
[8]Maffulli N,Longo UG,Spiezia F,et al.Aetiology and prevention of injuries in elite young athletes.Med Sport Sci,2011,56:187-200.
[9]张学林,高晓娟,史冀鹏,等.离心运动引起的骨骼肌过度使用损伤的机理研究.中国运动医学杂志,2012,31(12):1064-1074.
[10]卢鼎厚,张志廉,段昌平,等.阿是穴斜刺治疗肌肉损伤的研究.上海针灸杂志,2000,19(增刊):65-67.
[11]Armstrong RB,Ogilvie RW,Schwane JA.Eccentric exercise-induced injury to rat skeletal muscle.J Appl Physiol,1983,54(1):80-93.
[12]Dennett X,Fry HJ.Overuse syndrome:a muscle biopsy study.Lancet,1988,1(8591):905-908.
[13]高明,杨华元,刘堂义,等.手针与电针对急性运动大鼠骨骼肌线粒体的影响.中国针灸,2005,25(6):421-424.
[14]杨成,李滨,刘同慎,等.电针对脊髓损伤后星形胶质细胞增生的影响.中国针灸,2005 ,25(8):569-572.
[15]Zhang F,Ma J,Lu Y,et al.Acupuncture combined with curcμmin attenuates carbon tetrachloride-induced hepatic fibrosis in rats.Acupunct Med,2012,30(2):132-138.
[16]Boncompagni S,Rossi AE,Micaroni M,et al.Mitochondria are linked to calcium stores in striated muscle by developmentally regulated tethering structures.Mol Biol Cell,2009,20(3):1058-1067.
[17]Karalaki M,Fili S,Philippou A,et al.Muscle regeneration:cellular and molecular events.In Vivo,2009,23(5):779-796.
[18]Nunzi MG,Franzini-Armstrong C.Trabecular network in adult skeletal muscle.J Ultrastruct Res,1980,73(1):21-26.
[19]Bagnato P,Barone V,Giacomello E,et al.Binding of an ankyrin-1 isoform to obscurin suggests a molecular link between the sarcoplasmic reticulum and myofibrils in striated muscles.J Cell Biol,2003,20;160(2):245-253.
[20]Rossi AE,Boncompagni S,Wei L,et al.Differential impact of mitochondrial positioning on mitochondrial Ca(2+) uptake and Ca (2+) spark suppression in skeletal muscle.Am J Physiol Cell Physiol,2011,301(5):C1128-1139.
[21]张学林,周越,王瑞元.运动与骨骼肌中钙振荡.中国运动医学杂志,2009,28(5):581-599.
[22]屈竹青,卢鼎厚,王义润,等.针刺对骨骼肌损伤过程中细胞内钙分布的影响及其机制.中国运动医学杂志,1995,14(1):7-11.
[23]Pestronk A,Parhad IM,Drachman DB,et al.Membrane myopathy:morphological similarities to Duchenne muscular dystrophy.Muscle Nerve,1982,5(3):209-214.
[24]Reggiani C.Between channels and tears:aim at ROS to savethemembrane ofdystrophic fibres.JPhysiol,2008,586(7):1779.
[25]张祥,张学林,许寿生.运动与骨骼肌结构变化.中国运动医学杂志,2010,29(1):109-113.
[26]张学林,王瑞元.过度使用性损伤发生机制:骨胳肌张力整合复合体失衡学说.中国运动医学杂志,2013,32(7):657-665.
- 中国运动医学杂志的其它文章
- 《中国运动医学杂志》稿约
- 全国膝关节半月板外科学术会议通知

