营养损伤影响肝癌荷瘤小鼠体内炎性微环境的研究
王海龙,王绍山,胡人杰,赵秀梅 (.天津市滨海新区大港医院肿瘤科,天津 30070;.天津市医药科学研究所,天津 30000)
原发性肝癌是一种与炎性反应密切相关的恶性肿瘤:炎性反应在肝癌的发生和转移过程中具有促进作用。不同营养价值的饮食会通过肿瘤微环境中炎性因子的变化来影响肝癌患者的生存。笔者通过动物模型来研究过高或过低热量的饮食都会使促发肿瘤的炎性反应因子升高,而均衡营养更有利于肿瘤患者的机体康复,现报告如下。
1 资料与方法
1.1 一般资料:Balb/c小白鼠,2级实验动物,雌雄兼用,购自实北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK-(京)2012-0001。实验动物合格证编号:11400700001419。动物肿瘤瘤源HepA(肝癌腹水)由我中心瘤源室传代保存。瘤源传代保存于KM小鼠体内。
1.2 方法
1.2.1 肿瘤接种:按照文献方法进行。取接种肿瘤7~10 d状态良好的荷瘤(腹水型)动物,常规消毒后抽取少量腹水,涂片瑞氏染色细胞分类证实肿瘤细胞数不少于75%后将腹水抽出,以腹水与NaCl溶液之比为1∶4比例稀释,制备成接种用的肿瘤细胞混悬液。肿瘤细胞混悬液的制备均在无菌条件下(超净工作台中)完成。吸取上述制备的肿瘤细胞混悬液0.2 ml接种于小鼠右侧腋窝皮下,从取出肿瘤腹水至肿瘤接种完毕在60分钟内完成。
1.2.2 分组与给药:肿瘤细胞接种后24 h动物分组并开始给予不同配方的饲料。所有实验动物按体重分层后,随机分为5组,每组动物数量为10~16只不等。实验分组为:①基础饲料喂养组,饲喂商品繁育饲料,作为正常生理对照组;②低热量饲料喂养组,饲喂玉米粉饲料并间断辅以基础饲料;③强化饲料喂养组,饲喂强化营养饲料;④高脂饲料喂养组,饲喂高脂饲料;⑤脂肪乳喂养组,饲喂商品繁育饲料并灌胃脂肪乳,0.2 ml脂肪乳/10 g体重,1次/d,一直持续到实验结束。
1.3 评价指标:取血清用ELISA检测肿瘤相关的炎性因子IL-6、IL -8、NF-κB、TNF-α。
2 结果
2.1 血清IL-6表达水平比较:喂养后高脂饲料组、脂肪乳饲料组、强化饲料组、玉米饲料组、标准饲料组血清IL-6表达水平分别为(311.76±6.55)%、(233.63±4.44)%、(131.36±1.25)%、(144.64±1.12)%、(115.61±1.07)%,各组间比较差异有统计学意义(P<0.001)。采用LSD法两两比较,任何两组间比较,均有统计学意义(P<0.001)。
2.2 血清IL-8表达水平比较:喂养后高脂饲料组、脂肪乳饲料组、强化饲料组、玉米饲料组、标准饲料组血清IL-8表达水平分别为(365.10±5.88)%、(209.18±2.81)%、(135.82±1.67)%、(156.03±2.00)%、(96.37±0.82)%,各组间差异有统计学意义(P<0.001)。采用LSD法两两比较,任何两组间P<0.001,均有统计学意义。
2.3 血清NF-κB表达水平比较:喂养后高脂饲料组、脂肪乳饲料组、强化饲料组、玉米饲料组、标准饲料组血清NF-κB表达水平分别为(38.82±0.67)%、(34.19±1.15)%、(27.63±2.35)%、(26.64±2.11)%、(17.94±2.44)%,各组间比较差异有统计学意义(P<0.001)。采用LSD法两两比较,强化饲料组与玉米饲料组喂养后血清NF-κB表达水平比较,P=0.265,差异无统计学意义。
2.4 血清TNF-α表达水平比较:喂养后高脂饲料组、脂肪乳饲料组、强化饲料组、玉米饲料组、标准饲料组血清TNF-α表达水平分别为(1181.20±183.05)%、(634.56±21.49)%、(279.50±7.68)%、(317.80±6.69)%、(218.65±5.88)%,各组间差异有统计学意义(P<0.001)。采用LSD法两两比较,强化饲料组与玉米饲料组喂养后血清TNF-α表达水平比较,P=0.266,差异无统计学意义,强化饲料组与标准饲料组喂养后血清TNF-α表达水平比较,差异无统计 学意义(P=0.053)。具体情况详见表1和图1。
表1 不同饲料喂养的小鼠体内炎性因子的表达情况()
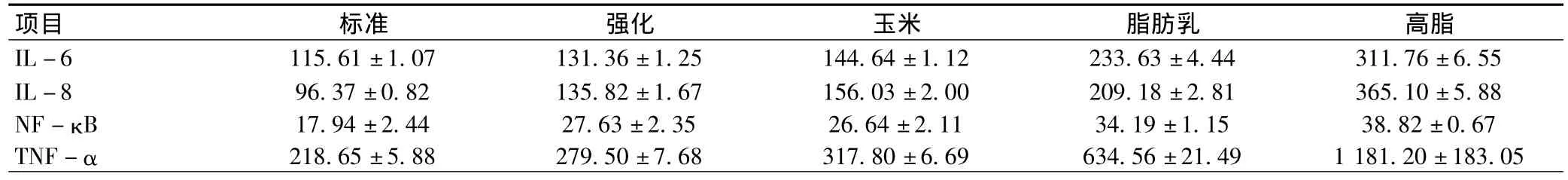
表1 不同饲料喂养的小鼠体内炎性因子的表达情况()
项目 标准 强化 玉米 脂肪乳 高脂IL-6 115.61±1.07 131.36±1.25 144.64±1.12 233.63±4.44 311.76±6.55 IL-8 96.37±0.82 135.82±1.67 156.03±2.00 209.18±2.81 365.10±5.88 NF-κB 17.94±2.44 27.63±2.35 26.64±2.11 34.19±1.15 38.82±0.67 TNF-α 218.65±5.88 279.50±7.68 317.80±6.69 634.56±21.49 1181.20±183.05
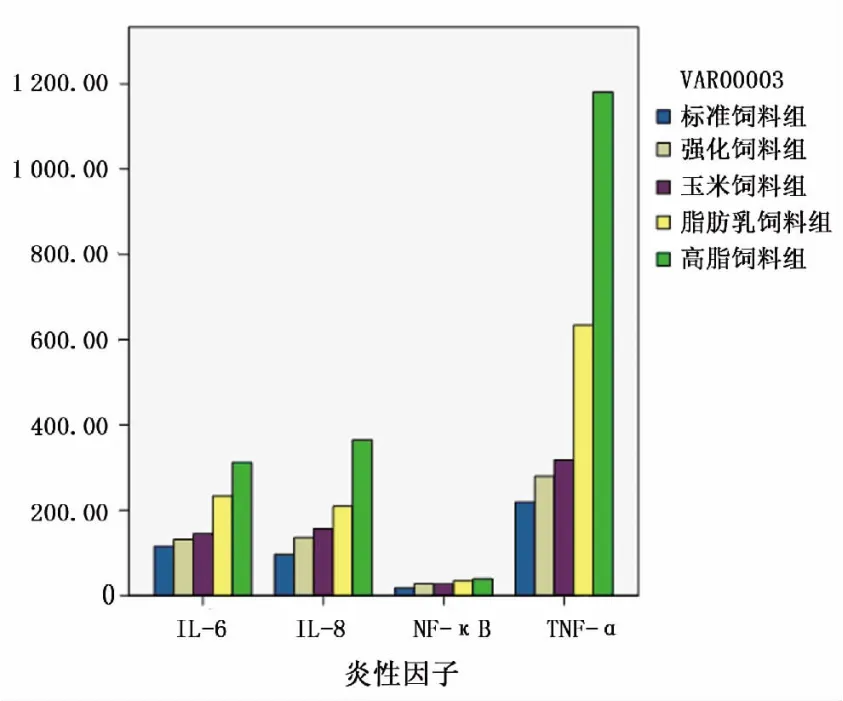
图1 不同饲料喂养的小鼠体内炎性因子表达情况
3 讨论
对于肿瘤患者饮食的选择会直接影响患者的预后,不当的饮食习惯,如高热量高脂肪的饮食,会引起患者体内炎性反应相关因子的急剧升高。本实验中高脂饲料组的促肿瘤炎性因子升高最明显。虽然脂肪乳组的热量含量最高,但是脂肪乳的口味不适合小鼠,所以该组小鼠进食量较高脂组少,因此造成这两组间最后还是高脂组炎性因子最高。这些升高的炎性因子会促进肿瘤的发生与转移,使机体处于长期的慢性免疫抑制状态。所以对于肝癌患者,不论在临床营养支持治疗中还是在日常饮食的健康宣教中都要考虑到不适当的营养支持治疗及不良的饮食结构所带来的负面作用。过高或过低的营养支持治疗都将不利于肝病患者的康复,甚至起到促发肿瘤的反作用,因为这些升高的炎性因子会加速肿瘤的发生发展。
TNF-α与肿瘤发展过程的多个环节有关,包括肿瘤细胞形成、逃逸、增生、浸润、血管生成、转移[1]。体内大多数TNF-α作为自分泌生长因子促进肿瘤生长。在部分肿瘤中,他通过诱导其他生长因子表达调节肿瘤生长。Lin和Fukata分别在动物体内和癌细胞中发现包括TNF-α和白介素(IL-6)在内的许多炎性反应介质可刺激肿瘤生长,促进肿瘤进展[2]。在原发性肝癌的研究中,多数专家认为TNF-α通过NF-κB通路在肿瘤的发生和进展中起作用。TNF-α激活肝细胞内的NF-κB不仅能能促进正常的肝细胞癌变,而且还可以促进这种发生癌变的细胞逃离最初的肿瘤,转移到身体其他部位。TNF-α的增高与肝脏的炎性反应活动状态有关,同时可以反映肝功能的受损情况和肝功能的储备情况[3]。白莉等通过动物实验证实炎性反应细胞因子,尤其是TNF-α的表达与肝癌转移显著正相关[4]。本研究发现高脂饮食或低热量饮食的机体内TNF-α的水平要显著高于标准饮食的机体,因此不论是高脂饮食还是低热量饮食都不利于机体康复,相反会促发肝癌的发展。
NF-κB作为一个核转录因子广发参与癌症的启动,发生及发展过程,在炎性反应与细胞癌变间起桥梁作用。NF-κB与血管内皮生长因子在肝癌中表达呈正相关,血管内皮生长因子是促进肝癌生长和侵袭转移的重要物质。核转录因子-κB在肿瘤生长中可以上调血管内皮生长因子的表达[5]。当NF-κB被抑制后,体内VEGF和血管黏附分子基因的表达受到抑制。肝细胞生长因子通过NF-κB的目标基因基质金属蛋白酶9来增强肝癌细胞的侵袭力[6]。本研究发现高脂饮食的机体体内NF-κB的水平要显著高于标准饮食的机体,因此高脂饮食将会通过NF-κB信号通道来促发肝癌的发展。
IL-6和IL-8是机体内复杂的细胞因子网络中的关键成员。IL-6及其受体失衡时,会引起机体内环境的紊乱,进而导致免疫功能紊乱促发肿瘤。研究发现肿瘤分期越晚、肿瘤负荷越大、治疗无效、有血行转移的患者体内IL-6的表达水平要明显升高。IL-8可通过促进胶原酶的活性增强肿瘤细胞的侵袭力,同时可诱导内皮细胞的迁移和增生来介导肿瘤组织血管增生[7]。本研究发现标准饲料喂养的小鼠体内IL-6的表达水平最低,说明均衡营养对对于维持机体微环境的平衡非常重要,过高或过低营养价值的饮食都将不利于机体免疫平衡的维持而促发肿瘤。
总之,通过本实验笔者发现对于肝癌荷瘤小鼠营养损伤会造成体内炎性因子的增加,从而促发肿瘤的发生与发展,这将指导在肝癌的治疗上提出新的理念和思路[8-10]。合理的均衡营养有利于机体内环境稳定的维持。由于观察期尚短暂,营养损伤造成体内炎性因子增加对机体的远期影响有待进一步研究。
[1]Chin YS,Bullard J,Bryant L,et al.High dose rate iridium-192 brachytherapy as a component of radical radiotherapy for the treatment of localized prostate cancer[J].Clin Oncol(R Coll Radiol)2006,18(6):474
[2]Lin W,Karin M.A cytokine mediated link between innate immunity,inflammation and cancer[J].J Clin Invest,2007,117(5):1175
[3]李树贵,张 瑞,张文平.肝硬化和肝癌患者肿瘤坏死因子的测定及其意义[J].中国医药,2011,6(13):11.
[4]白 莉,毛高平,曹传平.肝癌切除术后转移过程中炎性递质的作用[J].世界华人消化杂志,2005,13(13):1507.
[5]王李杰,白 莉.原发性肝癌与癌症关系的研究进展[J].癌症进展,2010,8(4):357.
[6]杨春霞,杨微波.核因子KB在HBV相关肝癌中的研究进展[J].医学综述,2011,17(17):2614.
[7]苗 雪,官 杰.IL-8的研究进展[J].齐齐哈尔医学院学报,2011,32(22):3693.
[8]李 理.65例中晚期肝癌介入治疗的疗效观察[J].长春中医药大学学报,2009,25(2):268.
[9]邢育红.肝癌的CT诊断特点与效果分析[J].吉林医学,2013,34(5):821.
[10]覃英容,林 源,莫显伟,等.原发性肝癌患者手术前后免疫功能状态的研究进展[J].吉林医学,2012,33(8):1670.

