血管内皮生长因子在老年AECOPD患者中的诊断价值及与APACHE III评分相关性研究
马晋 张杰 张颖 余其贵
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是目前全球致残和致死率较高的疾病之一, 也是老年人常见病、多发病。COPD急性加重(acute exacerbations of chronic obstructive pulmonary disease, AECOPD)与肺功能加速减损、生命质量降低及病死率增高密切相关。AECOPD及其严重程度的定义缺乏客观指标, 主要依据患者的主观症状和医生的判断。临床亟待需要一个能够早期诊断, 同时能够初步判断病情严重程度的指标, 近年国内外研究发现:血管内皮生长因子(vascular endothelial growth factor, VEGF)在AECOPD的诊断价值很高。
本文旨在动态观察患者血清AECOPD和APACHE III评分在疾病发展与治疗过程中的变化, 为临床制定合适治疗方案及对危重患者病情评估及预后判断提供依据。
1 资料与方法
1.1 一般资料 选取2012年1月~2012年10月在合肥市第一人民医院老年病科就诊的COPD患者90例, 年龄>65岁, 均符合《慢性阻塞性肺疾病诊治指南》(2007年修订版)。其中稳定期患者30例(稳定期COPD组), 年龄(86.67±4.40)岁;急性加重期患者60例(急性加重期COPD组), 年龄(84.65±4.29)岁。患者急性加重组(AECOPD组)根据痰液性质为脓痰组及非脓痰组,其中脓痰组30例, 平均年龄(85.17±3.98)岁;非脓痰组30例, 平均年龄(84.13±4.52)岁。另选取30名健康志愿者作为健康对照组, 平均年龄(84.57±4.01)岁。所有受试者均排除了长期服用维生素类药物激素类药物、严重心、肝肾功能损害、贫血、甲状腺功能异常、严重老年痴呆和精神异常者以及恶性肿瘤和免疫系统疾病。病例组和对照组间年龄差异无统计学意义(t=0.831, P=0.407),性别间差异有统计学意义(χ2=8.980, P=0.003)。在入选后24 h内收集2组血清VEGF、His-CRP、WBC、N浓度及第8天收集AECOPD组患者的以上各项指标。记录AECOPD组患者入院后24 h内及第8天的体温、心率、血压、白细胞、红细胞压积、尿量、肾功能、血清钠钾离子、血清胆红素等生化指标。
1.2 研究方法
1.2.1 VEGF、PCT、His-CRP、WBC、N的检测: 所有加重组患者在入院后第1日、第8日及稳定组、健康对照组在入院后次日空腹抽取静脉血3 ml, 置于无菌带塞试管中, 凝固后于常温3000 r/min, 离心5 min, 留取血清于4℃冰箱保存待测。VEGF用酶联免疫吸附法进行测定, 试剂由深圳科润达生物工程有限公司提供。PCT用酶联免疫吸附法进行测定, 试剂由法国梅里埃公司提供。His-CRP用免疫散射速率比浊法进行检测, 试剂由上海科华公司提供, 正常参考值:0~3mg/L;WBC计数及中性粒细胞百分比按照全国临床检验操作规程采用血细胞自动计数仪进行测定。
1.2.2 痰液标本采集 采用自然咳痰法, 清晨凉开水漱口后,深咳, 收集痰液。无菌容器收集新鲜无唾液痰标本。把不透明或乳状痰标本归为非脓痰组, 干咳无痰者亦归为非脓痰组;而黄色、绿色、棕色痰液均归为脓痰组。
1.3 统计学方法 采用SPSS17.0统计软件, 正态分布计量资料采用(±s)表示, 两组间比较采用t检验;偏态分布计量资料采用M(P25,P75)表示, 多组间比较采用秩和检验;采用Spearman积差相关分析指标间相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 四组血清VEGF、PCT、his—CRP、WBC、N比较 除N 指标外 , 第一天四组间 VEGF、PCT、his—CRP 、WBC 水平差异均有统计学意义(P<0.01), 脓痰组四项指标均高于其他三组(P<0.01), 非脓痰组his-CRP和WBC均高于稳定组和对照组(P<0.01), 稳定组VEGF高于对照组, 差异均有统计学意义。见表1。
表1 四组的血清VEGF、PCT、His-CRP、WBC、N测定值比较(±s)

表1 四组的血清VEGF、PCT、His-CRP、WBC、N测定值比较(±s)
注:a 表示与脓痰组比较差异有统计学意义, b 表示与非脓痰组比较差异有统计学意, c 表示与稳定组比较差异有统计学意义
组别 VEGF (μg)PCT His-CRP(mg/L)N(%)WBC(10×109/L)脓痰组233.36±73.98 1.497±0.92 20.57±11.18 53.53±6.50 11.01±3.12(n=30)(非n脓=痰30组)194.46±65.51a 0.047±0.026a 18.63±4.51 51.34±12.77 8.48±4.29a(稳n=定3组0)191.37±68.70a 0.043±0.012a 9.93±2.36ab 50.70±11.86 6.52±2.48ab正常(n=对3照0)组 118.75±79.85abc 0.407±0.008a 9.77±3.70ab 47.84±11.72 5.81±2.40ab F 14.382 65.586 23.548 1.368 16.223 P<0.001 <0.001 <0.001 0.256 <0.001
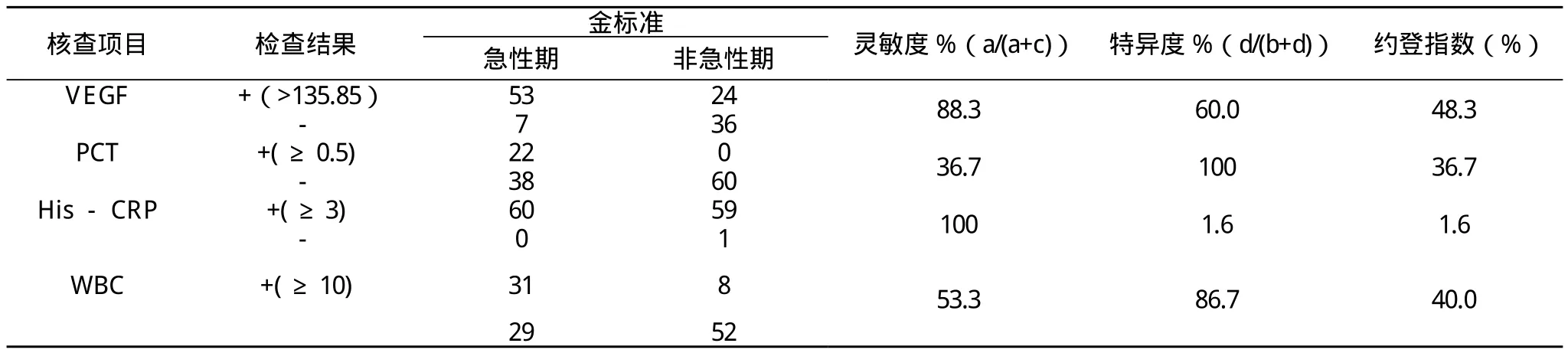
表2 VEGF 、PCT、His-CRP、N、WBC灵敏度, 特异度情况
通过表2可见, VEGF的约登指数最大, 综合比较,VEGF作为诊断AECOPD的单一指标是最好的。
2.2 急性期VEGF和APACHE Ⅲ评分间的相关性 经Pearson极差相关分析, 急性期第1天VEGF(213.91±73.63)与APACHEⅢ评分(40.98±4.40)间有相关性(r= 0.701, P<0.001);急性期第8天VEGF值(109.16±50.85)与APACHE Ⅲ评分(27.47±4.03)间有相关性(r=0.339, P=0.008)。
表3 VEGF与APACHE Ⅲ的相关性分析(±s)
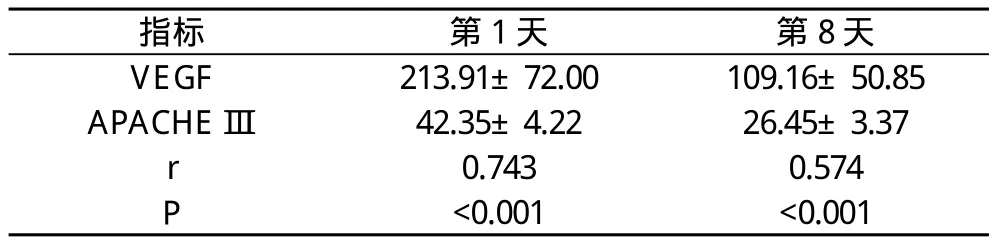
表3 VEGF与APACHE Ⅲ的相关性分析(±s)
指标 第1天 第8天VEGF 213.91±72.00 109.16±50.85 APACHE Ⅲ 42.35±4.22 26.45±3.37 r 0.743 0.574 P<0.001 <0.001
3 讨论
AECOPD是指患者出现超越了日常状况的持续恶化, 并需要改变基础常规用药, 通常在疾病过程中, 患者短期内咳嗽、咳痰、气短和(或)喘息加重, 痰量增多, 呈脓性或黏液性,可伴发热等炎症明显加重的表现。细菌感染是AECOPD的主要诱因, 目前临床常用于判断感染性疾病的his-CRP、WBC、N等指标特异性差, 影响因素众多, 尤其是老年人常伴有免疫功能和机体反应低下, 在急性炎症时变化都不明显。Peduzzi[1]等发现, WBC升高不是感染的独立预测指标, 其用于诊断感染的准确性很低, 也不能反映疾病预后。his-CRP是一种急性期反应蛋白, 由肝脏合成并分泌, 目前在临床上应用较为广泛,但除细菌感染外, 病毒感染、急性排异反应、心血管系统疾病及手术都可引起其升高, 因而对感染缺乏特异性, 且浓度升高与临床预后无关。Stolz[2]等报道, AECOPD患者入院时降钙素原显著高于发病后第14天和6个月, 他们认为降钙素原细菌感染性AECOPD时, 降钙素原常升高, 非细菌感染性或系统性炎症反应不明显时, 降钙素原则不一定升高。而Bozinovski等[3]则未观察到这一现象, 他们认为降钙素原不能更好地反映AECOPD的严重程度。因此, 降钙素原在预示AECOPD方面仍存在争议。近年国内外学者研究发现, 血清VEGF在AECOPD中的诊断及预后判断中的价值很高。
目前研究普遍认为COPD以气道、肺实质和肺血管的慢性炎症为特征, 近年来, 国内外有越来越多的研究证明VEGF参与了COPD的病情进展[4-6], 通过研究VEGF和FEV1之间的变化关系, 提出VEGF和气流受限程度相关。COPD早期仍以血管病变为主, 由于低氧等一系列因素引起肺血管收缩、促炎性介质释放, 从而导致血管重构, 另外, 炎性因子能刺激IL6、纤维蛋白原等释放, 这两者都能影响VEGF的表达[7],VEGF是血管重构中最重要的调控因子, 在COPD急性加重期, 由于机体进一步缺氧, 更多的炎性细胞释放, IL6、纤维蛋白原等更多因子激活, 肺血管重构增多, 表达更高水平的VEGF, 可见无论COPD稳定期还是急性加重期都以不同的方式参与COPD血管重塑及气道重塑。
临床上对患者的病情评估存在多种评分系统, APACHE评分是目前临床上常见于评估危重患者病性最常见的方法,APACHEⅢ评分效果明显优于APACHE II, 涵盖了全身各系统的急性生理变化状况, 客现的反映疾病当前的严重程度, 其评分高低是评估疾病严重程度的指标, 并与预后密切相关, 总分越高, 表示病情越重, 预后越差。为正确判断预后提供了条件[8], 本研究发现 , 治疗后 VEGF 值 (109.16±50.85)、APACHE III值(26.45±3.37)明显低于治疗前(明显改善或改善)VEGF值 (213.91±72.00)、APACHE III(42.35±4.22)(P<0.05), PCT 水平与APACHE III评分明显相关, 在COPD急性加重期, 更能准确的反映病情的严重程度, 为治疗提供一定的帮助。
综上所述, VEGF不仅可以作为老年性AECOPD患者的诊断指标, 同时动态监测患者血清VEGF水平变化有利于对患者的病情进行更全面的评估, 有助于患者的预后判断。
[1]Peduzzi P, Shatney C, Sheagren J, et al.Predictors of bacteremia and Gram-negative bacteremia in patients with sepsis.Arch Intern Med,1992, 152(3):529-535.
[2]Stolz D, Christ, Criain M, Bingisser R, et al.Antibiotic treatment of exacerbation of COPD: a randomized controlled trial comparing procalcitonin guidance with standard therapy.Chest, 2007,131(1):9-19.
[3]Bozinovski S, Hutchinson A, Thompsen M, et al.Serum amyloid a is a biomarker of acute exacerbations of chronic obstructive pulmonary disease.Am J Respir Crit Care Med, 2008(177): 269-278.
[4]Kasahara Y, Tuder R M, Cool C D, et al.Endothelial cell death and decreased expression of vascular endothelial growth factor and vascular endothelial growth factor receptor 2 inemphysema.Am.J.Respir, Crit.Care Med, 2001:163, 737-744.
[5]Kranenburg, A.R., de Boer, et al.Enhanced bronchial expression of vascular endothelial growth factor and receptors (Flk-1 and Flt-1)in patients with chronic obstructive pulmonary disease.Thorax ,2005(60): 106-113.
[6]Kanazawa H, Asai K, Hirata K, et al.Possible effects of vascular endothelial growth factor in the pathogenesis of chronic obstructive pulmonary disease.Am.J.Med, 2003(114): 354-358.
[7]Adams JM, Difazio LT, Rolandelli RH, et al.HIF 1:a key mediator in hypoxia .ActaPhysiol Hung, 2009, 96(1): 19-28.
[8]陈衡华.APACHEⅢ评分对COPD急性加重期并呼吸衰竭患者病情评估的价值.中国实用医药, 2008(10):123.

