铜基营养保护剂悬浮浓度快速测定方法的研究
徐 睿,张 民
(土肥资源高效利用国家工程实验室,国家缓控释肥工程技术研究中心,山东农业大学资源与环境学院,山东 泰安 271018)
0 引 言
无机铜制剂是当今应用范围较广的杀菌剂之一,它具有开发应用时间早、使用时间长、施用面积大、杀菌效果好、用途广泛等特点。1761年,人们就已用硫酸铜处理小麦种子防治腥黑穗病。1882年,法国波尔多大学教授米拉德(P.Millardet)发现波尔多液能够防治葡萄霜霉病[1]。现在市场上存在的无机铜制剂主要有:波尔多液、硫酸铜、氧氯化铜、氢氧化铜、氧化亚铜等[2-3]。在铜基营养保护剂杀菌作用和营养效果方面已做过了大量研究[4-5],此外铜基营养保护剂的研究生产也引起了广泛关注[6-9]。
判定铜基营养保护剂性能指标之一是其悬浮性[10],悬浮性是指分散的药粒在悬浮液中保持悬浮一定时间的能力[11],但是测定悬浮性的传统方法直接烘干法[12]比较费时费力,目前还没有较好的快速、简便的检测方法。本文通过对5种铜基营养保护剂采用离心干燥法、比浊法、铜氨比色法[13-15]分别测定其悬浮浓度,并与直接烘干法建立相关方程,通过检验评价,确定快速测定铜基营养保护剂悬浮效果的最佳方法。
1 材料与方法
1.1 试验材料
5种铜基营养保护剂:美国kocide2000(USA-G)(美国固信公司生产),铜基营养保护剂-1(CNPP1)、铜基营养保护剂-2(CNPP2)、铜基营养保护剂-3(CNPP3)、铜基营养保护剂-4(CNPP4)(均为山东农业大学“土肥资源高效利用国家工程实验室”下属的新型肥料中试与示范基地生产)。
1.2 测定方法
1.2.1 直接烘干法
直接烘干法的基本原理为:根据Stokes的沉降公式(ν=2gr2(d1-d2)/9n)和等速运动(s=νt)确定吸样深度;再根据颗粒比重大小、悬液温度,确定某粒径的吸样时间。在一定时间段内的不同时刻,用移液管在悬液一定深度吸取一定体积的悬浊液,烘干后称重。根据干样质量的大小,从而确定悬浊液悬浮特性的差异。具体操作方法如下:在1 000 mL量筒中盛入2g/L的待测样品1000mL,将试样充分摇匀后立即进行吸取测定。吸样深度位于液面下15cm处,吸样体积均为20mL。吸出的悬液放入已烘干称重的烧杯中,置于60℃烘箱中烘至恒重,冷却后称重。吸样时间间隔分别为 15,30,45,60,90,120 min。每吸完一个样品,必须将移液管冲洗干净,以免造成误差。
1.2.2 离心干燥法
前处理方法与直接烘干法相同,将吸出的20mL悬液放入已烘干称重的50 mL离心管中,转速4000r/min,离心10min,用移液枪将上清液吸出,置于60℃的烘箱中,烘至恒重,冷却后称重。
1.2.3 比浊法
用相同方法吸取悬液5mL(根据铜基营养保护剂的含铜量确定吸取体积),充分摇匀悬液后,完全转移到25 mL容量瓶中,定容摇匀,于470 nm波长下比色测定。
1.2.4 铜氨比色法
用相同方法吸取悬液2mL(根据铜基营养保护剂的含铜量确定吸取体积)置于25mL容量瓶中,分别加入1mol/L 1/2H2SO41mL和1mol/L NH3·H2O 3mL,定容摇匀,于660nm波长下比色测定。
1.3 数据分析
试验中获得的数据均用SAS程序软件(SAS Institute,1999)进行统计分析。
2 结果与讨论
2.1 不同方法测定的铜基营养保护剂的悬液浓度结果
2.1.1 直接烘干法测定的悬液浓度结果
测定结果见表1,可知随着时间的延长,悬浮浓度均有不同程度的降低,即悬液中悬浮固体的质量逐渐减少。将悬液进行烘干处理,烘干时间约为24h。
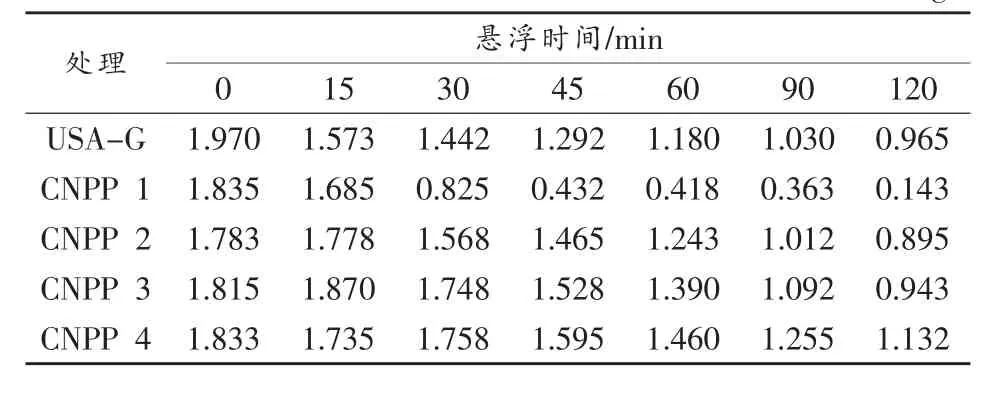
表1 直接烘干法测定的悬液浓度值 单位:g/L
2.1.2 离心干燥法测定的悬液浓度结果
采用离心干燥法后,首先将悬液进行离心处理,然后将上层清液吸出,进行烘干,烘干所需时间缩短至6h,进而可以快速的验证铜基营养保护剂的悬浮性随悬浮时间的变化关系。测定结果见表2。

表2 离心干燥法测定的悬液浓度值 单位:g/L
2.1.3 比浊法测定的悬液浓度结果
随着时间的推移,悬液会继续沉降,悬液浓度不断减小,采用比浊法在不同的悬浮时间所测得悬液吸光度值均呈变小趋势(表3)。比浊法操作步骤相对简单,但由于铜基营养保护剂溶于水后是悬浊液,在比色过程中,颗粒容易继续沉降,无法准确读出其吸光度值,只能进行粗略测定。

表3 比浊法测定的悬液吸光度值
2.1.4 铜氨比色法测定的悬液浓度结果
铜氨比色法在不同的悬浮时间所测得吸光度值(表4)变化趋势与用吸管法测得的悬液浓度基本一致,在某一时刻的悬液浓度越大,其加入一定浓度的硫酸后,解离出的铜离子就越多,进而加入一定浓度的氨水反应后,形成的铜氨络合溶液的颜色就深,测得的吸光度值就大,反之越小。

表4 铜氨比色法测定的悬液吸光度值
2.2 3种方法与直接烘干法的相关关系
2.2.1 离心干燥法与直接烘干法的相关关系
以表1数据作为横坐标(x),表2数据作为纵坐标(y)作图,得到相关方程(表5)。可知各处理所得回归方程相关系数r均大于0.9,置信度P均小于0.01,呈极显著相关。说明直接烘干法和离心干燥法对于测定铜基营养保护剂的悬浮性具有一致的线性关系,可以通过使用离心干燥法测定铜基营养保护剂的悬液浓度,然后代入其相关关系方程,求出在某一时刻悬液的准确浓度值。

表5 离心干燥法与直接烘干法建立的相关方程
2.2.2 比浊法与直接烘干法的相关关系
以表1数据作为横坐标(x),表3数据作为纵坐标(y)作图,得到回归方程列于表6中。可知用比浊法和直接烘干法建立的相关方程,均达到显著相关。虽然比浊法操作最为简单快速,但是考虑到测定过程中悬液不断沉降造成的试验误差,该方法可能存在一定的不准确性。
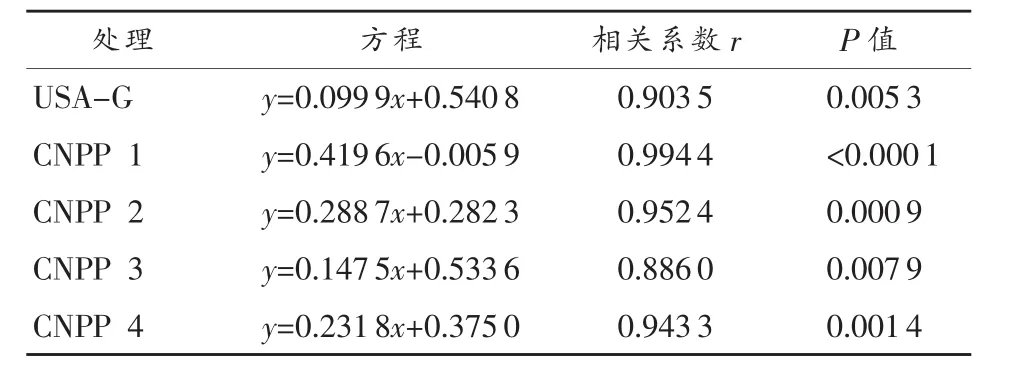
表6 比浊法与直接烘干法建立的相关方程
2.2.3 铜氨比色法与直接烘干法的相关关系
以表1数据为横坐标(x),表4数据为纵坐标(y)作图,得到回归方程列于表7中。可知各处理所得回归方程相关系数r均大于0.90,置信度P值均小于0.01,呈极显著相关。铜氨络合溶液比较稳定,在测定过程中不会继续沉降,能相对准确快速的判定悬液的浓度。

表7 铜氨比色法与直接烘干法建立的相关方程
2.3 测定铜基营养保护剂悬液浓度3种方法的评价
2.3.1 离心干燥法的评价
按照相同步骤进行试验,将离心干燥法测得的悬液浓度值一一代入表5相对应的回归方程中,求得相对应的一组悬液浓度值,然后将其与直接烘干法测得的实际悬液浓度值进行比较,计算出各个时间实际浓度和计算浓度的相对误差(表8)。可以看出CNPP1和CNPP4相对误差较大,美国固信USA-G相对误差最大值为7.78%;CNPP2除90 min时相对误差大于15%,其他值均小于5.5%;CNPP3中90min和120 min时相对误差大于15%,其他值均小于8%。相对误差出现原因可能是由于测量过程虽然是先离心再将上清液吸出,但是在上清液中仍有少量的铜基营养保护剂,吸出过程造成质量减少。其中最大相对误差为95.52%,最小相对误差为0.25%,平均相对误差为15.45%。说明该方法虽然可行,但是对于不同的铜基营养保护剂,其准确性不同,存在一定的试验误差。

表8 离心干燥法测定的相对误差
2.3.2 比浊法的评价
将吸光度法测得的吸光度值一一代入表6相对应的回归方程中,求得相应的悬液浓度值,然后与直接烘干法测得的实际悬液浓度值进行比较,计算出各时间实际浓度和计算浓度的相对误差(表9)。除CNPP4的相对误差控制在5.13%以内,其他4种处理的相对误差均有超出10%,准确性较差,主要是由于不同铜基营养保护剂的悬液稳定性不同,在比色过程中,悬液颗粒继续沉降,比色杯比色位置悬液浓度不断减小,吸光度值也不断减小,故吸光度值相对不准确。其中最大相对误差为32.52%,最小相对误差为0.61%,平均相对误差为10.02%。该方法虽然最为简单,但是误差较大,不能准确测定悬液的浓度。

表9 比浊法测定的相对误差
2.3.3 铜氨比色法的评价
将铜氨比色法测得的吸光度值一一代入表7相对应的回归方程中,求得相应的悬液浓度值,然后与直接烘干法测得的实际悬液浓度值进行比较,计算出各时间实际浓度和计算浓度的相对误差(表10)。CNPP3和CNPP4相对误差均在2.5%以内;处理USA-G相对误差控制在7%之内;而CNPP1在90min和120 min并且 CNPP2在 60min、90min和 120min时计算的相对误差较大,主要是由于悬液中的有效成分基本都沉降到量筒底部,悬液浓度太低。所有结果最大相对误差为18.76%,最小相对误差为0.04%,平均相对误差仅为4.51%,所以铜氨比色方法能够快速准确地测定铜基营养保护剂的悬液浓度。在以后的产品性能检验中,可以使用铜氨比色法测定铜基营养保护剂的悬液浓度,然后代入其相关方程中,从而快速准确地确定铜基营养保护剂在某一时刻的悬液浓度。

表10 铜氨比色法测定的相对误差
3 结束语
根据相关方程和检验结果,虽然使用离心干燥法和比浊法与直接烘干法建立的相关方程可达到显著相关,但是经过检验后相对误差较大,在以后的产品检验中不能使用此方法。铜氨比色法与直接烘干法建立的相关方程均呈极显著相关,最小相对误差为0.04%,平均相对误差只有4.51%,测定时间可由24 h缩短为30 min,所以使用铜氨比色法可快速准确测定铜基营养保护剂的悬浮效果。
[1]潘国才,吴会昌.无机铜制剂在蔬菜生产上的应用[J].农业科技通讯,2009(4):186-187.
[2]王忠跃,耿俊云.世界上铜制剂的发展[J].中外葡萄与葡萄酒,2001(3):65-67.
[3]徐映明,朱文达.农药问答[M].5版.北京:化学工业出版社,2011:212.
[4]Qiang Z,Min Z,Qiang M.Copper-based foliar fertilizer and controlled release urea improved soil chemical properties,plant growth and yield of tomato[J].Scientia Horticulturae,2012(143):109-114.
[5]段路路.波尔多液营养保护剂对番茄缺铁锌症矫治及生长效应研究[J].干旱地区农业研究,2006,24(3):89-94.
[6]Xin B W,Long M H.Anovel one-step method to synthesize copper nitrate hydroxide nanorings[J].Trans.Nonferrous Met Soc China,2009(19):480-484.
[7]张树青.纳米氢氧化铜的控制合成及应用研究[D].济南:山东科技大学,2005.
[8]Guanhua L,Wenfeng J,Wensheng L,et al.Copper hydroxide nano-and microcrystal:Facile synthesis,shape evolution and their catalytic properties[J].Journal of Colloid and Interface Science,2011(353):392-397.
[9]Yu L,Xiao Y Y,Rooke J,et al.Ultralong Cu(OH)2and CuO nanowire bundles:PEG200-directed crystal growth for enhanced photocatalytic performance[J].Journal of Colloid and Interface Science,2010(348):303-312.
[10]张强,陈颖.TURBISCAN LAB稳定性分析仪研究农药WDG悬浮液稳定性[J].光谱学与光谱分析,2008,28(4):843-846.
[11]郭武棣.液体制剂[M].北京:化学工业出版社,2004.
[12]段路路.波尔多液营养保护剂矫治植物缺铁锌症状及生物效应研究[D].济南:山东农业大学,2006.
[13]董斌,李生英.硫酸四氨合铜(Ⅱ)溶液中加入氢氧化钠溶液能否产生氢氧化铜沉淀[J].甘肃高师学报,1998,3(3):49-51.
[14]席改卿.硫酸铜与氨水反应实验的探讨[J].邯郸师专学报,1999,9(3):36-37.
[15]石莉萍,刘纯.硫酸四氨合铜的制备及组成测定的实验研究[J].沈阳教育学院学报,2002,4(4):113-114.

