南极适冷菌Psychrobacter sp. G普遍胁迫蛋白(USP)基因的克隆及其胁迫条件下的应答特征分析*
宋维志,林学政*,车 帅
(1. 国家海洋局 第一海洋研究所,山东 青岛 266061;2. 国家海洋局 海洋生物活性物质重点实验室,山东 青岛 266061)
南极生态系统具有独特的地理环境及气候特征,如常年低温、干燥、盐度高且变化大、强辐射等,生存于其中的南极细菌必须采用独特的适应机制来应对这种极端的生存环境[1-3]。
普遍胁迫蛋白(Universal Stress Protein,USP)最早在大肠杆菌的双向等电聚焦电泳中发现,并被命名为C13.5蛋白[4]。研究发现,该基因与大肠杆菌的多种胁迫和饥饿刺激应答反应均相关,包括生长稳定期,C、N、磷酸盐、硫酸盐及氨基酸的缺乏,热激、氧化剂、金属、酒精、抗生素等有害物质的处理[5]。大肠杆菌USP家族成员包括UspA,UspC,UspD,UspE,UspF,UspG(UspB并不属于USP家族)[6]。目前所发现的USP大多属于UspA家族,它能够形成同型二聚体,在大肠杆菌中还发现了UspA的异型二聚体,这可能是USP具有多种生物学功能的原因[7]。
尽管已经在很多物种中发现USP能被多种胁迫刺激诱导,但其明确的作用机理还不清楚,至今对USP的研究对象主要集中于中温菌大肠杆菌[6-9],而对生存于南极这一极端生境的适冷菌的USP的研究尚未见报道。为进一步了解南极细菌的生境适应机制,根据南极适冷菌Psychrobactersp. G的基因组测序草图,通过设计特异性引物,克隆得到1个USP基因。通过实时定量PCR技术(qRT-PCR)对其在不同胁迫条件下的表达情况进行了研究,以期阐明该基因在南极适冷菌生境适应性中的作用。
1 材料与方法
1.1 菌株、培养基与试剂
南极适冷菌Psychrobactersp. G分离自南极乔治王岛西南部的水样并保存于本实验室中[10]。
所使用不同盐度培养基的成份见表1,培养基于1×105Pa下湿热灭菌20 min。海水取自山东青岛海域,盐度为31。
大肠杆菌感受态细胞DH5α(D9057)、克隆载体pMD18-T(D101A)、RNA提取试剂盒(D9108D)、反转录试剂盒(DRR037A)、SYBR PrimeScriptTMRT-PCR Kit(DRR041A)均购自大连Takara公司;基因组DNA提取试剂盒(DP302)、琼脂糖凝胶回收试剂盒(DP209-2)均购自天根生化科技(北京)有限公司。

表1 培养基成份Table 1 Components of culture media
1.2 Usp1141基因的克隆
为获取Usp1141基因全长及其完整的调控序列,根据菌株Psychrobactersp. G的基因组草图,选取Usp1141基因起始密码子ATG上游-500~-600 bp的序列以及终止密码子TAA下游0~100 bp的序列,利用软件Primer 5.0设计特异性引物Usp1141-F和Usp1141-R(表2)。PCR扩增反应条件如下:95 ℃ 4 min;42 ℃ 30 s,72 ℃ 40 s,30个循环; 72 ℃ 10 min,4 ℃保持。PCR产物用琼脂糖凝胶回收试剂盒切胶纯化后连接到pMD-18T载体并转化大肠杆菌DH5α。含有插入片段的阳性克隆并由上海桑尼生物科技有限公司完成测序。
1.3 生物信息学分析
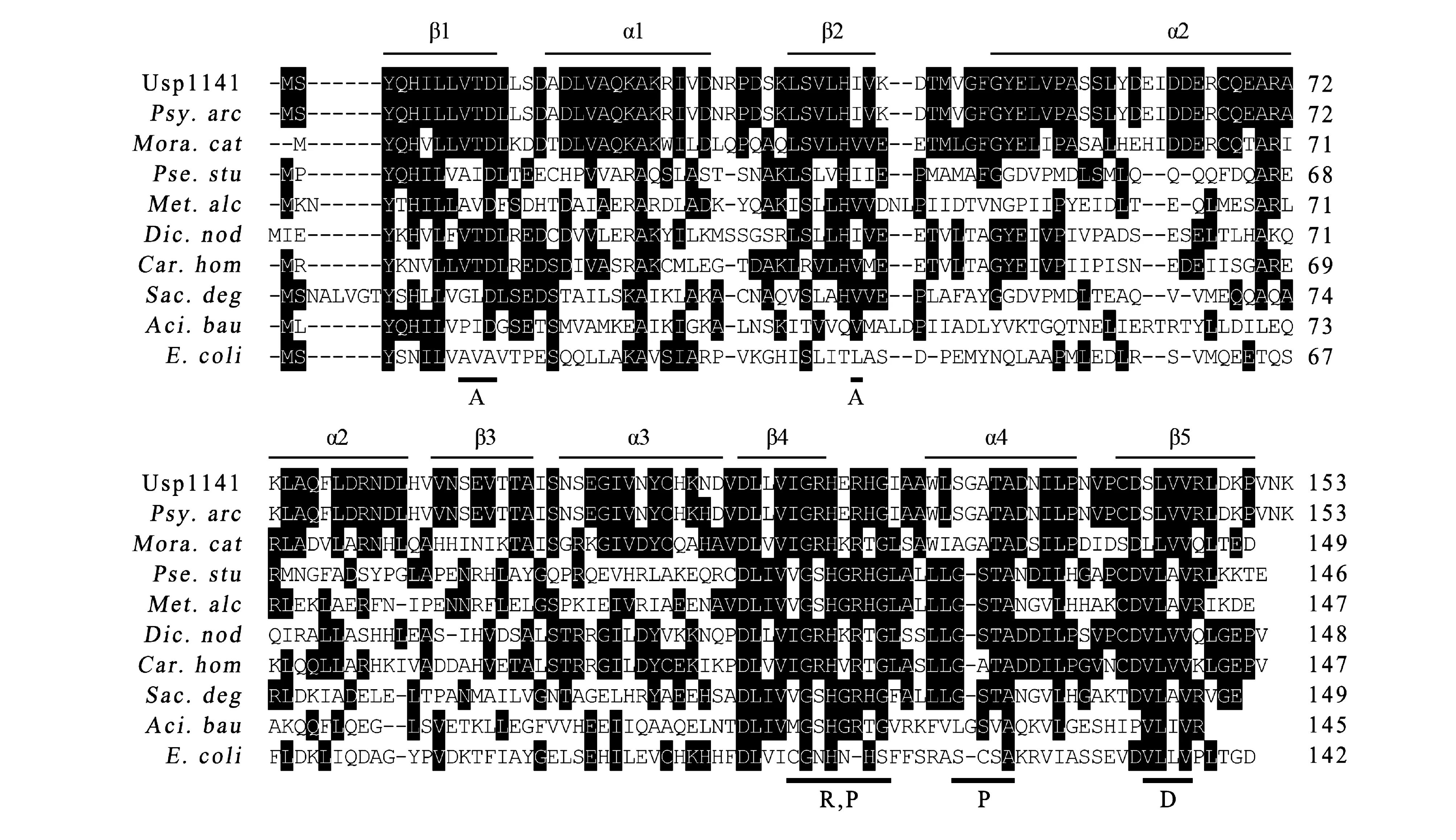
扩增得到的Usp1141基因的核苷酸序列通过BLAST(http:∥www.ncbi.nlm.nih.gov)与GenBank中已有的序列进行比对分析。启动子序列(-35区,-10区)、核糖体结合位点(RBS)由Softberry网站(http:∥linuxl.softberry.com/berry.phtml)分析获得[11]。蛋白等电点(pI)、分子量(MW)由Lasergene-EditSeq(v.1.02; DNASTAR Inc.)计算得出。使用Lasergene序列分析软件包(v.1.02;DNASTAR Inc.)中的MegAlign,将Usp1141与其他菌种UspA进行多序列比对,所选取的UspA分别来自于Psychrobacterarcticus(YP_265125),Moraxellacatarrhalis(YP_003627803),Pseudomonasstutzeri(YP_001172977)、Methylomicrobiumalcaliphilum(YP_004916566)、Dichelobacternodosus(YP_001208950),Cardiobacteriumhominis(ZP_05705139),Saccharophagusdegradans(YP_527252),Acinetobacterbaumannii(ACJ41690)和Escherichiacoli(ACT43718)。选取与菌株G进化关系较近菌株的UspA蛋白,使用软件Mega 4.0中的邻接法(neighbor-joining method,NJ)构建系统发育树,通过自展检测法(bootstrap test)评估所构建的系统发育树的可靠性[12]。
1.4 胁迫处理
首先将菌株G在最适生长温度(20 ℃)和盐度(45)条件下培养,待培养液OD600达到0.5时(指数生长期),进行如下的胁迫处理:1)温度胁迫:将菌株分别于0、10 和30 ℃培养,并分别于2,6和12 h时取样并于-80 ℃保存。2)盐度胁迫:将OD600为0.5的培养液于20 ℃下8 000 g离心5 min,收集菌体。将获得的菌体分别重悬于与离心前体积相等的、盐度分别为0,15,90和120的培养基中。重悬后的菌体于20 ℃继续培养2,6和12 h后取样并于-80 ℃保存。3)温度盐度协同胁迫:按照盐度胁迫的操作方法,将OD600为0.5的培养液分别于如下条件下继续培养:温度0 ℃,盐度15;温度30 ℃,盐度15;温度0 ℃,盐度90;温度30 ℃,盐度90。菌株于上述条件下继续培养2,6和12 h后取样并于-80 ℃保存。最适生长条件(温度为20 ℃,盐度为45)下继续培养的菌株于相同时间点(2,6和12 h)取样设为对照,进行基因差异表达分析。
1.5 Usp1141 基因表达分析
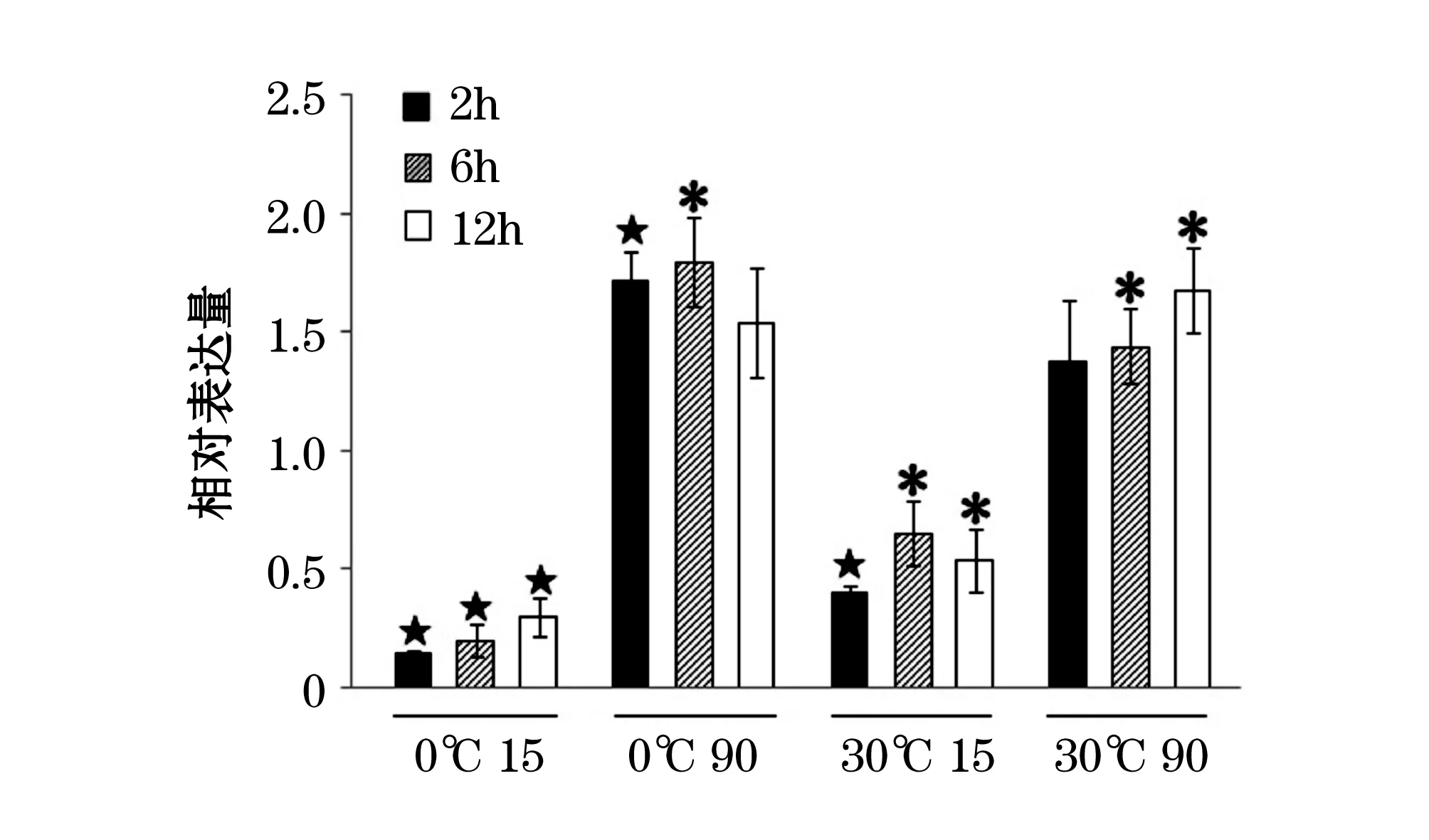
利用RNA提取试剂盒提取总RNA,获得的总RNA的质量通过测定其A260/A280值确定。使用PrimeScript RT Reagent Kit 将得到的500 ng RNA反转录为cDNA。使用SYBR PrimeScriptTMRT-PCR Kit试剂盒进行实时定量分析。以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)基因作为内参基因[13-14]。使用软件Primer 5.0设计Usp1141基因和GAPDH基因实时定量PCR引物,引物Usp1141-QF、Usp1141-QR、GAPDH-QF、GAPDH-QR序列详见表2。qRT-PCR仪为Stratagene Mx3000P qPCR System,反应条件如下:95 ℃,5 s;47 ℃,15 s;72 ℃,20 s,40个循环;72 ℃ 10 min,4 ℃保持。所有实验均重复3次。基于临界循环值(Ct)对mRNA进行定量,采用相对Ct值法(2-ΔΔCt)进行数据处理,对照组Usp1141基因的表达量标准化为1[15]。使用SPSS 16.0对样本的重复性以及样本间的差异进行统计分析。P>0.05时,样本间不存在显著性差异;0.01 表2 基因克隆和qRT-PCR引物Table 2 Primers used in the gene cloning and qRT-PCR analysis 根据南极适冷菌Psychrobactersp. G的基因组测序草图和功能注释,发现一个UspA基因(Usp1141)。通过设计特异性引物,克隆到了该基因的全长序列。基因序列测定表明,该基因ORF长462 bp,编码153个氨基酸,理论蛋白分子量为17 kDa,pI值为5.23。启动子序列-35区(5′-ATGAAA-3′)和-10区(5′-TAGTAAAAT-3′)分别位于-304 bp和 -276 bp处,起始密码子上游11 bp处有一个典型的RBS序列(5′-AGGA-3′)(图1)。Usp1141基因序列及推导的氨基酸序列已提交GenBank,获得的序列注册号为JQ782515。多序列比对结果表明,Usp1141的氨基酸序列与其他已知物种的UspA氨基酸序列存在相似性很高的保守区;Usp1141的二级结构为交替排列的4个α螺旋和5个β折叠;与ATP结合相关的氨基酸残基分别位于β1,β2,β4,α4和β5上(图2)。 从构建的系统发育树可以看出,Usp1141与来自同属菌株Psychrobacterarcticus273-4的UspA进化关系很近,与同科菌株MoraxellacatarrhalisRH4的UspA进化关系次之,而与Escherichiacoli和Bacillussubtilis的UspA的进化关系则较远(图3)。 黑体加下划线代表-35区、-10区和RBS;黑体代表起始密码子ATG和终止密码子TAA图1 Usp1141基因全长序列及其推导的氨基酸序列Fig. 1 Full-length nucleotide sequences and deduced amino acid sequences of Usp1141 gene 序列上方横线代表4个α螺旋和5个β折叠;序列下方的黑线代表与ATP接触的氨基酸残基(A: 腺嘌呤; R: 核糖;P: 磷酸基团; D: 二聚物表面)图2 Usp1141与其他菌种UspA的多序列比对Fig. 2 Sequence alignment of Usp1141 with other representative bacterial UspA 图3 Usp1141的系统发育分析Fig. 3 Phylogenetic analysis of Usp1141 qRT-PCR研究结果表明,温度对Psychrobactersp. GUsp1141基因的表达基本没有影响。无论是低温(0,10 ℃)还是高温(30 ℃)处理,其表达均没有显著性变化(图4)。 图4 Usp1141基因对温度胁迫的应答特征Fig. 4 Expression characteristics of Usp1141 gene in response to temperature stresses 图5 Usp1141基因对盐度胁迫的应答特征Fig. 5 Expression characteristics of Usp1141 gene in response to salinity stresses 当培养基盐度(0,15)低于菌株G生长的最适盐度时,Usp1141基因的表达会受到显著抑制。当培养基盐度为0且处理时间为12 h时,其表达量最低,仅为对照的0.25倍;当培养基盐度(90,120)高于菌株生长的最适盐度时,Usp1141基因的表达水平则会显著升高;当盐度为120且处理时间为6 h时,其表达量为对照的2倍(图5)。 图6 Usp1141基因对温度和盐度协同胁迫的应答特征Fig. 6 Expression characteristics of Usp1141 gene in response to combined stresses of temperature and salinity 当培养基盐度低于菌株生长的最适盐度时,无论温度低于还是高于最适温度,Usp1141基因的表达均受到抑制。当培养温度为0 ℃,培养基盐度为15时,其表达受到显著抑制,仅为对照的0.15倍;当培养温度为30 ℃,培养盐度为15,处理时间为2 h时,其表达量仅为对照组的0.41倍。当培养基盐度高于菌株生长的最适盐度时,无论温度低于还是高于最适温度,Usp1141基因的表达水平均会提高。当培养温度为0 ℃,培养基盐度为90的培养条件时,基因表达量会显著升高,并在6 h后达到对照组的1.8倍;当培养温度为30 ℃,培养基盐度为90时,基因表达量在前2 h内无明显变化,但在随后的10 h内,其表达量会显著提高,达到对照组的1.7倍(图6)。 极地生态系统的独特性为研究极端条件环境下微生物的适应机制提供了极好的资源。南极细菌Psychrobactersp. G分离自南极乔治王岛西南部的水样中,其最适生长温度为20 ℃,当温度高于30 ℃则完全停止生长,表明该菌属于适冷菌。本研究从Psychrobactersp. G中克隆得到了1个USP编码基因Usp1141。 多序列比对结果表明,Usp1141的氨基酸序列与其他已知物种的UspA氨基酸序列存在相似性很高的保守区,并发现有与结合ATP相关的氨基酸残基(图2)。这些表明Usp1141可能与其他UspA蛋白发挥类似的生物学功能,并通过与ATP结合来发挥作用[16]。进化树分析表明,Usp1141与同属的Psychrobacterarcticus 273-4的UspA进化关系较近,与同一科的Moraxella catarrhalis RH4(YP_003627803)的UspA进化关系次之,这与上述菌株基于16S rRNA的系统进化关系基本一致(图3)。 实时定量PCR研究表明,温度变化对Usp1141基因的表达基本没有影响(图4),与之不同的是,热激处理会诱导中温菌大肠杆菌UspA的表达[5],这表明适冷菌Psychrobactersp. G可能采取其他机制来适应外界温度的变化,如在低温下诱导冷激蛋白的表达[17-19],高温下诱导热激蛋白的表达等[20-21]。当培养基盐度低于菌株生长的最适盐度时(0,15),Usp1141基因的表达会受到显著抑制;而高盐度(90,120)下其表达量则会显著提高(图5)。这表明Usp1141可能在菌株G对渗透压变化的适应性中发挥作用。在自然条件下,南极细菌通常需要同时面对多种环境压力,如在南极地区,温度变化通常伴随着盐度变化[3]。因此对温度盐度协同胁迫下Usp1141基因的表达情况也进行了研究。结果表明,Usp1141基因在温盐协同胁迫下的表达情况与在温度和盐度单因子影响时的表达情况基本一致,即Usp1141基因表达量的变化与温度无关,低盐度会抑制其表达,而高盐度会诱导其表达(图6)。 尽管USP已经在很多物种中发现,但其明确的作用机理还不清楚。且之前的研究主要集中于嗜中温菌大肠杆菌[6, 8-9],对南极适冷菌的USP的研究目前尚未见报道。南极适冷菌Psychrobactersp. G 的生存环境与大肠杆菌完全不同,本研究对阐明适冷菌中USP的作用机理有一定意义。 参考文献(References): [1] MARGESIN R, SCHINNER F. Properties of cold-adapted microorganisms and their potential role in biotechnology [J]. Journal of Biotechnology, 1994, 33(1):1-14. [2] PEARCE D A. Climate change and the microbiology of the Antarctic peninsula region [J]. Science Progress, 2008, 91(2):203-217. [3] THOMAS D N, DIECKMANN G S. Antarctic Sea ice--a habitat for extremophiles [J]. Science, 2002, 295(25):641-644. [4] VAN BOGELEN R A, HUTTON M E, NEIDHARDT F C. Gene-protein database ofEscherichiacoliK-12: edition 3 [J]. Electrophoresis, 1990, 11(12):1131-1166. [5] KVINT K, NACHIN L, DIEZ A, et al. The bacterial universal stress protein: function and regulation [J]. Current Opinion in Microbiology, 2003, 6(2):140-145. [6] GUSTAVSSON N, DIEZ A, NYSTROM T. The universal stress protein paralogues ofEscherichiacoliare co-ordinately regulated and co-operate in the defence against DNA damage [J]. Molecular Microbiology, 2002, 43(1):107-117. [7] NACHIN L, BRIVE L, PERSSON K C, et al. Heterodimer formation within universal stress protein classes revealed by an in silico and experimental approach [J]. Journal of Molecular Biology, 2008, 380(2):340-350. [8] NYSTR M T, NEIDHARDT F C. Cloning, mapping and nucleotide sequencing of a gene encoding a universal stress protein inEscherichiacoli[J]. Molecular Microbiology, 1992, 6(21):3187-3198. [9] SIEGELE D A. Universal stress proteins inEscherichiacoli[J]. Journal of Bacteriology, 2005, 187(18):6253-6254. [10] LIN X Z, CUI S S, XU G Y, et al. Cloning and heterologous expression of two cold-active lipases from the Antarctic bacteriumPsychrobactersp. G [J]. Polar Research, 2010, 29:421-429. [11] PANICKER G, MOJIB N, NAKATSUJI T, et al. Occurrence and distribution of capB in Antarctic microorganisms and study of its structure and regulation in the Antarctic biodegradativePseudomonassp. 30/3 [J]. Extremophiles, 2010, 14(2):171-183. [12] KUMAR S, NEI M, DUDLEY J, et al. MEGA: A biologistcentric software for evolutionary analysis of DNA and protein sequences [J]. Briefings in Bioinformatics, 2008, 9(4):299-306. [13] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR [J]. Nucleic Acids Research, 2001, 29(9):e45. [14] HUGGETT J, DHEDA K, BUSTIN S, et al. Real-time RT-PCR normalisation; strategies and considerations [J]. Genes and Immunity, 2005, 6(4):279-284. [15] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(Delta Delta C(T)) method [J]. Methods, 2001, 25(4):402-408. [16] ZAREMBINSKI T I, HUNG L W, MUELLER D H, et al. Structure-based assignment of the biochemical function of a hypothetical protein: a test case of structural genomics [J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(26): 15189 15193. [17] BAKERMANS C, TOLLAKSEN S L, GIOMETTI C S, et al. Proteomic analysis ofPsychrobactercryohalolentisK5 during growth at subzero temperatures [J]. Extremophiles, 2007, 11(2):343-354. [18] BERGER F, MORELLET N, MENU F, et al. Cold shock and cold adaptation proteins in the psychrotrophic bacteriumArthrobacterglobiformisSI55 [J]. Journal of Bacteriology, 1996, 178(11):2999-3007. [19] KAWAMOTO J, KURIHARA T, KITAGAWA M, et al. Proteomic studies of an Antarctic cold-adapted bacterium,ShewanellalivingstonensisAc10, for global identification of cold-inducible proteins [J]. Extremophiles, 2007, 11(6):819-826. [20] LIU S, ZHANG P, CONG B, et al. Molecular cloning and expression analysis of a cytosolic Hsp70 gene from Antarctic ice algaeChlamydomonassp. ICE-L [J]. Extremophiles, 2010, 14(3):329-337. [21] GARC A D L, ALCAZAR A, BAQUERO F, et al. Identification of in vivo HSP90-interacting proteins reveals modularity of HSP90 complexes is dependent on the environment in psychrophilic bacteria [J]. Cell Stress Chaperones, 2011, 16(2):203-218.
2 结果与分析
2.1 Usp1141基因核苷酸及蛋白氨基酸序列分析


2.2 Usp1141基因对温度胁迫的应答特征


2.3 Usp1141基因对盐度胁迫的应答特征
2.4 Usp1141基因对温度和盐度协同胁迫的应答特征
3 讨 论
- 海洋科学进展的其它文章
- 《海洋科学进展》征稿简则

