一株产紫杉醇的南方红豆杉内生菌的分离与鉴定
李昆太,彭卫福,周 佳,黄 林,程 新
(江西农业大学 生物科学与工程学院,江西 南昌 330045)
紫杉醇(paclitaxel,商品名taxol)系三环二萜类生物碱[1],是当今世界公认的广谱、疗效确切的天然抗癌药物。早在1971年,美国化学家Wani等[2]最先从太平洋短叶红豆杉(Taxus brevifolia)的树皮中分离提取到紫杉醇。由于紫杉醇在树皮中的含量极低(平均产量约0.015%)[3],使得传统的从红豆杉植株中直接提取紫杉醇的方式受到了极大的限制和挑战。因此,如何寻求到新的药源途径来生产紫杉醇,成为了国内外药学界急需解决的课题。
植物内生菌在与宿主植物长期共进化过程中,可产生一系列具有抗肿瘤、抗菌、抗病毒、杀虫等作用的生物活性物质[4-6]。因此,从植物内生菌中寻找并开发新的生物活性物质,正成为国内外学者研究的热点。1993年,Stierle等[7]首次从短叶红豆杉中分离到一株能产紫杉醇的内生真菌紫杉霉(Taxomyces andreanae),该发现极大地激发了国内外学者开展产紫杉醇内生菌的研究热潮。
本文以南方红豆杉(Taxus chinensis var.mairei)植株为材料,从中分离筛选到1株具有产紫杉醇能力的内生真菌,并通过菌株形态学观察以及18S rRNA序列分析对该菌株进行了鉴定。
1 材料和方法
1.1 主要仪器
摇床、离心机、培养箱、电子天平、高效液相色谱仪、超声波细胞破碎仪等。
1.2 材料
供试植物为采自于江西农业大学中药园的南方红豆杉新鲜树枝,紫杉醇标准品(上海源叶生物工程有限公司),牛肉膏(北京奥博星生物技术有限公司),蛋白胨(北京奥博星生物技术有限公司),其它试剂均为国产分析纯。
1.3 培养基
1.3.1 内生菌分离平板培养基 PDA培养基(g/L):马铃薯(去皮煮汁,过滤取液)200;葡萄糖20;琼脂20;pH自然。牛肉膏蛋白胨培养基(g/L):牛肉膏5;蛋白胨10;氯化钠5;琼脂20;pH 7.0~7.2。高氏一号培养基(g/L):可溶性淀粉 20;KNO31;K2HPO40.5;MgSO4·7H2O 0.5;NaCl 0.5;FeSO4·7H2O 0.01;琼脂20;pH 7.2 ~7.4。
1.3.2 内生菌发酵培养基(g/L) 马铃薯(去皮煮汁,过滤取液)200;葡萄糖10;蔗糖10;硫酸镁0.15;乙酸钠1.0;苯丙氨酸0.02;pH自然。
1.3.3 内生菌鉴定培养基 察氏培养基(g/L):硝酸钠3.0;磷酸氢二钾1.0;硫酸镁0.5;氯化钾 0.5;硫酸亚铁0.01;蔗糖30;琼脂20;pH自然。
1.4 内生菌的分离纯化
采用组织块法对南方红豆杉内生菌进行分离[8]。将采集的新鲜南方红豆杉茎表面以无菌水冲洗干净,在无菌操作室中用体积分数75%的酒精溶液浸泡3 min,以无菌水冲洗4至5次,然后用体积分数0.1%升汞溶液浸泡3 min,再用无菌水冲洗4~5次。将经上述处理的材料按无菌操作技术,切成0.5 cm×0.5 cm的小段,分别覆盖接种至PDA、牛肉膏蛋白胨、高氏一号等分离培养基平板上,然后置于28℃恒温培养箱中培养。当观察到组织块边缘有丝状真菌长出后,及时将边缘菌丝转接到新鲜的培养基平板上进行划线纯化。
1.5 内生菌产紫杉醇的鉴定
1.5.1 内生真菌的发酵培养方法 每支内生真菌的新鲜斜面以10 mL无菌水洗下菌丝体,打碎均匀制成菌悬液。吸取1 mL菌悬液接至装量为50 mL/250 mL三角瓶的发酵培养基中,28℃振荡(150 r/min)培养7 d。
1.5.2 内生真菌发酵液的预处理[9]摇瓶发酵结束后,用干净的4层纱布过滤发酵液,分别收集滤液和菌丝体。滤液用等体积的二氯甲烷萃取2次,每次1 h,合并二氯甲烷萃取相,加入无水硫酸钠干燥,过滤后35℃下以旋转蒸发仪除去有机溶剂,得到粗提物Ⅰ;菌丝体反复冻融3次后,用超声波细胞破碎仪破碎菌体(可涂片在显微镜下观察菌丝破碎与否),加入30 mL甲醇浸提1 h,过滤后,35℃下以旋转蒸发仪除去有机溶剂,得到粗提物Ⅱ;粗提物Ⅰ和Ⅱ合并,以5 mL甲醇溶解后,用薄层层析和HPLC法进行紫杉醇的鉴定。
1.5.3 薄层层析(TLC)鉴定法 用毛细吸管吸取内生真菌发酵液的处理液,点样于硅胶G板(50 mm×100 mm,使用前放入105℃烘燥箱中活化30 min)的底部,以紫杉醇标准品溶液为对照。点样后,用甲醇∶氯仿=1∶7(V/V)的混合液为展开剂进行展层,展层结束后以饱和碘蒸气进行斑点的显色。
1.5.4 HPLC 鉴定法 高效液相系统:Aglient 1100 HPLC;色谱柱:Kromasil C18 column(4.6 mm ×250 mm,5 μm);流动相:H2O/乙腈 =5/5(v/v);流速:1 mL/min;检测波长:227 nm;柱温:25 ℃;进样量:20 μL。
1.6 内生菌的分类鉴定
1.6.1 菌株形态特征观察[10]经薄层层析与HPLC法确定产紫杉醇类物质的内生真菌,在察氏培养基上分别采用点植培养法、载片培养观察法以及插片法观察菌落、菌丝体和孢子的形态特征,该菌株进行初步鉴定。
1.6.2 18S rRNA序列测定及系统进化分析 以内生真菌的基因组DNA为模板,用NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS6(5'-GCATCACAGACCTGTTATTGCCTC-3')为18S rRNA上下游引物进行PCR扩增。PCR产物经纯化后由上海生工生物工程有限公司测序。将得到的18S rRNA序列与GenBank数据库中的序列进行BLAST相似性比对,下载同源性较高的序列,保存成FASTA格式的文件,利用MEGA 4.0软件构建系统进化树。
2 结果与分析
2.1 南方红豆杉内生菌的分离及其发酵产物的初步鉴定
以南方红豆杉植株的茎部为材料,从中分离纯化得到5株内生真菌,初步命名为红茎-1、红茎-2、红茎-3、红茎-4、红茎-5。将这5株内生真菌的发酵液处理物首先进行TLC分析,结果发现红茎-3的发酵液处理物与紫杉醇标准品具有相同的比移值(Rf≈0.93)和颜色相近的显色斑点(图1),这初步表明红茎-3可能具有产紫杉醇的能力。
为了进一步验证红茎-3能否产紫杉醇,将其发酵液处理物与紫杉醇标准品进行HPLC分析,二者的HPLC图谱如图2所示。
由图2可以看出,紫杉醇标准品和红茎-3的发酵液浸提物具有相同保留时间的洗脱峰,二者均在3.1 min左右。综合红茎-3发酵液浸提物以及紫杉醇标准品的TLC和HPLC分析,可以初步判定红茎-3具有发酵产紫杉醇的能力。需要说明的是,尽管初步判定了红茎-3具有产紫杉醇的能力,但是还需进一步对其发酵产物进行分离纯化,并借助紫外光谱、质谱、红外光谱、核磁共振等技术手段进行结构解析。

图1 红茎-3发酵液处理物与紫杉醇标准品的薄层层析比较Fig.1 The TLC comparison between Red stem -3 fermentation broths with standard paclitaxel
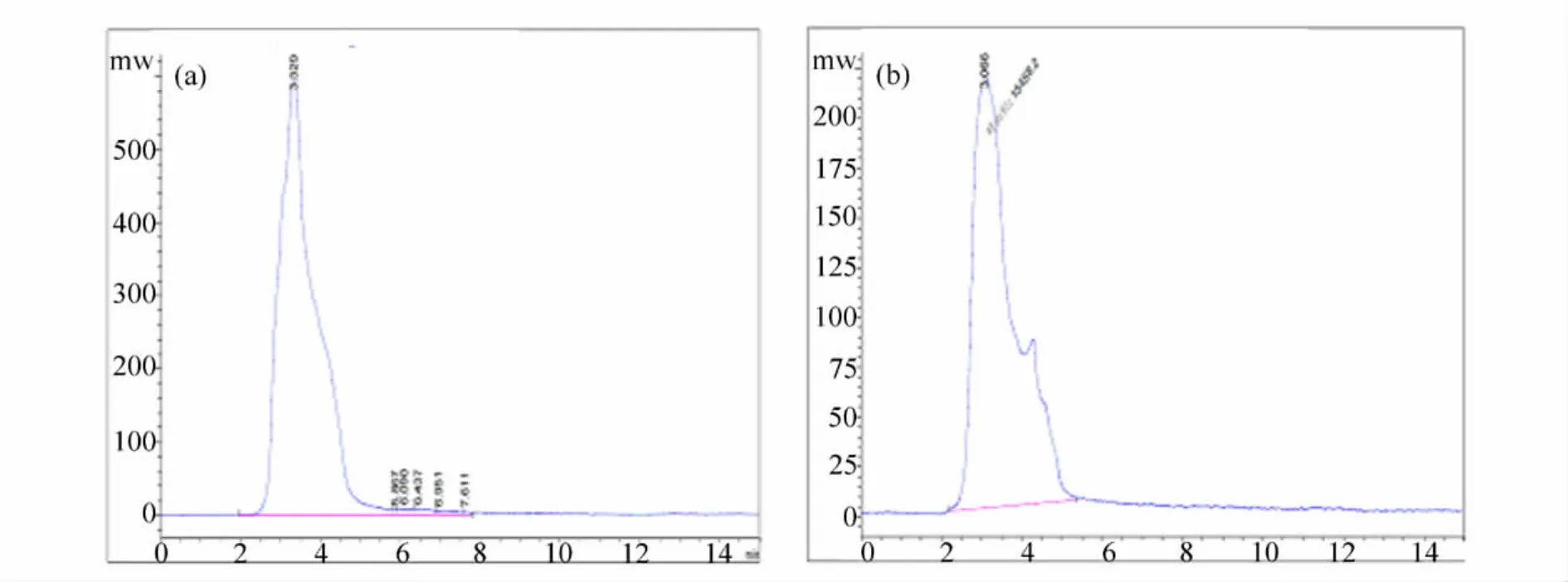
图2 紫杉醇标准品(a)与红茎-3发酵液处理物(b)的HPLC图谱Fig.2 The HPLC figures of standard paclitaxel(a)and Red stem -3 fermentation broths(b)
2.2 红茎-3的菌种鉴定
2.2.1 红茎-3的菌株形态特征观察 红茎-3菌株点植于察氏培养基平板上,菌丝生长速率快,培养2 d后菌落直径可达6 cm左右,3 d可长满整个培养皿。菌落在前3 d呈白色绒毛状,后期转变成深褐色,如图3所示。借助插片法和载片法对红茎-3的菌丝和分生孢子形态进行显微观察,可以看出红茎-3菌丝发达呈交织的分支状(图4a),菌丝有横隔(图4b),分生孢子呈椭圆形且紧密聚集形成子囊壳结构(图4c)。
根据以上形态特征观察,可初步鉴定红茎-3为子囊菌亚门的核菌纲。
2.2.2 红茎-3的18S rRNA序列测定及系统进化分析 将红茎-3(IS279)的18S rRNA序列与Gen-Bank数据库序列进行BLAST相似性搜索,收集相似性较高的序列,利用MEGA 4.0软件,Neighbor-Joining法构建系统进化树,结果如图5所示。

图3 红茎-3的菌落形态特征Fig.3 The morphologic colony of Red stem-3(culture for 48 h)
由图5可以看出,红茎-3与间座壳属 2个菌株(Diaporthe sp.MI 02和Diaporthe sp.MI 03)聚类在同一个分支上,序列同源性为99%。根据红茎-3的形态和生物学特征,及其序列同源性比较的结果,内生菌红茎-3菌株可鉴定为间座壳属(Diaporthe sp.),并初步命名为Diaporthe sp.H-3。
3 讨论
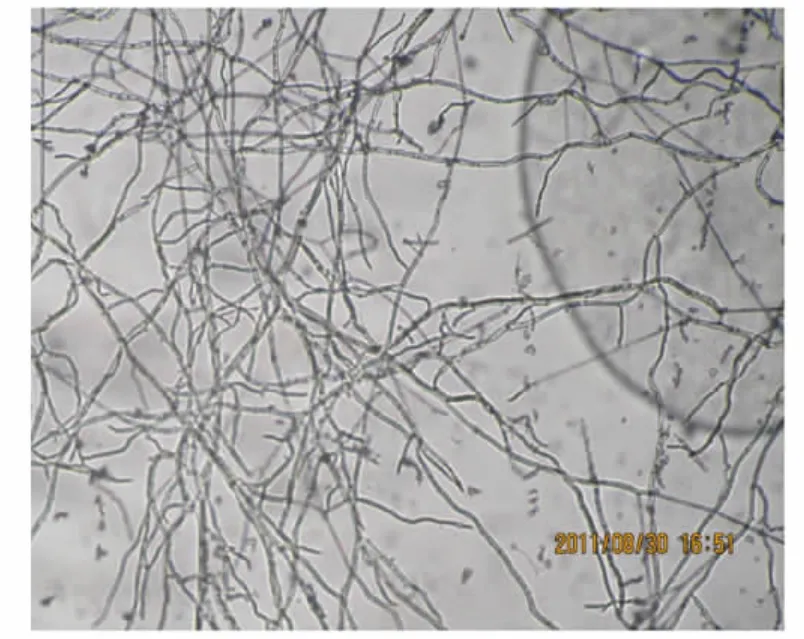
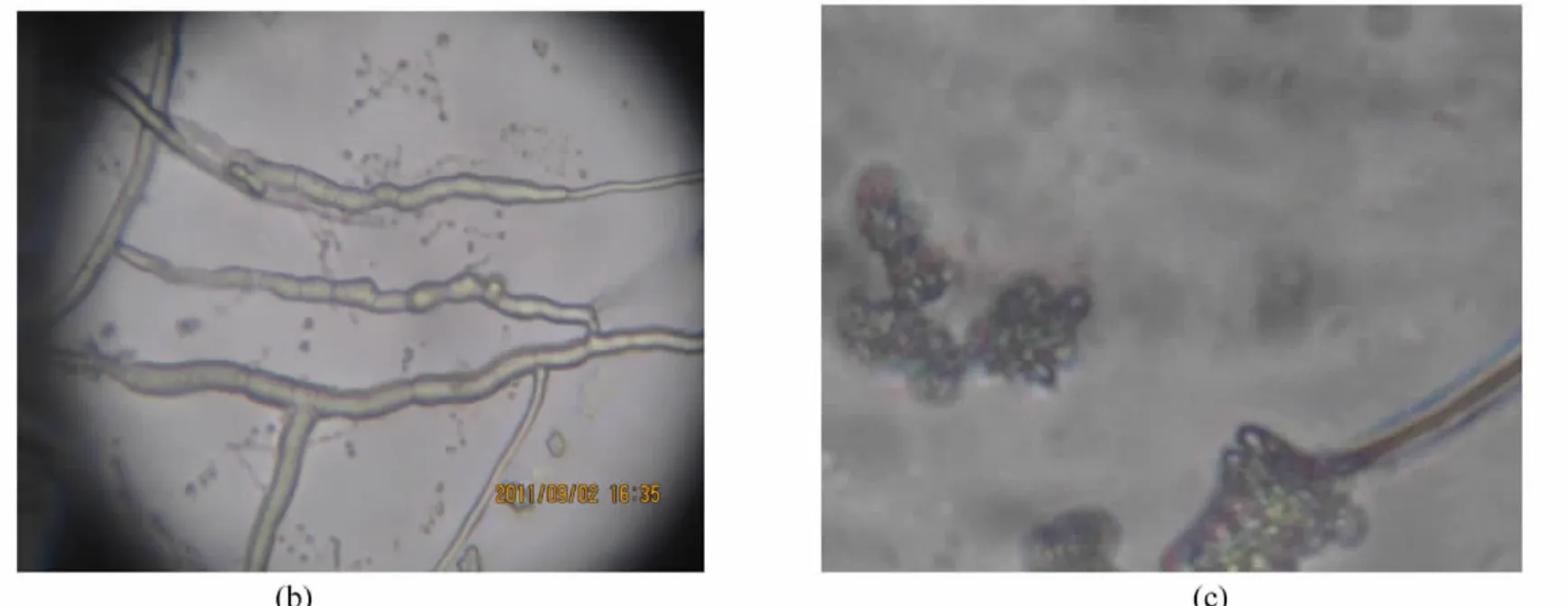
图4 红茎-3的菌丝体及孢子形态图Fig.4 The morphologic hyphal and acervulus of endophyte Red stem-3
目前的紫杉醇生产技术,即从红豆杉原料中直接提取紫杉醇或其中间体的方法,已远远不能满足市场需求。由于微生物发酵法具有菌体生长快、发酵周期短、产物产率高、生产成本低且发酵过程易实现自动化控制等诸多优势,因此利用植物内生真菌工业化发酵产紫杉醇或中间体,是解决这个问题的有效途径。
到目前为止,国内外已报道的从红豆杉属植物中分离到的产紫杉醇内生真菌多达20多个属,且多以霉菌为主,如 Taxomyces andreanae(紫杉霉属)、Fusarium lateritum(镰刀霉属)、Alternariu sp.(交链霉属)、Pestalotiopsis micropora(盘多拉毛霉属)、Nodulisporium sylviform(多节孢属)等[11-12]。除了红豆杉属植物外,从非红豆杉属植物中,如木橘[13]、榧树[14]、夹竹桃[15]、柏树[16]等,也分离筛选到了可产紫杉醇的各种内生真菌。这充分说明了紫杉醇产生菌具有生物多样性,同时也显示了紫杉醇产生菌宿主的生物多样性。
迄今,国内外许多学者不仅在产紫杉醇内生菌的分离筛选方面做了大量的工作,而且就产紫杉醇内生菌的菌种选育及其发酵工艺优化等方面也进行了大量研究[17-19]。尽管利用内生真菌进行紫杉醇的发酵生产已显示出诱人的前景和巨大的潜力,而且借助高产菌种的选育、发酵条件的优化等手段使得内生菌产紫杉醇的能力得到了大幅度的提高,但是这些研究大多停留在实验室阶段,目前仍难以实现中型或大型工业化规模的发酵生产[20]。究其原因,还在于缺乏适合于工业化的高产菌株。因此,寻找高产紫杉醇的内生菌株并建立合适的发酵工艺控制路线,仍然是今后的重点研究方向。

图5 红茎-3的18S rRNA序列系统进化树Fig.5 The phylognetic tree of Red stem-3 18S rRNA sequences
本文以南方红豆杉植株为材料开展了内生菌的分离筛选,并最终获得一株具有产紫杉醇能力的内生真菌Diaporthe sp.H-3。值得注意的是,目前有关间座壳属内生菌产紫杉醇的报道尚属首次,但Diaporthe sp.H-3发酵产紫杉醇的潜能还有待进一步的研究。
[1]纪元,毕建男,严冰,等.产紫杉醇真菌的研究概况与紫杉醇工业生产的一个新思路[J].生物工程学报,2006,22(1):1-6.
[2]Wani M C,Taylor H L,Wall M E,et al.Plant antitumor agents VI:The isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J].J Am Chem Soc,1971,93:2325 -2327.
[3]Vidensek N,Lim P,Campbell A,et al.Taxol content in bark,wood,root,leaf,twig,and seedling from several Taxus species[J].J Nat Prod,1990,53(6):1609 -1615.
[4]张祺玲,杨宇红,谭周进.植物内生菌的功能研究进展[J].生物技术通报,2010,7:28-34.
[5]江曙,陈代杰,陶金华.植物内生菌及其代谢产物的药学研究进展[J].中国生化药物杂志,2008,29(6):424-426.
[6]Aly A H,Debbab A,Proksch P.Fungal endophytes:unique plant inhabitants with great promises[J].Appl Microbiol Biotechnol,2011,90:1829 -1845.
[7]Stierle A,Strobel G A,Stierle D.Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of Pacific Yew[J].Science,1993,260:214 -216.
[8]陈传文,孙前光,朱军,等.三种药用植物内生菌的分离及其抗肿瘤活性菌株的筛选[J].微生物学通报,2010,37(10):1462-1466.
[9]竺俊鑫,李勇超,孟丽.红豆杉中产紫杉醇内生真菌分离部位的比较研究[J].生物技术通报,2008,4:191-194.
[10]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990,93-105.
[11]马玉超,赵凯,王世伟,等.产紫杉醇(Taxol)内生真菌的生物多样性[J].菌物研究,2003,1(1):28-32.
[12]赵凯,平文祥,周东坡.内生真菌发酵生产紫杉醇的研究现状与展望[J].微生物学报,2008,48(3):403-407.
[13]Gangadevi V,Muthumary J Taxol,an anticancer drug produced by an endophytic fungus Bartalinia robillardoides Tassi,isolated from a medicinal plant,Aegle marmelos Correa ex Roxb[J].World J Microbiol Biotechnol,2008,24:717 - 724.
[14]Li J Y,Sidhu R S,Ford E J,et al.The induction of taxol production in the endophytic fungus-Periconia sp from Torreya grandifolia[J].Journal of Industrial Microbiology and Biotechnology,1998,20:259 -264.
[15]Kumaran R S,Muthumary J,Hur B.Isolation and identification of an anticancer drug,Taxol from Phyllosticta tabernaemontanae,a leaf spot fungus of an angiosperm,Wrightia tinctoria[J].The Journal of Microbiology,2009,47(1):40 -49.
[16]严冰,毕建男,纪元,等.一株柏树内生真菌产生抗肿瘤药物紫杉醇[J].南开大学学报:自然科学版,2007,40(6):67-70.
[17]赵凯,平文祥,张丽娜,等.用Genome shuffling技术选育紫杉醇高产菌株[J].中国科学(C 辑),2008,38(3):221 -229.
[18]赵凯,周东坡,平文祥.产紫杉醇菌株原生质体诱变育种的研究[J].生物工程学报,2005,21(5):847-850.
[19]王世伟,马玺,平文祥,等.微生物发酵生产紫杉醇研究进展[J].微生物学通报,2007,34(3):561-565.
[20]林福呈,刘小红,王洪凯,等.紫杉醇及其产生菌的研究现状与展望[J].微生物学报,2003,43(4):534-538.

