紫薇离体茎段快速繁殖体系研究
段丽君,李国瑞,童 俊,叶要妹*
(1.华中农业大学 园林学院,湖北 武汉 430070;2.华中农业大学 理学院,湖北 武汉 430070;3.武汉市林业果树科学研究所,湖北 武汉 430075)
紫薇(Lagerstroemia indica)隶属于千屈菜科(Lythraceae)紫薇属,别名“百日红”、“痒痒树”、“满堂红”,主要分布在亚洲东部至南部和澳大利亚的北部[1]。作为园林观赏植物,紫薇有其独特的观赏价值,树姿优美,在夏季少花季节开花,不仅花期长,而且花色丰富,是重要的园林绿化树种。紫薇传统繁殖方式主要是播种和扦插,但繁殖速度慢,性状易变异。利用组织培养的方法培育苗木,具有繁殖速度快、繁殖系数高、保持繁殖材料及新植株的优良种性,从而提高种苗质量,具有重要的意义及应用前景[2]。但长期以来,有关紫薇离体培养研究报道比较少,1984年黄钦才[3]最早报道培养利用紫薇腋芽快速繁殖,杨彦伶[4]、瞿宏杰[2]需经过6 ~7 次继代培养,得到每丛20 ~50 个丛生芽,李晓青[6]和曹受金[2]探讨紫薇茎段诱导、增殖、生根的培养基配方。现国内已获得了紫薇腋芽的增生[3,6-8],枝条的快繁[9],叶片的再生[10]和种子无菌苗[5],但多局限于培养基配方的优化,没有建立从外植体消毒到生根炼苗比较系统、稳定的再生体系,难以满足科研、生产的需求。现以紫薇茎段为材料,旨在通过消毒时间、取材季节、基本培养基、激素配比等一系列的研究,确定适宜于紫薇茎段植株再生的最佳途径,建立、完善其离体再生体系,从而满足紫薇及其相关树种的树木改良研究及其优良苗木快速繁殖的需要。
1 材料与方法
1.1 试验材料
在华中农业大学花卉基地内选择株高2 m左右、生长健壮的2~3年生优良紫薇单株。
1.2 试验方法
1.2.1 茎段消毒时间的筛选 5月份,选取紫薇当年生的中上部枝条,剪取带腋芽茎段和顶芽茎段部分,分别用洗衣粉水清洗后流水冲洗30 min以上。然后,在超净工作台上,分别用75%的酒精处理30 s,无菌水冲洗2~3次,接着用0.1%的升汞处理,具体是带腋芽茎段分别处理6,8,10 min,顶芽茎段分别处理4,6,8 min,无菌水冲洗3~5次,最后用无菌滤纸吸干外植体上的水分,分别接种于MS+6-BA 1.0 mg/L+NAA 0.05 mg/L的培养基上。然后将其放于培养室进行培养,每个处理10个外植体,重复3次,15 d后统计污染率,萌发率、褐化率。
污染率:污染的外植体数/外植体总数×100%;褐化率:褐化的外植体数/外植体总数×100%;萌发率:萌发外植体数/外植体总数×100%。
1.2.2 取材时间对带芽茎段萌发的试验 分别于春季4月、夏季6月、秋季9月3个不同时间段取材对茎段进行试验,将带腋芽茎段接种到培养基MS+6-BA 1.0 mg/L+NAA 0.05 mg/L上。每个处理10个外植体,重复3次,观察外植体污染率、腋芽萌发率及其生长情况。
1.2.3 带芽茎段的初代培养 试验采用双因素完全随机设计,6-BA 3个水平为0.5,1.0,2.0 mg/L,NAA 2个水平为0.05,0.1 mg/L,共6个处理组合。消毒后将带顶芽茎段和带腋芽茎段分别接种到6个处理组合中,每个处理10个外植体,重复3次。第15天统计污染率和萌发率。
1.2.4 带芽茎段的增殖 第15天将初代培养萌发的腋芽和顶芽切取转接到4种增殖培养基上培养:(1)MS+6 - BA 0.5 mg/L+NAA 0.05 mg/L;(2)MS+6 - BA 1.0 mg/L+NAA 0.05 mg/L;(3)MS+6-BA 1.0 mg/L+NAA 0.1 mg/L;(4)MS+6 -BA 2.0 mg/L+NAA 0.1 mg/L。1 个月后再次继代与原培养基相同的培养基上,每个处理10个外植体,重复3次,培养30 d后观察腋芽和不定芽发生状况,统计增殖倍数。增殖倍数:腋芽增殖的芽总数/外植体总数。
1.2.5 壮苗培养 以紫薇增殖苗为外植体进行试验,培养基设3个处理,(1)MS;(2)MS+GA30.5 mg/L;(3)MS+GA31.0 mg/L,每个处理10个外植体,重复3次,培养30 d后统计株高及生长情况。
1.2.6 生根培养 在继代丛生芽中选取生长良好,长度在2 cm以上的嫩枝,切去基部愈伤,将其接入以 1/2MS 为基本培养基,同时分别附加 IBA 0.2,0.5,1.0 mg/L 或 NAA0.2,0.5,1.0 mg/L 3 个浓度的培养基中进行培养,每个处理10个外植体,重复3次,40 d后统计生根率、生根数、平均根长。
生根数:长度大于0.5 cm的根个数;生根率:生根的外植体数/外植体总数×100%。
1.2.7 数据观测与统计分析 如无特别交代,本实验中的初代、继代及分化的基本培养基为MS,琼脂含量为7.0 g/L,蔗糖浓度为30 g/L;生根培养的基本培养基为1/2MS,琼脂为7.0 g/L;培养基pH值:5.8~6.0。灭菌条件:121℃、1.1 kg/cm2灭菌 20 min;培养室条件:温度为(25±2)℃、光强为1 400 lx、光周期为14 h光/10 h暗的条件。
试验数据采用SAS统计软件进行分析,百分率的数据分别先经反正弦转换、对数转换后进行方差分析和多重比较。
2 结果与分析
2.1 消毒时间对茎段消毒的影响
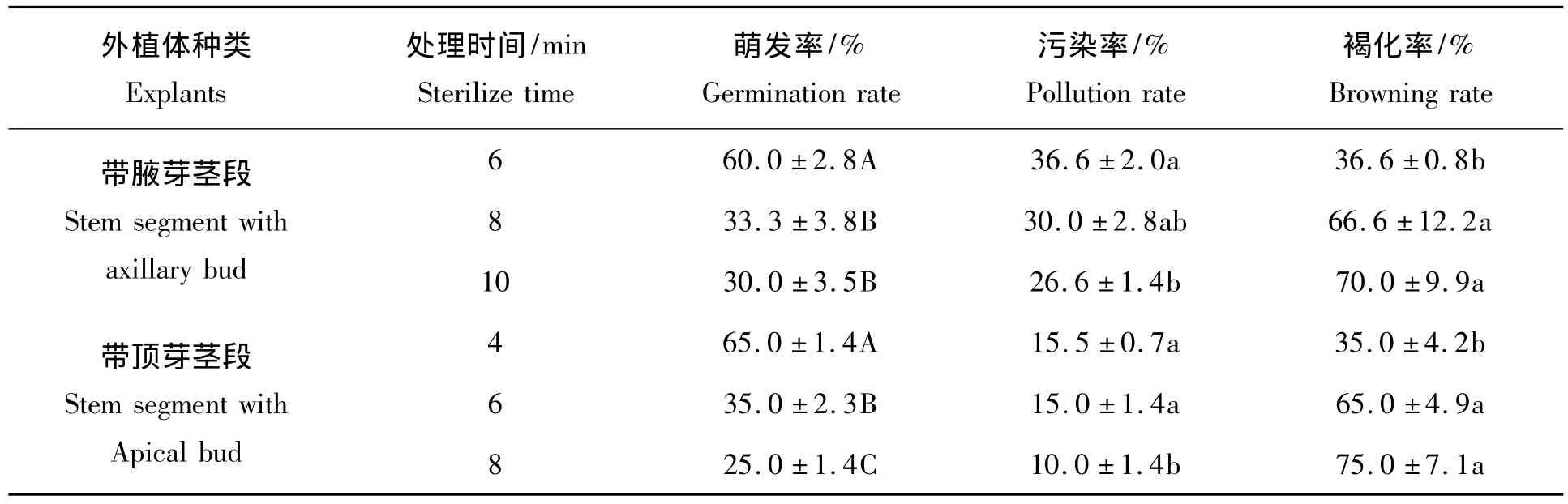
表1 不同消毒时间对紫薇外植体消毒的影响Tab.1 Effects of different sterilization treatment on survival of Lagerstroemia indica
外植体的消毒处理对进行组织培养研究有着至关重要的作用,消毒时间恰当,可以减少外植体的污染和材料的损失。从表1可以得出HgCl2处理时间对紫薇的腋芽茎段污染率和褐化率有显著影响,对萌发率有极显著的影响,进一步的多重比较结果显示:带腋芽的茎段用HgCl2溶液消毒6 min萌芽率最高,褐化率最低,污染率也相对较小,效果最佳;带顶芽的茎段在用HgCl2溶液消毒4 min萌芽率高,污染率和褐化率均较低,效果好。
2.2 取材季节对腋芽茎段萌发的影响

表2 取材季节对腋芽萌发的影响Tab.2 Effects of sampling time on germinating
取材季节对腋芽茎段的污染率和萌发率均有极显著的影响,进一步的多重比较结果显示,污染率的高低顺序是:秋季、夏季、春季,萌发率的高低顺序是:夏季、秋季、春季,且试验观察到夏季和秋季萌条的生长势好于春季萌发的。综合污染率、萌发率及萌条的生长势,夏季的腋芽茎段培养效果最好。
2.3 带腋芽茎段初代培养
方差分析结果表明,6-BA和NAA浓度对紫薇茎段腋芽的萌发率均达显著的影响,6-BA和NAA不同浓度之间的交互作用对紫薇茎段腋芽的萌发率作用不明显。从表3可以得出6-BA浓度为1.0 mg/L时萌芽率最高,萌发率和芽长都显著好于0.5 mg/L时的,但6-BA浓度为1.0 mg/L和2.0 mg/L两者萌发率和芽长没有显著性差异;NAA在浓度为0.1 mg/L时的萌芽率要显著好于0.05 mg/L的。理论上,诱导紫薇茎段萌发效果比较好的是6-BA 1.0 mg/L+NAA 0.1 mg/L和6-BA 2.0 mg/L+NAA 0.1 mg/L 这两个组合。

表3 6-BA和NAA对带腋芽茎段萌发的影响Tab.3 Effects of 6 -BA and NAA on ratio of shooting
由表4的6-BA和NAA不同浓度组合对腋芽诱导率及芽生长势的实际效果来看,6-BA 1.0 mg/L+NAA 0.1 mg/L和6-BA 2.0 mg/L+NAA 0.1 mg/L这两个组合的萌发率较高。随着培养时间的延长,腋芽的生长情况有所不同。在浓度为1.0 mg/L时腋芽生长健壮(图1-A);浓度为2.0 mg/L时腋芽生长速度快,芽长但节间较长,苗细弱。因此,根据萌发率、生长势及增殖倍数的结果,带腋芽茎段的初代培养基选用 MS+6 -BA 1.0 mg/L+NAA 0.1 mg/L。

表4 不同组合处理对紫薇带腋芽茎段诱导的影响Tab.4 Effects of different treatment on axillary bud induction
2.4 带芽茎段的增殖
切取初代培养萌发的腋芽继代于不同处理的培养基上,开始继代时,只有腋芽萌发增殖;经过4次继代后,茎基部出现了大量丛生芽(图1-B)。4个处理中都有丛生芽发生,表5方差分析表明,各处理间对平均芽个数及丛生芽长有显著性差异,多重比较结果显示:处理3诱导丛生芽个数为61个,显著高于处理1和处理4,处理2和处理3诱导的芽较处理4的生长健壮。综合比较平均芽个数及丛生芽长可知,在处理3的培养基MS+6-BA 1.0 mg/L+NAA 0.1 mg/L上对茎段腋芽的增殖效果最为理想。
2.5 GA3对丛生苗继代生长的影响

表5 BA、NAA不同浓度组合对茎段腋芽的增殖影响Tab.5 Effects of 6 -BA and NAA on buds multiplication
将紫薇的再生芽在附加了不同浓度GA3的MS培养基中培养1个月后,表6方差分析结果表明不同处理对试管苗的生长量有极显著影响。处理1的苗生长量极显著地高于处理2和处理3。在不添加GA3的MS培养基上苗生长量最高,叶片绿色(图1-C)。GA3对取自丛生芽的芽苗伸长生长的促进作用不明显,苗甚至不生长,随着培养时间的延长,叶片发黄直至脱落(图1-D)。GA3对紫薇无菌苗的伸长生长没有促进作用,因此,在紫薇丛生苗的继代培养中可以不添加激素。

表6 GA3对丛生苗生长的影响Tab.6 Effects of GA3on axillary buds growth
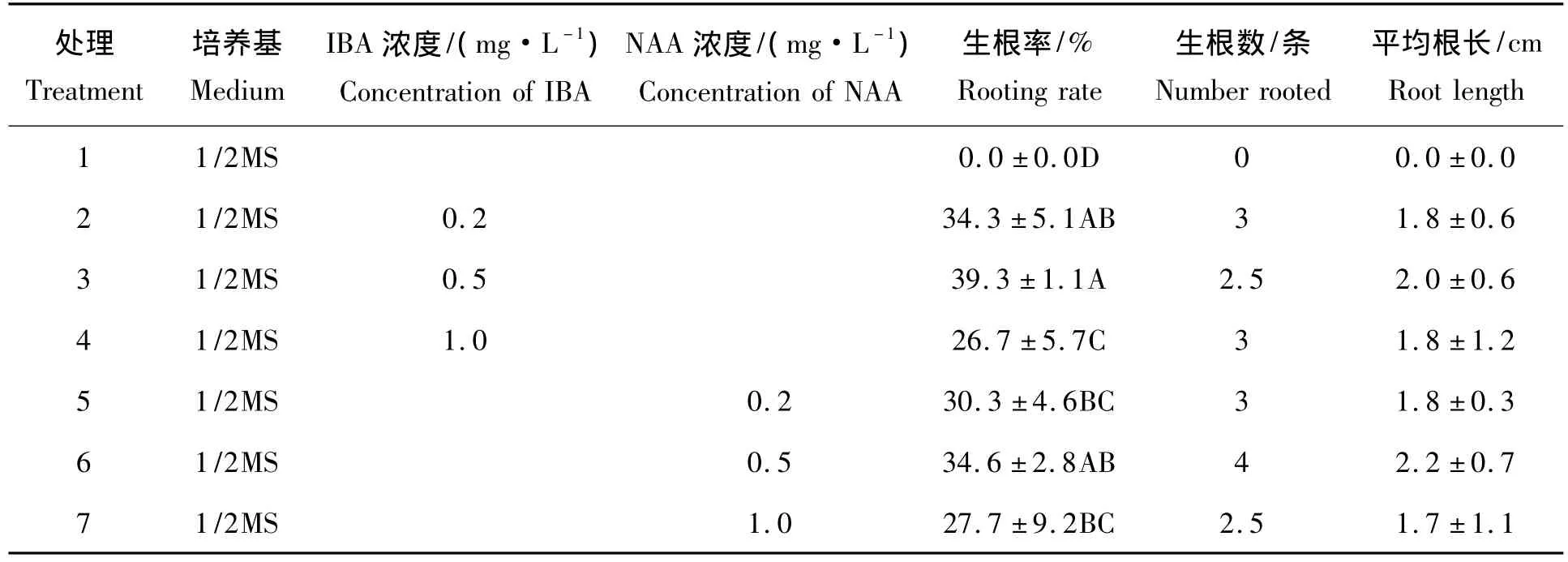
表7 生长素对试管苗生根的影响Tab.7 Effects of auxins on rooting of plantlets in vitro

图1 紫薇带芽茎段的快繁Fig.1 Rapid propagation of budded stem segmant of Lagerstroemia indica
2.6 生长素对试管苗生根的影响
表7方差分析表明,IBA对紫薇试管苗的生根率有极显著的影响,NAA对生根率无显著影响,但添加了生长素的1/2MS培养基的试管苗生根率均极显著地高于未添加生长素的1/2MS培养基。进一步的多重比较结果表明,处理3的生根率却极显著地高于处理5和处理7;同时,结合生根率、生根数和平均根长的结果,试管苗生根应在1/2MS培养基上添加浓度为0.5 mg/L的IBA。生根的健壮苗即可炼苗移栽(图1-E、图1-F)。
3 讨论
紫薇茎段直接从大田采集,不同季节生长状态不同,取材季节对芽的萌动有显著影响。本研究表明,在高温干燥的夏季截取半木质化茎段作组织培养,污染率较低,萌芽率高且生长势健康,效果明显好于春季和秋季。这与紫薇在夏季生长旺盛、枝条半木质化、表面污染物少和植株内源激素含量高都有明显关联。在本实验中,紫薇春季刚萌发的茎段幼嫩,容易产生药害,消毒处理后,极易褐化,腋芽萌芽率低。而在秋季取材的茎段已完全木质化,内生菌积累较多,污染率高,应相应延长消毒时间为宜。这在巴戟天[11],柑橘[12],香椿[13]的研究上有类似报道。
培养基中的生长素和细胞分裂素对紫薇丛生芽诱导、增殖和生根有显著作用。本研究通过系列激素配比实验,筛选出紫薇茎段诱导、增殖培养基最佳配方为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L,生根最佳配方为1/2MS+IBA0.5 mg/L。研究结果显示紫薇茎段在最佳激素配比的培养基上,萌芽率可高达97.6%,经过4次继代出现了大量丛生芽,平均不定芽苗(长度大于1 cm)达61个且生长强壮,继代次数少,见效快,能够大量运用于快繁生产。紫薇茎段快繁体系的建立,为紫薇的繁殖添加了新途径,对保存紫薇优良性状,加快紫薇工厂化生产具有重要意义。
[1]陈俊愉.中国花卉品种分类学[M].北京:中国林业出版社,2001:162-171.
[2]曹受金,刘辉华,田英翠.紫薇的组织培养与快速繁殖[J].北方园艺,2010,33(8):149-151.
[3]黄钦才.紫薇腋芽培养[J].植物生理学通讯,1984,33(3):44.
[4]杨彦伶,杨柳,张亚东.紫薇组织培养技术[J].林业科技开发,2005,18(2):50 -52..
[5]瞿宏杰,王会.不同培养基对紫薇试管苗的诱导·增殖·生根的影响[J].安徽农业科学,2008,47(21):8906-8907.
[6]李晓青,王慧瑜,张晓申,等.紫薇组培快繁技术研究[J].现代农业科技,2009,37(19):91-93.
[7]姜旭红,宋刚,张虎,等.日本紫薇的组织培养与快速繁殖[J].植物生理学通讯,2004,40(6):707.
[8]宋平.紫薇再生体系的建立及多倍体诱导研究[J].北京:北京林业大学,2009.
[9]蔡明,田苗,王敏等.紫薇离体再生体系建立的初步研究//中国观赏园艺研究进展[M].北京:中国林业出版社,2007,251-255.
[10]张秦英.紫薇离体再生体系的建立//中国观赏园艺研究进展[M].北京:中国林业出版社,2008:315-317.
[11]何宗明,李慧敏,曹光球,等.巴戟天优良材料茎段组织培养污染率控制方法[J].安徽农学通报,2009,14(13):53-54.
[12]王子成,李忠爱,邓秀新.柑橘成年态茎段外植体消毒方法研究[J].河南大学学报:自然科学版,2005,71(2):57-60.
[13]许丽琼,涂炳坤.香椿茎段组织培养和再生技术研究[J].华中农业大学学报,2007,51(5):697-700.

