载铁沸石催化H2O2降解阳离子红X-GRL染料废水
李大群,蒋进元,周岳溪,李清雪
1.河北工程大学城市建设学院,河北 邯郸 056038
2.中国环境科学研究院水污染控制技术研究中心,北京 100012
载铁沸石催化H2O2降解阳离子红X-GRL染料废水
李大群1,2,蒋进元2*,周岳溪2,李清雪1
1.河北工程大学城市建设学院,河北 邯郸 056038
2.中国环境科学研究院水污染控制技术研究中心,北京 100012
以天然沸石为载体,FeSO4·7H2O溶液为浸渍液,采用浸渍蒸干法制备载铁沸石非均相类Fenton反应催化剂,并用其催化H2O2降解阳离子红X-GRL染料废水。结果表明,浸渍液浓度为0.18 mgL、煅烧温度为300 ℃时制备的催化剂铁含量较高,催化效果和稳定性较好。当反应时间为120 min、溶液pH为3.0、催化剂投加量为20.0 gL、H2O2投加量为30.0 mmolL时,催化降解效果最佳,对染料废水TOC、色度、CODCr和TN的去除率分别为60.3%、99.4%、55.5%和49.9%;载铁沸石催化剂重复使用3次后,仍具有一定的催化效果。
染料废水;非均相类Fenton反应;载铁沸石;阳离子红X-GRL
我国是染料生产与使用大国,每年有大量染料废水产生,如不经处理直接排入水体将会给环境带来严重污染。废水中的某些偶氮类染料可在还原条件下生成致癌物芳香胺,对人类健康造成潜在的危害[1]。染料废水具有成分复杂、污染物浓度高、色度高、无机盐含量较高、可生化性较差、脱色困难等特点,采用生物法等传统方法对其处理,很难得到较理想的效果[2]。所以,染料废水处理仍是水处理领域的重要研究内容,研究开发一种高效、低成本、可靠的染料废水处理方法仍十分必要。
目前常用的染料废水处理技术有絮凝法、吸附法、微电解法、膜法、高级氧化法[3-4]。其中,高级氧化法中的Fenton法处理效果较好[5-7],但铁泥生成量较大,如不进行后续处理易对环境造成二次污染[8],实际应用受到很大限制。近年来大量学者致力于染料废水的非均相类Fenton反应体系的研究与开发[9-12]。笔者以天然沸石为载体,通过浸渍蒸干法制备载铁沸石非均相类Fenton催化剂,研究其催化H2O2降解模拟阳离子红X-GRL染料废水的效果及特性,并对反应条件进行优化。
1 材料和方法
1.1 仪器和试剂
仪器:UV1700紫外可见分光光度计(日本岛津公司);TOC-VCPH型总有机碳分析仪(日本岛津公司);HANGING FA 2004分析天平(上海天平仪器厂);PHS-3E型pH计(上海雷磁仪器厂);MY3000-6E混凝试验搅拌仪(武汉市梅宇仪器有限公司);CODCr快速测定仪(承德华通环保仪器公司);原子吸收分光光度计(日本岛津公司);JSM7001F型扫描电子显微镜(日本电子株式会社);XRF-1800型X射线荧光光谱仪(日本岛津公司)。
试剂:H2O2(浓度为30%)、FeSO4·7H2O、NaOH、H2SO4等均为分析纯;阳离子红X-GRL染料(天津瑞基化工有限公司生产,浓度为95%);天然沸石,粒径40~65目,产地为河南巩义。
准确称取0.657 9 g阳离子红X-GRL粉末,溶于5 L超纯水中配制模拟阳离子红X-GRL染料废水,该模拟废水染料浓度为125 mgL,CODCr为167.2 mgL,TOC浓度为59.9 mgL,TN浓度为12.2 mgL,稀释10倍后530 nm处吸光度为1.583。
1.2 试验与分析方法
催化剂制备:将30.0 g粒径为40~65目的天然沸石浸渍在200 mL FeSO4·7H2O溶液中,90 ℃水浴加热至蒸干,105 ℃烘干4 h后,置于马弗炉300 ℃煅烧2 h,自然冷却,用去离子水洗净后105 ℃干燥,制成非均相类Fenton反应催化剂[13-15]。用其催化H2O2降解阳离子红X-GRL染料废水。
TOC和TN浓度采用TOC-VCPH型总有机碳分析仪测定,pH采用玻璃电极法测定,Fe2+浓度采用原子吸收分光光度计测定[16],CODCr采用快速消解法测定,染料特征吸光度采用UV1700紫外-可见分光光度计测定。紫外-可见吸收光谱采用UV1700紫外-可见分光光度计测定[17],扫描波长为190~700 nm。
天然沸石和载铁沸石催化剂的表面特征用扫描电子显微镜进行观察,组分及含量用X射线荧光光谱仪测定。
色度去除率(E)的计算公式:
E=100×(A0-At)A0
式中,A0为染料原水最大吸收波长处吸光度;At为处理后染料废水稀释10倍后最大吸收波长处吸光度。
2 结果与分析
2.1 催化剂制备优化与表征
2.1.1 浸渍液浓度优化
按1.2节的制备方法,在浸渍液浓度分别为0.18、0.36和0.89 molL,煅烧温度300 ℃,煅烧时间2 h条件下,制备3种非均相类Fenton催化剂。在水样体积为100 mL,催化剂投加量为15.0 gL,水样pH为2.5,H2O2投加量为30.0 mmolL,混凝试验搅拌仪(400 rmin)搅拌反应120 min条件下催化降解染料废水,以TOC、色度、TN、CODCr去除率以及Fe析出量为评价指标,考察浸渍液浓度对催化剂催化效果的影响,结果如图1所示。

图1 浸渍液浓度对催化剂催化效果的影响Fig.1 Effect of impregnated liquid content on catalyst catalytic result
由图1可知,催化剂催化H2O2对阳离子红X-GRL染料废水的脱色能力基本不受浸渍液浓度影响,色度去除率都在98.0%以上;当浸渍液浓度由0.18 molL提高到0.89 molL时,染料废水TOC去除率由55.9%提高到62.1%;CODCr去除率由43.5%提高到50.1%,虽有一定增长但增幅较小;TN去除率反而降低。因为一定条件下浸渍液浓度越高,沸石铁负载量越多,催化效果就越好。但沸石载体铁负载量有限,当浸渍液浓度达到一定值后,再提高其浓度沸石铁负载量增加非常有限。同时,铁负载量的增加使沸石载体内部空间减小,吸附能力下降[18],TN去除效果降低。另外,浸渍液浓度较高时制备的催化剂在催化反应过程中Fe析出量较大,稳定性相对较差。综上,催化剂制备过程中最优的浸渍液浓度为0.18 molL。
2.1.2 煅烧温度优化
浸渍液Fe2+浓度为0.18 molL,煅烧温度分别为200、300、400 ℃下制备3种非均相类Fenton催化剂。在水样体积为100 mL,催化剂投加量为15.0 gL,水样pH为2.5,H2O2投加量为30.0 mmolL,混凝试验搅拌仪(400 rmin)搅拌反应120 min条件下催化降解染料废水,以TOC、色度、TN、CODCr去除率以及Fe析出量为评价指标,考察煅烧温度对催化剂催化效果的影响,结果如图2所示。
由图2可知,煅烧温度从200 ℃提高到300 ℃时,催化剂催化效果受此影响较小,溶液色度、TOC、CODCr和TN去除率分别只提高了3.2%、1.8%、6.4%和5.9%;继续提高煅烧温度到400 ℃时,催化剂催化效果迅速减弱,溶液色度、TOC、CODCr和TN去除率较300 ℃时,分别降低了20.9%、25.1%、21.4%和4.5%。因为煅烧温度会影响铁在催化剂中的存在形式[15],当煅烧温度较低时,部分铁可能会以二价氧化物的形式存在于沸石载体中;当煅烧温度较高时,二价铁氧化物浓度减少,而二价铁能更好地催化H2O2降解有机污染物[19]。同时煅烧温度较高时,催化剂稳定性增强,反应过程中Fe析出量减少。综上,催化剂制备过程中最佳的煅烧温度为300 ℃。

图2 煅烧温度对催化剂的影响Fig.2 Effect of calcination temperature on catalyst catalytic result
2.1.3 催化剂表征
用X射线荧光光谱仪对天然沸石和载铁沸石催化剂的组分及其所占比例进行测定,结果见表1。由表1可知,天然沸石和载铁沸石催化剂某些组分所占比例差异较大,特别是铁和铝。催化剂中铁元素所占比例由2.4%提高到10.6%,铝元素比例由13.3%下降至8.2%。可见,经浸渍蒸干和高温煅烧后,沸石结构内部孔隙中会负载一定的铁元素,同时沸石骨架结构中的部分铝也可能被铁所取代,造成催化剂中铝元素比例下降,铁元素比例上升。而铁的增加能使催化剂催化效果显著提高。
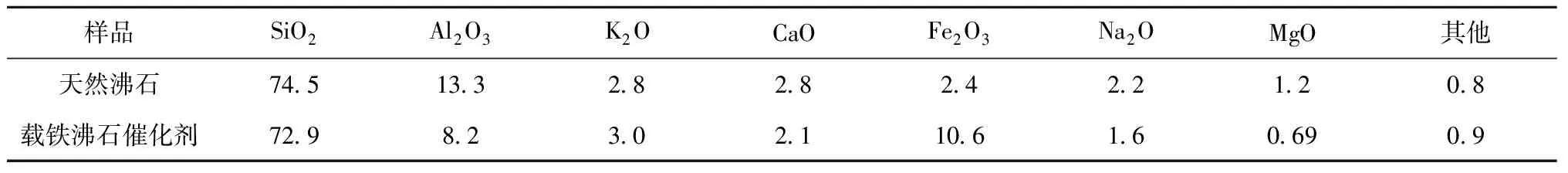
表1 样品XRF测定结果
用扫描电子显微镜对天然沸石和载铁沸石催化剂的表面特征进行观察,结果如图3所示。由图3可知,与天然沸石相比,载铁沸石表面比较光滑,没有明显的铁沉淀物。而样品XRF测定结果显示,载铁沸石催化剂中铁元素比例较天然沸石有很大提高,表明铁主要存在于催化剂内部孔隙中,这有利于载铁沸石催化剂的稳定性[15],催化反应过程中铁不易析出。

图3 SEM电镜结果Fig.3 Result of SEM natural zeolite Fe-containing zeolite catalyst
2.2 H2O2、催化剂分别及其共用降解染料废水
室温下,水样体积为100 mL,水样pH为2.5,催化剂投加量为15.0 gL,H2O2投加量为30.0 mmolL,混凝试验搅拌仪(400 rmin)搅拌反应120 min,考察H2O2、催化剂分别及其共用对模拟阳离子红X-GRL染料废水的处理效果,结果如图4所示。

图4 H2O2,催化剂分别及共用对阳离子红X-GRL染料废水的降解效果Fig.4 The degradation effect of Cationic Red X-GRL wastewater respectively by H2O2,catalyst,H2O2 and catalyst
由图4可知,在H2O2单独作用下,阳离子红X-GRL染料废水TOC、TN、CODCr和色度去除率分别只有2.4%、11.5%、2.3%和0.32%,氧化效果较差;催化剂单独作用下因为沸石载体的吸附作用而具有一定的去除效果,染料废水TOC、TN、CODCr和色度去除率分别为42.2%、48.4%、35.9%和59.4%。H2O2与催化剂共同作用下染料废水溶液TOC、TN、CODCr和色度去除率分别为56.0%、57.3%、50.3%和99.1%,各项指标特别是脱色效果明显好于H2O2和催化剂单独作用之和。因为酸性条件下催化剂中的铁能够催化H2O2分解产生氧化能力较强的·OH[20-21],其能够氧化阳离子红X-GRL染料使其脱色,或者进一步将其氧化成CO2和H2O[22]。同时,由于催化剂对阳离子红X-GRL染料的吸附作用,加快了该类Fenton氧化反应速率。
2.3 载铁沸石催化H2O2降解染料废水的影响因素
2.3.1 反应时间
室温下取100 mL水样,调节pH为2.5,投加15.0 gL催化剂,30.0 mmolL H2O2,混凝试验搅拌仪(400 rmin)搅拌反应,分别在反应时间为10、30、60、90、120和180 min时取样,考察反应时间对催化降解效果的影响,结果如图5所示。

图5 反应时间对催化效果的影响Fig.5 Effect of reaction time on catalytic result
由图5可知,催化剂催化效果受反应时间影响较大,反应时间小于120 min时,随反应时间延长,阳离子红X-GRL染料废水TOC、色度、CODCr和TN去除率都有明显增大;当反应时间为120 min时,色度、TOC、CODCr和TN去除率分别能达到98.5%、53.5%、44.6%和47.3%;继续延长反应时间,各项指标去除率增幅较小,反应180 min时色度、TOC、CODCr和TN去除率分别只有99.4%、57.4%、50.3%和52.2%。可见,最佳的反应时间应为120 min。
2.3.2 溶液pH

图6 pH对催化效果的影响Fig.6 Effect of pH on catalytic result
由图6可见,当pH为3.0时,催化剂催化效果最好,阳离子红X-GRL染料废水TOC、色度和CODCr去除率都达到最大,分别为58.1%、99.3%和47.2%;而降低或增大溶液pH都会使催化剂催化效果降低,因为降解过程中主要发生以下反应[23-24]:
Fe3++H2O2→Fe(HO2)2++ H+
(1)
FeOH2++H2O2→Fe(OH)(HO2)2++H+
(2)
Fe(HO2)2+→Fe2++·HO2
(3)
Fe2++H2O2→Fe3++OH·+·OH
(4)
H2O2+·OH→H2O+·HO2
(5)
Fe2++·HO2→Fe3++HO2-
(6)
Fe2++·OH→Fe3++OH·
(7)
pH较低时H2O2比较稳定,抑制了中间产物Fe(HO2)2+的产生〔式(1)~式(3)〕,从而降低了Fe2+和·OH的生成量,使催化反应速率降低。pH较高时,催化剂中的铁主要以Fe(OH)3或Fe2O3·nH2O的形式存在而失去催化能力[25],同时会造成H2O2的无效分解,使溶液中H2O2的浓度降低[26],·OH的生成量降低。而当pH为5.0时染料废水TN去除率最大,因为该pH下沸石对溶液中NH4+-N具有较好的吸附效果[27]。
2.3.3 催化剂投加量
室温下取100 mL水样,调节pH为3.0,投加30.0 mmolL H2O2,催化剂投加量分别控制在1.0、5.0、10.0、15.0和20.0 gL,混凝试验搅拌仪(400 rmin)搅拌反应120 min后取样分析催化剂投加量对催化降解效果的影响,结果如图7所示。
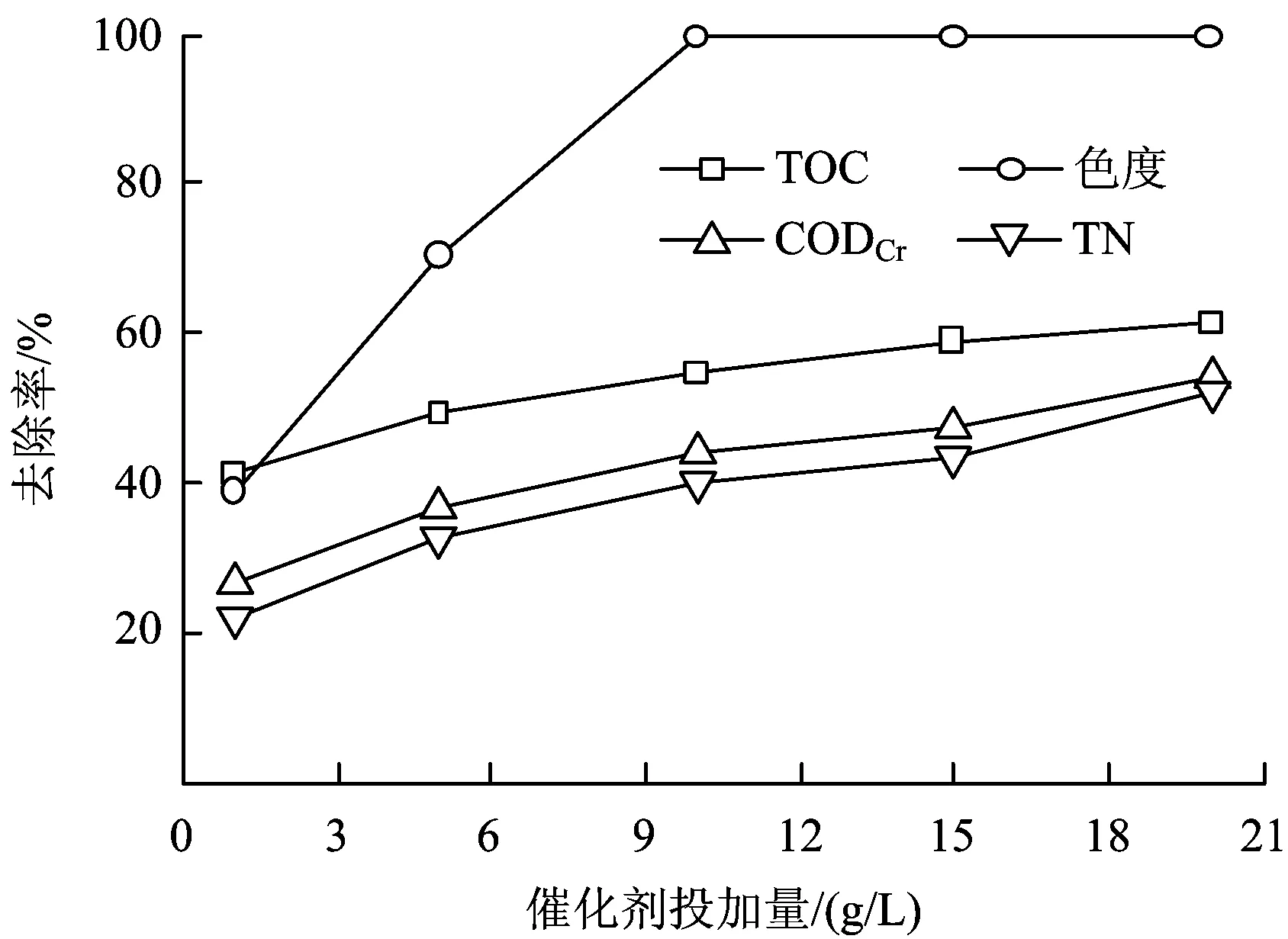
图7 催化剂投加量对催化效果的影响Fig.7 Effect of catalyst content on catalytic result
由图7可知,随着催化剂投加量的增加,阳离子红X-GRL染料废水溶液TOC、CODCr和TN去除率都逐渐增大,当催化剂投加量为20.0 gL时,TOC、CODCr和TN去除率都达到最大,分别为61.2%、54.3%和50.5%;而当催化剂投加量小于10.0 gL时,色度去除率随投加量的增大而逐渐增大。催化剂投加量为10.0 gL时,色度去除率达99.3%,当催化剂投加量大于10.0 gL时,再增加投加量,色度去除率基本保持不变。因为催化剂投加量的增加使与H2O2接触的Fe浓度增大,·OH的生成速率加快[28],相同时间内被氧化的有机物增多,故染料废水溶液TOC、色度和CODCr去除率增大。同时,催化剂投加量增大时溶液中被吸附的NH4+-N增多,TN去除率增大。综合考虑,最佳的催化剂投加量为20.0 gL。
2.3.4 H2O2投加量
室温下取100 mL水样,调节pH为3.0,投加20.0 gL催化剂,H2O2投加量分别为10.0、30.0、50.0、70.0和90.0 mmolL,混凝试验搅拌仪(400 rmin)搅拌反应120 min后取样分析H2O2投加量对降解效果的影响,结果如图8所示。

图8 H2O2投加量对催化效果的影响Fig.8 Effect of H2O2 content on catalytic result
由图8可知,试验范围内阳离子红X-GRL染料废水色度去除效果受H2O2投加量影响不大,去除率都在99.3%左右;当H2O2投加量少于30.0 mmolL时,随H2O2投加量的增加阳离子红X-GRL染料废水TOC、CODCr和TN去除率都呈明显上升趋势;当H2O2投加量大于30.0 mmolL时,增加H2O2投加量TOC、CODCr和TN去除率变化不大。当H2O2投加量为30.0 mmolL,染料废水TOC、色度、CODCr和TN去除率分别60.3%、99.4%、55.5%和49.9%。因为当H2O2浓度较低时,随H2O2浓度增大,·OH生成量相应增加[29],氧化速率加快,相同反应时间内染料废水TOC、CODCr、TN去除率增大。当H2O2浓度大于30.0 mmolL时,整个反应过程受式(2)、式(3)影响,增大H2O2浓度,·OH生成量变化不大,催化效果变化不明显。
2.4 染料废水溶液紫外-可见光光谱特性变化
室温下取100 mL水样,调节pH为3.0,催化剂投加量为20.0 gL,H2O2浓度为30.0 mmolL,混凝试验搅拌仪(400 rmin)搅拌反应120 min后取样,对其和原水进行紫外扫描,结果如图9所示。

图9 反应前后阳离子红X-GRL染料废水紫外吸收光谱Fig.9 The UV absorption spectra of Cationic Red X-GRL wastewater sample before and after theo reaction process
从图9可以看出,模拟阳离子红X-GRL染料废水在530和287 nm处有2个明显的特征吸收峰,经类Fenton反应处理后原有2个特征吸收峰都消失,而在210~270 nm吸光度增大。表明阳离子红X-GRL染料结构中的发色基团和助色集团在·OH的氧化作用下断裂或者脱落[30],生成其他新物质而脱色。
2.5 催化剂的稳定性
室温下取100 mL水样,调节水样pH为3.0,催化剂投加量为20.0 gL,H2O2投加量为30.0 mmolL,搅拌反应120 min,考察催化剂重复使用次数对催化剂催化效果的影响,结果如图10所示。由图10可知,随着催化剂重复使用次数增多,溶液TOC、CODCr、TN和色度的去除率都有明显降低。原因可能是反应过程中催化剂中部分Fe析出,造成催化剂中铁的比例逐渐减少,反应速率降低,而3次使用过程中Fe析出量分别为17.1、10.5和4.1 mgL。虽然催化剂催化效果降低,但重复使用3次后,溶液TOC、CODCr、TN和色度的去除率分别达到39.5%、29.6%、10.0%和71.4%,仍具有一定的催化效果。

图10 催化剂重复使用次数对催化效果的影响Fig.10 Effect of repeated use number of catalyst on catalytic result
3 结论
(1)采用浸渍蒸干法制备载铁沸石类Fenton反应催化剂,最佳的浸渍液FeSO4浓度为0.18 molL,最佳煅烧温度为300 ℃,该条件下制备的催化剂催化效果较好,铁含量和稳定性较高。
(2)在载铁沸石催化H2O2降解阳离子红X-GRL染料废水过程中,催化效果受反应时间、溶液pH、催化剂和H2O2投加量影响较大,最佳催化氧化反应参数:反应时间120 min,溶液pH为3.0,催化剂投加量为20.0 mgL,H2O2投加量为30.0 mmolL。经催化氧化反应后,阳离子红X-GRL染料废水特征吸收峰消失,溶液色度被去除,CODCr、TOC和TN浓度都有很大程度降低。
(3)在重复使用过程中,催化剂催化效果有一定程度降低,但重复使用3次后,仍具有一定的催化效果,染料废水脱色率可达71.4%,TOC、CODCr和TN去除率可达39.5%、29.6%和10.0%。
[1]许德珍,贺一顺.偶氮染料中微量芳香胺类的分析方法现状[J].印染,1996,22(3):26-31.
[2]CHEN G,HUANG M H,CHEN L,et al.A batch decolorization and kinetic study of Reactive Black 5 by a bacterialstrainEnterobactersp. GY-1[J].International Biodeterioration and Biodegradation,2011,65:790-796.
[3]丁绍兰,李郑坤,王睿.染料废水处理技术综述[J].水资源保护,2010,26(3):73-78.
[4]薛方亮,张雁秋.染料废水处理技术最新研究进展[J].水科学与工程技术,2007(2):26-29.
[5]陈娴,高永,徐旭,等.FeY催化剂光助Fenton法降解亚甲基蓝染料废水[J].环境科学与技术,2012,35(2):139-142.
[6]顾平,刘奎,杨造燕.Fenton试剂处理活性黑KBR染料废水研究[J].中国给水排水,1997,13(6):16-17.
[7]李绍峰,黄君礼,陶虎春.Fenton试剂降解水中活性染料的研究[J].哈尔滨建筑大学学报,2001,34(5):76-80.
[8]刘琰,孙德智.高级氧化技术处理染料废水的研究进展[J].工业水处理,2006,26(6):1-5.
[9]郑怀礼,谢礼国,胡鹏,等.非均相类Fenton反应催化氧化脱色降解直接桃红12B[J].光谱学与光谱分析,2010,30(6):1647-1651.
[10]TIAN S H,TU Y T,CHEN D S,et al.Degradation of acid Orange Ⅱ at neutral pH using Fe2(MoO4)3as a heterogeneous Fenton-like catalyst[J].Chemical Engineering Journal,2011,169:31-37.
[11]HASSAN H,HAMEED B H.Fe clay as effective heterogeneous Fenton catalyst for the decolorization of Reactive Blue 4[J].Chemical Engineering Journal,2011,171(3):912-918.
[12]XUE X F,HANNA K,DENG N S.Fenton-like oxidation of Rhodamine B in the presence of two types of iron(Ⅱ,Ⅲ) oxide[J].Journal of Hazardous Materials,2009,166(1):407-414.
[13]姜远光,刘玉茹,王少坡.Fe3+和Mn2+双金属负载型非均相类Fenton催化剂的制备及性能[J].天津城市建设学院学报,2011,17(2):114-118.
[14]何炽,赵景联,夏敏强,等.分子筛固载Fe2+-Fenton法降解水中甲基橙的研究[J].环境科学与技术,2006,29(12):1-3.
[15]CHEN A Y,MA X D,SUN H W.Decolorization of KN-R catalyzed by Fe-containing Y and ZSM-5 zeolites[J].Journal of Hazardous Materials,2008,156(1):568-575.
[16]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:279-281.
[17]DAI S H,LI P,YANG X Z,et al.Fluorescence spectra of lycopence in different solvents[J].Acta Optica Sinica,2006,26(1):141-146.
[18]邹卫华,白红娟,李苛,等.天然沸石对阳离子染料中性红的吸附及机理研究[J].郑州大学学报,2011,43(4):71-76.
[19]杨玲,赵勇胜,马百文,等.Fenton和类Fenton氧化处理地下水中BTEX及其动力学[J].环境工程学报,2011,5(5):992-996.
[20]KANG S F,CHANG H M.Coagulation of textile secondary effluents with Fenton’s reagent[J].Water Science Technology,1997,36(12):215-222.
[21]高迎新,张昱,杨敏,等.Fe3+或Fe2+均相催化H2O2生成羟基自由基的规律[J].环境科学,2006,27(2):305-309.
[22]孙振英.Photo-Fenton反应降解染料及非染料污染物机理研究[D].哈尔滨:哈尔滨工程大学,2006:22-32.
[23]高真.Fenton及类Fenton技术去除水中难降解有机物的机理研究[D].武汉:武汉科技大学,2011:3-5.
[24]OLMOS R G,HOLZER F,KOPINKE F D,et al.Indications of the reactive species in a heterogeneous Fenton-like reaction using Fe-containing zeolites[J].Applied Catalysis A:General,2011,398(1):44-53.
[25]BAUTISTA P,MOHEDANNO A F,GILARRANZ M A.Application of Fenton oxidation to cosumetic wastewaters treatment[J].Journal of Hazardous Materials,2007,143(12):128-134.
[26]LIU R,CHIU H M,SHIAU C S,et al.Degradation and sludge production of texitile dyes by Fenton and photo-Fenton processes[J].Dyes and Pigments,2007,73(1):1-6.
[27]刘玉亮.斜发沸石对废水中铵离子交换特性的试验研究[D].重庆:重庆大学,2004:37-38.
[28]NTAMPEGLIOTIS K,RIGA A,KARAYANNIS V,et al.Decolorization kinetics of Procion H-exl dyes from textile dyeing using Fenton-like reactions[J].Journal of Hazardous Materials,2006,136(1):75-84.
[29]MUTHUVEL I,SWAMINATHAN M.Photoassisted Fenton mineralization of Acid Violet 7 by hterogeneous Fe(Ⅲ)-Al2O3catalyst[J].Catalysis Communication,2007,8(7):981-986.
[30]吴坚扎西,张科杰.Fenton试剂处理酸性玫瑰红B的研究[J].环境保护科学,2005,31(6):27-30. ▷
DegradationofCationicRedX-GRLDyeWastewaterwithH2O2CatalyzedbyFe-containingZeolite
LI Da-qun1,2, JIANG Jin-yuan2, ZHOU Yue-xi2, LI Qing-xue1
1.College of Urban Construction, Hebei University of Engineering, Handan 056038, China
2.Research Center of Water Pollution Control Technologies, Chinese Research Academy of Environmental Sciences, Beijing 100012, China
The Fe-containing zeolite heterogeneous Fenton-like reaction catalysts were prepared by evaporation impregnation liquid methods, with natural zeolite as carrier and ferrous sulphate heptahydrate as impregnation liquid. The dye wastewater, Cationic Red X-GRL, was degraded by hydrogen peroxide catalyzed by these catalysts. The catalysts prepared at the conditions of impregnated liquid concentration 0.18 mgL, calcined temperature 300 ℃, had a higher iron content, better catalytic effect and stability. Catalysts had the best catalytic effect, when reaction time was 120 min, solution pH was 3.0, catalysts dosage was 20.0 gL, and H2O2concentration was 30.0 mmolL. The TOC, chromaticity, CODCr, and TN removal rates of the dye wastewater, Cationic Red X-GRL, were 60.3%, 99.4%, 55.5% and 49.9%, respectively. After repeated used three times, the catalysts still had a certain catalytic effect.
dye wastewater; heterogeneous Fenton-like reaction; Fe-containing zeolite; Cationic Red X-GRL
1674-991X(2013)05-0391-07
2013-01-16
收稿日期:国家水体污染控制与治理科技重大专项(2012ZX07201-005)
李大群(1985—),男,硕士研究生,主要从事水污染处理技术研究,lidaqunyang@163.com
*责任作者:蒋进元(1974—),男,副研究员,博士,主要从事水污染控制技术研究工作,jiangjy@craes.org.cn
X703.1
A
10.3969j.issn.1674-991X.2013.05.061

