C臂CT在15例肺部小病灶射频消融术中的应用
李晓群,张 勇,黄大钡,张 健,张高尚,文自祥,李记华,刘辉来
射频消融(radiofrequency ablation,RFA)是近年发展起来的一项微创肿瘤治疗技术,在肺脏肿瘤局部治疗中占有越来越重要的地位,其对失去手术机会、不适合手术的高风险患者、拒绝手术的肺癌患者及肺转移瘤患者在一定程度上能起到代替手术的作用。目前临床上经皮RFA常用的影像引导方式有CT、DSA透视、MRI等,但是上述引导方式各有不足,具有着一定的局限性。近年发展起来的C臂CT技术,相对于其他影像学引导方式,有明显的优势。本研究拟通过回顾性分析C臂CT在肺部小病灶RFA中的应用情况,研究如何利用C臂CT简化肺小病灶RFA操作步骤,提高电极针布针准确度,预防并及时发现、处理并发症,减少医患所接受的辐射量。
1 材料与方法
1.1 材料
1.1.1 临床资料 2007年11月—2011年1月在我室行C臂CT引导下肺肿瘤RFA治疗且病灶最大径 ≤ 3.0 cm的15例患者,其中男7例,女8例。患者年龄28~74岁,平均49岁,中位年龄53岁。共18处病灶,最大径范围为0.4~2.9 cm,平均1.4 cm,共行RFA术16例次,1例患者重复RFA治疗。
1.1.2 仪器设备 采用GE INNOVA 3100 IQ数字平板血管机、PHILPS 1250-FD20平板血管造影机(均具有C臂CT功能)为影像引导设备。RFA设备采用RITA1500型射频治疗仪,具有自动温度控制和阻抗监测功能,并选择StarBurst XL型电极针,单次消融即可产生3~5 cm的消融灶。
1.2 方法
1.2.1 手术过程 ①术前评估患者一般情况,注意有无心肺功能不全、感染、出血史、使用抗凝血药物及支气
管扩张剂等。术前禁食,手术开始时肌内注射哌替啶50 mg。②根据近期的影像学检查,如CT或MRI,评估肿瘤大小、位置、邻近结构等。根据肿瘤在肺脏的位置选择合适的体位,使病灶距皮肤进针点垂直距离最短,注意避开肋骨、大血管、肺大泡、叶间裂、大气管、肩胛骨等结构。③患者双手上举,在患者体表拟穿刺区放置自制的网格状金属标记物协助定位。对患者进行呼吸训练,使每次呼吸运动幅度尽量一致。然后进行C臂CT三维旋转扫描,旋转速度为 20°/s或 40°/s,共旋转 200°,采集的图像数据被传送至AW工作站进行二维、三维重建,重建的多平面类CT图像能清晰地显示肿块的位置、形状和范围,使用工作站的测量工具,在靶目标病灶与体表定位标记处画出进针路径,测量进针深度,根据病变情况结合金属网格样穿刺标记物在患者体表选择恰当的皮肤穿刺点。用2%利多卡因在穿刺点自皮肤至胸膜壁层局部浸润麻醉,局麻完毕后留注射器针头于胸壁,初步判断针头与病灶的位置关系。④通过体表定位点进针,穿过肌层后嘱患者屏气,迅速进消融针至测量深度,固定消融针,进行三维旋转扫描并重建三维图像,多个方位确定针尖在肿瘤中的合适位置。⑤消融针针尖位于肿瘤中央后再打开锚状电极针,再次行三维扫描并重建三维图像,观察电极针散开后的情况,当电极针位置合适时,即可行RFA。⑥射频发生器功率为150 W,初始消融温度为90℃,消融进行后逐渐升至103℃,消融时间视病灶大小在肺脏为15~25 min。⑦术后再次进行三维扫描并重建三维图像,观察病灶情况,评估消融情况,注意有无出血、气胸等并发症。1.2.2 辐射剂量评估 记录每例患者每次手术的DAP(cGy·cm2)值,根据 Monte-Carlo 转换系数模拟[1],计算有效剂量 ED(mSv),计算公式 ED=转换系数(k) × DAP,k=0.14 mSv/Gycm2。
1.2.3 肺肿瘤疗效评价 本研究采用一种修正的实体瘤疗效评价标准[2],疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),定义见表1。CT复查时间一般为术后1、3和6个月。
1.3 统计学方法

表1 修正的实体瘤疗效评价标准
统计术后累积生存率、缓解率及并发症发生率,手术辐射累积剂量、有效剂量,采用SPSS16.0软件进行分析。
2 结果
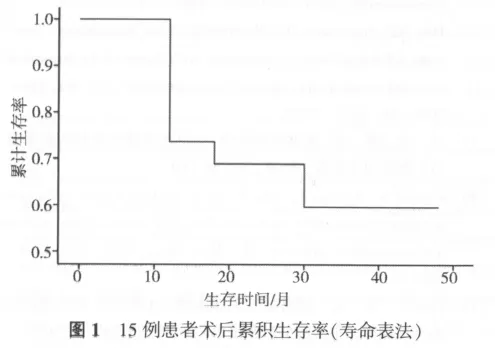
本研究16例次RFA手术中,18处病灶穿刺均获成功。有5例出现并发症,包括气胸2例(均无需穿刺抽气或胸腔闭式引流),咯血3例。全部病例随访时间为1~39个月,至本课题随访结束时15例患者均得以随访,其中4例死亡,11例仍存活。平均随访时间12.3个月。15例患者实际半年生存率为100%,实际1年生存率为73.3%。通过寿命表法得出15例患者行RFA治疗后的0.5年累积生存率为100.0%,1年累积生存率为69.0%,2年累积生存率为 60.0% (图 1)。
有影像随访记录的15处肿瘤中,术后第1次复查 (1~3个月)显示肿瘤缓解率 (CR+PR)为53.3%(8/15)。
16次RFA手术中平均累积剂量为 (81.33±59.51)mGy,平均有效剂量为(2.41 ± 1.85)mSv。
3 讨论
C臂CT是新的成像技术[3],在肺部小病灶RFA的常见影像引导方式中,C臂CT具有很多优势:DSA透视操作简便,可通过调整患者体位或球管投射角度获得最佳穿刺路径,可实时观察穿刺针在肺内的深度及方向[4],从而达到理想的穿刺效果,并且术者操作空间较大,操作时间短。该方法的不足之处是不能预设穿刺轨道和深度,穿刺精确度一般。对于小于10 mm及邻近血管或纵隔的病灶,DSA透视难以分辨[5],且对轻微并发症不能及时发现。
C臂CT同时具有DSA透视和CT的优点,其在C臂旋转时进行二维X线投射,由平板探测器接受后传送至C臂成像系统来成产生类CT(CT-like)图像,可同时重建出横断面、矢状面、冠状面的断层图像,还可使用最大密度投影 (MIP)、容积再现(VR)、表面遮盖显示(SSD)、仿真内镜(VA)等各种后处理技术对资料进行再次加工,从而获得有立体旋转图像、类CT图像及三维血管重建图像,可从三维任意角度立体观察和分析病灶的大小、形态、结构、与邻近组织之间的关系,有利于判断病变解剖结构,从而帮助临床诊断[6-8]。由于肺内结节或肿块与周围肺组织的密度相差大,对比度好,因此能完全满足对肺肿瘤小病灶的穿刺需要。利用C臂CT可术中多方位观察电极针的位置,确保消融范围超出肿瘤边缘0.5~1 cm;对于邻近重要器官和结构的病灶,C臂CT可准确分辨电极针与周围结构关系,从而避免对周围重要结构造成热损伤;术后还可及时复查病灶消融情况,观察有无气胸等并发症。本组16例次RFA手术中,18处病灶穿刺成功率为100%,效果理想。黄大钡等[12]在C臂CT引导下对13例患者共15处病灶行经皮胸部肿物RFA,14处病灶为1次穿刺成功,电极针在15处病灶中位置分布满意,满足手术需要。
但需要指出的是,现阶段的C臂CT密度分辨率上还不如CT,达不到多层螺旋CT约3 Hu的密度分辨率[10],有时难以分辨肿块内部不同成分[9]。 同时C臂CT重建图像横断位可能出现条纹状伪影,尤其是带金属穿刺针三维旋转扫描时。所以当需要分辨病灶内部成分或辨别病灶与纵隔结构时,需要慎重选择影像引导方式。
目前,关于C臂CT辐射剂量的测量是一个难点[3],其测量十分复杂。与传统的多层螺旋CT相比,C臂CT缺乏一种被普遍接受的一般剂量测量标准。当前文献中,缺乏同等图像质量下的直接对比的文献报道,但有一些学者已经做了初步研究:从相同部位单次扫描来看,C臂CT辐射剂量应该是低于多层螺旋CT的。Gupta等[13]研究显示,C臂CT扫描时靶器官、腕部、内耳、颞骨岩部所测射线剂量较CT低。Daly等[14]使用颅脑模型测量C臂CT的辐射剂量,研究发现,为获得理想的骨骼和软组织结构图像,其辐射剂量分别约为3 mGy(0.10 mSv)、10 mGy(0.35 mSv),低于普通颅脑 CT的辐射剂量(2 mSv)。 白玫等[15]也显示,行头部扫描时,C臂CT有效剂量为1.10 mSv,而多排螺旋CT有效剂量为2.07 mSv,两种扫描所致器官剂量比较有统计学差异。在胸部成像时C臂CT辐射剂量也低于多层螺旋 CT[14-15]。 Hwang 等[5]的研究中,27 例 C臂CT引导下肺活检术平均有效剂量为4.6 mSv。本研究中,手术平均累积剂量为(81.33±59.51)mGy,平均有效剂量为(2.41±1.85)mSv。
减少医患所受辐射剂量是当前一大趋势,所以术者应该要慎重考虑C臂CT的使用及扫描次数。C臂CT成像容积是决定散射量的最大单一因素,由于C臂CT没有多层螺旋CT的准直器,因此要慎重选择成像范围以减少辐射剂量,并设法通过减少散射辐射而改善图像对比度。
总之,我们认为C臂CT在肺部小病灶RFA中能给术者带来丰富的信息,简化了操作流程,一定程度上减少了术者和患者接触的辐射剂量,是值得推广的一项新技术。虽然C臂CT功能还存在一些不足,但是随着技术的进步和经验的积累,相信会成为更加便捷的辅助工具。
[1]陈胜利,黄齐好,朱栋梁,等.冠心病介入诊疗中患者的X射线辐射评估[J].中国动脉硬化杂志,2004,12: 441-444.
[2]Fernando HC,De Hoyos A,Landreneau RJ,et al.Radiofrequency ablation for the treatment of non-small cell lung Cancer in marginal surgical candidates [J].J Thorac Cardiovasc Surg,2005,129:639-644.
[3]Orth RC,Wallace MJ,Kuo MD,et al.C-arm cone-beam CT:generalprinciplesand technicalconsiderationsforuse in interventional radiology [J].J Vasc Interv Radiol,2008,19:814-820.
[4]黄远东,何家富.DSA定位下经皮肺活检诊断肺周围性病变的价值[J].临床肺科杂志,2008,13: 4.
[5]Hwang HS,Chung MJ,Lee JW,et al.C-arm cone-beam CT-guided percutaneous transthoracic lung biopsy:usefulness in Roentgenol,2010,195: W400-W407.
[6]Froelich JJ,Ishaque N,Regn J,et al.Guidance of percutaneous pulmonary biopsies with real-time CT fluoroscopy [J].Eur J Radiol,2002,42: 74-79.
[7]Jin KN,Park CM,Goo JM,et al.Initial experience of percutaneous transthoracic needle biopsy of lung nodules using C-arm cone-beam CT systems[J].Eur Radiol,2010,20: 2108-2115.
[8]Reiser MF,Becker CR,Nikolaouk,et al.Multislice CT[M].Berlin Heidelberg: Springer,2008: 33-51.
[9]戚春厚,卢 川,刘作勤.C臂CT在介入治疗中的临床应用[J].国际医学放射学杂志,2008,31: 359-361,388.
[10]李 臻,韩新巍,焦德超,等.C臂CT引导下靶向穿刺术在非血管介入诊疗中的应用 [J].介入放射学杂志,2011,20:544-547.
[11] Gupta R,Grasruck M,Suess C,et al.Ultra-high resolution flatpanel volume CT: fundamental principles,design architecture,and system characterization [J].Eur Radiol,2006,16: 1191-1205.
[12]黄大钡,李晓群,文自祥,等.三维重建及类CT图像在胸部肿物射频消融术中的临床应用 [J].当代医学,2010,16:159-161.
[13] Damet J,Sans-Merce M,Miéville F,et al.Comparison of organ doses and image quality between CT and flat panel XperCT scans in wrist and inner ear examinations [J].Radiat Prot Dosimetry,2010,139: 164-168.
[14] Daly MJ,Siewerdsen JH,Moseley DJ,et al.Intraoperative conebeam CT for guidance of head and neck surgery:Assessment of dose and image quality using a C-arm prototype [J].Med Phys,2006,33:3767-3780.
[15]白 玫,刘 彬.采用体模评价DynaCT成像质量和辐射剂量[J].医疗卫生装备,2009,30: 68-69.
[16] Koyama S,Aoyama T,Oda N,et al.Radiation dose evaluation in tomosynthesis and C-arm cone-beam CT examinations with an anthropomorphic phantom[J].Med Phys,2010,37: 4298-4306.
[17]陈疆红,贺 文,赵丽琴,等.高清晰CT胸部低剂量筛查的临床应用[J].中国医学影像技术,2010,26: 2302-2305.
[18] Hirota S,Nakao N,Yamamoto S,et al.Cone-beam CT with flatpanel-detector digital angiography system:early experience in abdominal interventional procedures [J].Cardiovasc Intervent Radiol,29: 1034-1038.

