DEK真核表达载体的构建及其对p53启动子活性的影响
刘婕 ,闫志风 ,张亚楠 ,林娅红 ,丁丽华 ,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.解放军总医院 妇产科,北京 100853
原癌基因dek最初是从急性髓系白血病患者骨髓细胞中以dek-can融合基因的形式分离而来的[1]。研究表明,DEK与人类多种肿瘤的发生、发展有密切关系。DEK在许多恶性肿瘤如肝细胞癌、膀胱癌、恶性黑色素瘤和宫颈癌中均有过表达[2-4]。DEK可以诱发人类乳头状瘤病毒(HPV)E7靶基因癌变,在宫颈癌的发生发展中发挥重要作用[5]。同时,在乳腺癌中DEK的表达也明显升高,而且与肿瘤的分级、分型及淋巴结转移相关,在恶性度高和晚期乳腺癌中可以作为一个特异性的靶基因。最近研究发现,DEK与DNA结合影响染色质重构和基因表达,并且可以抑制依赖p53蛋白和不依赖p53蛋白介导的细胞衰老和凋亡[6]。因此,我们从乳腺cDNA文库中获得了DEK全长编码序列,构建了N端带Flag标签的真核表达载体。人胚肾293T细胞转染效率高,常用来检测真核基因的表达,我们将构建的DEK表达载体转染293T细胞,检测其表达。为了检测DEK在乳腺癌中的作用机制,我们利用构建的真核表达载体,在乳腺癌ZR75-1细胞中检测了DEK对p53基因启动子活性的影响,发现在ZR75-1细胞中,DEK降低了p53启动子的活性。我们的研究为进一步检测DEK在乳腺癌发生和发展中的作用奠定了基础,并预示DEK可能成为将来检测和治疗乳腺癌的靶标。
1 材料和方法
1.1 材料
人胚肾293T细胞、乳腺癌ZR75-1细胞、p53全长启动子报告基因质粒均由本实验室保存;大肠杆菌DH5α感受态细胞购自Invitrogen公司;DMEM培养基和胎牛血清购自GIBCO公司;限制性内切酶BamHⅠ、EcoRⅠ,pfu酶和DNA连接酶购自TaKaRa公司;质粒提取、胶回收和PCR回收试剂盒均为Pro⁃mega公司产品;PCR引物由北京赛百盛生物有限公司合成;转染试剂LipofectAMINE2000购自Invitro⁃gen公司;鼠抗人Flag抗体购自Bethyl Laboratories公司;兔抗人GAPDH和辣根过氧化物酶偶联的IgG抗体购自SantaCruz公司。
1.2 DEK编码序列的PCR扩增
dek基因序列GenBank登录号为NM_003472,根据GenBank中报告的序列设计用于PCR扩增的上游引物(5'-CGGGATCCATGTCCGCCTCGGCCCCTGC-3')和 下 游 引 物(5'-CGGAATTCTCAAGAAATTAG CTCTTTTACAG-3'),上下游引物5'端分别携带BamHⅠ、EcoRⅠ酶切位点。PCR模板为人乳腺文库。PCR反应条件:95℃变性1 min;95℃变性30 s,58℃复性30 s,72℃延伸90 s,29个循环;72℃再延伸7 min。PCR扩增所用的酶为pfu酶。
1.3 pcDNA3-Flag载体的构建
以乳腺文库为模板,PCR扩增dek基因序列,切胶回收目的条带,37℃下用BamHⅠ/EcoRⅠ双酶切dek基因片段与pcDNA3-Flag载体,4 h后切胶回收酶切产物,于16℃连接8 h,连接产物转化大肠杆菌DH5α感受态细胞,挑取平板上的克隆至LB培养基中,37℃培养4 h后提取质粒进行PCR鉴定,鉴定为阳性的质粒再经BamHⅠ/EcoRⅠ双酶切鉴定。
1.4 Western印迹
转染后收集细胞,加入SDS加样缓冲液,煮沸10 min,离心后取上清液进行SDS-PAGE,转移至硝酸纤维素膜,用5%脱脂奶粉于4℃封闭1 h,加入用5%脱脂奶粉1∶1000稀释的Flag抗体或1∶10 000稀释的GAPDH抗体,室温轻摇1 h,TBST洗膜3次,每次7 min,加入用5%脱脂奶粉稀释的辣根过氧化物酶偶联的羊抗兔IgG,室温轻摇1 h,TBST洗膜3次,每次7 min,用化学发光法显色5 min,压片显影。
1.5 萤光素酶和β-半乳糖苷酶活性测定
萤光素酶活性测定按Promega公司试剂说明进行。转染24 h后弃培养基,用PBS洗1次,加入100 μL裂解缓冲液,室温轻摇15 min,将细胞收集到1.5 mL离心管中,振荡5 min,4℃、12 000 r/min离心5 min,收集上清,取15 μL上清液,用荧光计测定萤光素酶活性。
再取上述上清液10 μL与90 μL含β-巯基乙醇(2.7 ml/L)的Z缓冲液混匀,加入20 μL 4 mg/mL的ONPG溶液,常温放置至出现浅黄色,加入50 μL 1 mol/L Na2CO3溶液终止反应,测定 D420nm值,其中β-半乳糖苷酶活性用于校正细胞转染效率,启动子活性为细胞转染效率校正后的萤光素酶活性。
2 结果
2.1 dek基因的PCR扩增
以乳腺文库为模板,用PCR方法扩增DEK全长编码序列,长度应为1128 bp,DNA凝胶电泳结果与预期大小相符(图1)。
2.2 pcDNA-3-Flag-DEK载体的构建
将PCR扩增的DEK编码序列和pcDNA3-Flag用BamHⅠ/EcoRⅠ双酶切处理,经连接、转化,抗性筛选得到的重组质粒经PCR鉴定为阳性(未显示)。PCR鉴定阳性者再用BamHⅠ/EcoRⅠ双酶切鉴定,酶切鉴定结果进一步表明双酶切后在1128 bp处可见特异片段,而空载体对照无此片段(图2)。DNA序列分析结果证实该插入片段为DEK编码序列(结果未显示)。
2.3 pcDNA3-Flag-DEK载体在293T细胞内的表达
将上述阳性克隆提取质粒后转染293T细胞,对照组转染pcDNA3-Flag空载体,24 h后裂解细胞,Western印迹检测细胞内DEK的表达,以GAPDH为内参。结果见图3,转染pcDNA3-Flag-DEK载体的细胞中表达相对分子质量约43×103的特异性条带,与预期结果相符,表明pcDNA3-Flag-DEK载体携带的DEK编码序列能在293T细胞中表达。
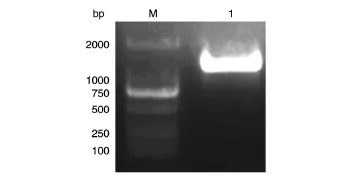
图1 PCR扩增dek基因
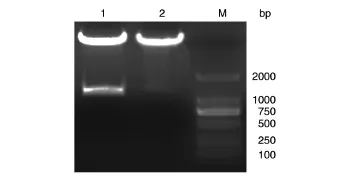
图2 pcDNA-3-Flag-DEK的双酶切鉴定
2.4 不同剂量DEK对p53启动子活性的影响
p53全长启动子报告基因质粒与不同剂量DEK表达载体转染ZR75-1乳腺癌细胞后,通过检测萤光素酶活性,测定DEK对p53启动子活性的影响。方法如前所述,启动子活性为细胞转染效率校正后的萤光素酶活性,即为萤光素酶活性/β-半乳糖苷酶活性。结果见表1,与对照组相比,0.1 μg DEK的表达即可使p53启动子活性降至约1/7;当DEK表达量增加至1 μg时,p53启动子活性降至约1/20。表明DEK明显抑制p53启动子的活性,且对p53启动子活性的调节呈剂量依赖关系(图4,P<0.05)。因此,DEK可能是调控p53启动子活性的新转录因子。
3 讨论
dek在多种人类侵袭性肿瘤中均表达上调,是很重要的癌基因。也有研究发现,DEK过表达抑制HeLa细胞的衰老,并延长人胶质细胞的寿命;DEK表达缺失可诱导宫颈癌细胞凋亡。因此,DEK可以抑制细胞衰老和细胞凋亡[6]。p53是人类很重要的抑癌基因,当细胞受到内部或外部应激反应(如DNA损伤)时,p53蛋白被活化,并诱导细胞凋亡[7]。某些因素引起p53基因突变或功能丧失,是引发宫颈癌的重要因素,宫颈癌组织中突变型p53蛋白的表达率明显高于慢性宫颈炎。Trisha等发现,DEK通过促进p53的降解而抑制细胞凋亡,且DEK抑制p53下游基因p21和Bax的表达[6]。为了进一步研究DEK在肿瘤中的作用,我们构建了DEK的真核表达载体,发现DEK明显抑制p53启动子的活性。因此,除已报道的DEK在蛋白水平调节p53表达[8]外,我们首次发现DEK在转录水平同样抑制p53启动子活性,可能是调节p53表达的新的转录因子,说明DEK在p53的功能发挥中具有重要的调控作用。后续,我们将进一步研究DEK调节p53启动子的功能及机制。综上,我们成功地得到DEK表达载体,为进一步研究DEK在肿瘤发生、发展中的作用机制,以及临床分子靶向治疗奠定了基础。
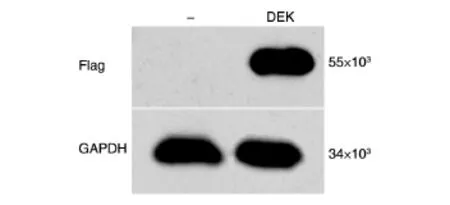
图3 Western印迹检测Flag-DEK在293T细胞中的表达

图4 不同剂量DEK对p53启动子活性的影响

表1 不同剂量DEK对p53启动子活性的影响的实验结果(x±s)
[1]von Lindern M,Fornerod M,van Baal S,et al.The transloca⁃tion(6;9),associated with a specific subtype of acute myeloid leukemia,results in the fusion of two genes,dek and can,and the expression of a chimeric,leukemia-specific dek-can mRNA[J].Mol Cell Biol,1992,12(4):1687-1697.
[2]Wu Q,Li Z,Lin H,et al.DEK overexpression in uterine cer⁃vical cancers[J].Pathol Int,2008,58(6):378-382.
[3]Wise-Draper T M,Mintz-Cole R A,Morris T A,et al.Over⁃expression ofthe cellularDEK protein promotesepithelial transformation in vitro and in vivo[J].Cancer Res,2009,69(5):1792-1799.
[4]Carro M S,Spige F M,Quarto M,et al.DEK expression is controlled by E2F and deregulated in diverse tumor types[J].Cell Cycle,2006,5:1202-1207.
[5]Wise-Draper T M,Allen H V,Thobe M N,et al.The hu⁃man DEK proto-oncogene is a senescence inhibitor and an upregulated target of high-risk human papillomavirus E7[J].J Virol,2005,79:14309-14317.
[6]Wise-Draper T M,Allen H V,Jones E E,et al.Appotosis inhibition by the human DEK oncoprotein involves interfer⁃ence with p53 functions[J].Mol Cell Biol,2006,26:7506-7519.
[7]Vogelstein B,Lane D,Levine A J.Surfing the p53 network[J].Nature,2000,408(6810):307-310.
[8]Kim D W,Chae J I,Kim J Y,et al.Proteomic analysis of apoptosis related proteins regulated by proto-oncogene protein DEK[J].J Cell Biochem,2009,106(6):1048-1059.

