起始pH值对序批式反应器中强化生物除磷系统的影响研究
李亚静 ,谭静亮
(天津城市建设学院 a. 天津市水质科学与技术重点实验室;b. 环境与市政工程学院,天津 300384)
厌氧/好氧生物除磷(EBPR)是废水除磷的一种有效技术.在 EBPR的厌氧阶段,挥发性脂肪酸(VFAs)被消耗并以聚羟基烷酸(PHAs)的形式储存,PHAs合成所需的能量及还原物质通常由胞内聚磷(poly-P)和糖原降解提供,体系中磷的浓度因此会上升;好氧阶段,聚磷菌依靠氧化胞内的PHAs为微生物生长、磷吸收和糖原合成提供碳源和能源.由于好氧磷吸收超过厌氧磷释放,可通过排泥达到磷去除.
研究结果表明[1-2],pH值是影响除磷效率的关键因素之一,在一定范围内提高pH值可提高除磷效果.文献中已有一些关于 pH值对 EBPR影响的报道[3-5],但这些研究都是在控制整个厌氧和好氧阶段pH值条件下进行的.考虑到实际工程中,控制整个厌氧和好氧阶段的pH值较为不便,而且代价也很高,因此,本实验采用只控制反应器的起始pH值来探讨pH值对EBPR的影响及机理.
EBPR技术中,除磷过程的实质是利用微生物所产生的多种酶催化一系列生物氧化还原反应.其中,脱氢酶参与微生物体内氧化—还原反应的全过程,其活性反映了活性微生物量及其对有机物的代谢能力.目前,关于pH值如何影响EBPR酶系统的活性报道较少,而它的研究对深入认识聚磷菌生化调节机理具有指导作用.因此,本文还将对不同pH值下PAO富集的EBPR系统的脱氢酶活性进行研究,并探讨其对聚磷微生物生长和代谢的影响.
1 材料与方法
1.1 接种污泥
实验所用的接种污泥取自天津市某污水处理厂二沉池污泥.
1.2 实验装置及运行
实验在3个SBR中进行,如图1所示.有效容积为4.50 L,每周期进水量3.15 L.每天运行4个周期,每周期 6 h,其中厌氧 2 h,好氧 3 h,DO控制在2 mg/L左右,其余1 h为沉淀、排水和闲置时间.由时间程序控制器及附属电子线路控制运行周期和各段进水、厌氧、曝气、沉淀、排水等.采用电动搅拌器使厌氧阶段反应器内混合液均匀,以曝气器连接曝气头作为好氧阶段气源.

图1 试验装置
1.3 进水配制
用自配模拟生活污水进行实验室小试,配水水质见表 1.进水采用乙酸/丙酸作为混合碳源(摩尔比为1∶2);厌氧开始时反应器化学需氧量为 200 mg/L,磷质量浓度为 10 mg/L.混合液挥发性悬浮固体(VSS)约3000 mg/L,污泥龄约为10 d.

表1 配水水质
1.4 分析方法
可溶解性正磷酸盐(SOP)采用钼锑抗分光光度法;混合液悬浮固体(MLSS),混合液挥发性悬浮固体(MLVSS)按标准方法测定;脱氢酶活性的测定按尹军等[6]的方法进行;采用荧光原位杂交(fluorescence in situ hybridization,简称 FISH)用于确定EBPR系统中 PAOs所占比例,具体方法参考Amann[7].本实验采用 16 srRNA-EUBMIX探针(EUB338,EUB338-Ⅱ和EUB338-Ⅲ)标记表征所有细菌;采用 PAOMIX探针(PAO462,PAO651和PAO846)标记表征聚磷功能菌即 PAOs;污泥样品杂交后,用荧光显微镜(奥林巴斯 IX71)切换不同的滤光片组观察,并用影像捕捉系统摄像,用Imagepro-Plus 6.0对所得图片进行分析,并计算PAOs占全菌的比例.
2 结果与讨论
2.1 pH的周期变化
厌氧阶段开始时,将各反应器内pH值分别调节为 6.5,7.0和 7.5,相应的反应器编号为 SBRl~SBR3.反应器的pH值调节使用0.5 M HC1或0.5 M NaOH,pH值在进水倒入反应器的瞬间调节;在厌氧起始控制pH值策略中,pH值变化如图2所示.厌氧阶段,各反应器中的pH值均向中性变化,在厌氧末,起始pH值为6.5,反应器的pH值升高至7.1,起始pH值为7.5,反应器pH值下降至7.2,而起始pH值为7.0则反应器的pH值基本保持不变.好氧阶段,由于CO2溢出,pH值升高,但由于厌氧起始pH值不同,3个反应器的好氧末pH值也不同,较高的厌氧起始pH值对应较高的好氧末pH值.
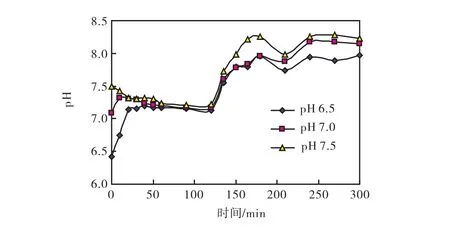
图2 不同起始pH值的SBR中pH的周期变化
2.2 pH对EBPR磷代谢及微生物生长的影响
经过1个月的驯化期,3个SBR反应器污泥的SOP释放与吸收达最大,SOP去除率稳定,污泥沉降性能提高并稳定.此时,可以认为聚磷菌在各SBR反应器富集并处于稳定状态.
表2为不同pH值下一个周期内溶解性正磷酸盐(SOP)变化情况.由表2可知,随着pH值的升高,厌氧释磷量和好氧吸磷量都逐渐增加,释磷速率和吸磷速率也在增加.Yagci等[8]比较了不同条件下EBPR中吸收单位VFA时的厌氧释磷量,认为在具有较高SOP释放/VFA吸收的EBPR系统中,聚磷菌的含量也增大.由于3个反应器的进水量完全相同,而较高的pH对应较高的释磷量,因此,推测在pH=7.5时聚磷菌的含量最高.为了验证这种推测,本文采用FISH结合DAPI染色的方法鉴定聚磷菌并计算其含量比,如图3所示.DAPI染色在FISH杂交后对同一样品进行染色,DAPI与DNA结合会呈现蓝色,而与多聚磷酸盐结合会呈现黄色,既可以提供观片的背景色,又可以观察目标微生物的多聚磷酸含量情况.通过直接计数法测得,三种pH值条件下,聚磷菌占总菌的比例分别为 51.5%,59.3%,64.2%,pH=7.5条件下聚磷菌含量最多.从分子生物学角度分析了三种pH值条件下系统对磷的去除性能.与厌氧释磷相比,SOP的好氧吸收增加得更快,所以SOP的去除率由82.69%增加到98.50%.随着pH值升高,随着驯化污泥的pH值升高,SVI逐渐增加,由89增加到108,污泥沉降性能较为稳定.此结果表明,pH值升高有利于EBPR中聚磷微生物的生长.

表2 pH对EBPR磷代谢的影响

图3 三种pH值下系统中聚磷菌的FISH分析
2.3 进水pH对聚磷微生物酶活性的影响
在不同pH条件下,脱氢酶活性在一个周期内的变化趋势相同,如图4所示.由图4可知,脱氢酶活性在厌氧过程没有明显变化,这是由于厌氧阶段不存在最终电子受体,因而脱氢酶活性基本不变[9].在好氧阶段,脱氢酶活性随着时间延长而降低,并且厌氧阶段活性大于好氧阶段活性.结果与文献报道一致,如Goel等人[10]研究发现,脱氢酶活性在厌氧阶段比在好氧阶段高40%~60%;Trevors等人[11]对土壤的脱氢酶活性进行研究,发现厌氧阶段的活性大于好氧阶段的活性,其原因有待于进一步研究.
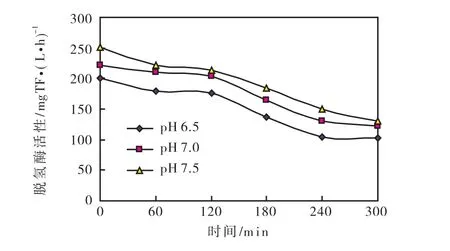
图4 不同pH值厌氧和好氧条件下脱氢酶活性的变化曲线
由前述可知,好氧末脱氢酶活性可以反映微生物细胞的合成能力,脱氢酶活性在好氧始和好氧末的差值可以反映 PHA降解能力.在不同 pH值条件下,好氧始和好氧末的脱氢酶活性如图5所示.由图5可知,随着pH值升高,好氧末脱氢酶活性增加,表明微生物细胞的合成能力增强.这说明,较高的pH有利于聚磷菌的生长代谢,从而提高了除磷效率.同时,也反映了在高pH下,EBPR除磷效率的提高是由于聚磷微生物的富集,这进一步说明在一定pH范围内,高pH时除磷效率的改善主要是微生物作用而不是化学作用[2].脱氢酶活性在好氧始和好氧末的差值随着pH升高变化不大,表明微生物降解PHA的速率受pH值的影响较小.

图5 不同pH值下好氧始与好氧末脱氢酶活性的变化曲线
3 结 论
(1)控制起始pH值在6.5~7.5范围内,随着pH值升高,厌氧释磷量和好氧吸磷量都逐渐增加,释磷速率和吸磷速率也在增加.在好氧末,可溶解性正磷酸盐(SOP)浓度 SBR3<SBR2<SBR1,除磷效率分别为98.50%,93.87%,82.69%;最佳除磷效果发生在pH=7.5.
(2)从分子生物学角度分析了三种 pH值条件下系统对磷的去除性能.即运用FISH技术计算出不同pH值条件下聚磷菌在系统中的含量比,得知随着pH值升高,聚磷菌占总菌的比例分别为21.5%,29.3%,34.2%,在pH=7.5条件下聚磷菌含量最多,其除磷效果也最高.
(3)比较不同 pH值下增强生物除磷系统中关键酶活性的变化规律.结果表明,在 pH=6.5~7.5范围内,脱氢酶的活性随着pH的增加而线性增加,表明较高的pH有利于聚磷菌的生长和提高聚磷菌的活性,从而提高了除磷效率.
综上所述,在高pH下,EBPR除磷效率的提高是由于聚磷微生物的富集,这进一步说明在一定 pH范围内,高pH时除磷效率的改善主要是微生物作用而不是化学作用.可见,污水起始pH值对EPBR的除磷效果的影响是显著的,通过控制起始pH值可以达到显著提高污水除磷效果的目的.
[1]OEHMEN A,LEMOS P C,CARVALHO G,et al.Advances in enhanced biological phosphorus removal:From micro to macro scale[J]. Water Research,2007,41(11):2271-2300.
[2]ZHANG Chao,CHEN YIN-guang,LIU Yan. The long-term effect of initial pH control on the enrichment culture of phosphorus- and glyco gen-accumulating organisms with a mixture of propionic and acetic acids as carbon sources[J]. Chemosphere,2007,69(11):1,713-1,721.
[3]OEHMEN A,VIVESM T,LU H B,et al. The effect of pH on the competition between polyphosphate- accumulating organisms and glycogen-accumulating organisms[J]. Water Research,2005,39(15):3,727-3,737.
[4]FILIPE C D M,DAIGGER G T,GRADY C P L. A metabolic model for acetate uptake under anaerobic conditions by glycogen accumulating organisms:stoichiometry,kinetics,and the effect of pH[J]. Biotechnology and Bioengineering,2001,76:17-31.
[5]FILIPE C D M,DAIGGER G T,GRADY C P L. Effects of pH on the rates of aerobic metabolism of phosphorus-accumulating and glycogen-accumulating organisms[J]. Water Environment Research,2001,73:213-222.
[6]尹 军,付 瑶. 活性污泥的基质代谢脱氢酶活性测定[J]. 中国给水排水,2002,9:50-52.
[7]AMANN R I. Molecular Microbial Ecology Manual[M]. Netherland:Kluwer Academic Publishers,1995.
[8]YAGCI N,ARTAN N,COKGOR U,et al. Metabolic model for acetate uptake by a mixed culture of phosphate- and glycogen-accumulating organisms under anaerobic conditions[J]. Biotechnology and Bioengineering,2003,84(3):359-373.
[9]张 超,陈银广,刘 燕. pH对增强生物除磷系统酶活性的影响[J]. 高等学校化学学报,2008,9:1,797-1,800.
[10]GOEL R,MINO T,SATOH H,et al. Enzyme activities under anaerobic and aerobic conditions inactivated sludge sequencing batch reactor[J]. Water Research,1998,32(7):2,081-2,088.
[11]Trevors J T. Effect of substrate concentration,inorganic nitrogen,O2concentration,temperature and pH on dehydrogenase activity in soil[J]. Plant and Soil,1984:77(2/3):285-293.

