草鱼MHC classⅠ基因多态性及其与鱼体抗柱形病能力关系分析
杨 玲,孟庆磊,张龙岗,张志山,安 丽,董学飒,刘羽清,付佩胜 (山东省淡水水产研究所,山东省淡水水产遗传育种重点实验室,山东 济南 250117)
草鱼MHCclassⅠ基因多态性及其与鱼体抗柱形病能力关系分析
杨 玲,孟庆磊,张龙岗,张志山,安 丽,董学飒,刘羽清,付佩胜 (山东省淡水水产研究所,山东省淡水水产遗传育种重点实验室,山东 济南 250117)
用1对引物HMC6-S和MHC6-A分别从草鱼(Ctenopharyngodonidellus)40尾抗病个体和40尾易染个体的基因组DNA中扩增MHC基因片段,扩增产物长度为262bp。在262bp的核苷酸序列中,有50个(19%)多态位点。在其编码的87个氨基酸位点中,有16个多态位点(18.39%),其中有10个位点发生在多肽结合位点上(62.5%)。对核苷酸替代的类型和位点进行分析,发现多肽结合位点的非同义碱基替代率与同义碱基替代率均大于非多肽结合位点的非同义碱基替代率与同义碱基替代率,表明氨基酸替代替换集中出现在多肽结合位点(PBR)上。分析80个个体的测序结果,发现有17种不同的MHC class Ⅰ等位基因,编码17种不同的氨基酸序列。等位基因A、B、C、D是2个群体共有的,其中等位基因A出现的频率最高,占总样本数量的36.25%;等位基因E、F、G、H、I、P只出现在抗病个体中,等位基因J、K、L、M、N、O、Q只出现在易染个体中。
主要组织相容性复合体(MHC);MHC class Ⅰ多态性;抗病力;草鱼(Ctenopharyngodonidellus)
主要组织相容性复合体(major histocompatibility complex,MHC),是存在于脊椎动物某一染色体上编码主要组织相容性抗原的一组紧密连锁的基因群,各类生物MHC基因的生物学功能都是相同的,主要是识别、清除外来和内在抗原,在免疫反应中起着重要作用,与机体免疫应答、免疫调节和移植排斥等有关。
MHC 基因可分为MHCⅠ类和MHCⅡ类分子,2类分子均参与抗原的提呈过程,存在多态性的抗原结合位点。Ⅰ类基因由2 条分开的肽链组成,一条为MHC 编码的α 链(或称为重链) ,由3 个片段(α1、α2 和α3) 组成; 另一条为β 链(或称为轻链) ,但不是由MHC 编码,β 链属于β-2 微球蛋白(简称为β2m) 。Ⅱ类分子由2 条非共价的结构相似的多肽链(α 链和β 链) 组成,每条链均有2 个功能区,即α1、α2 和β1、β2,每个功能区含90 个氨基酸和1 个约25 个氨基酸的跨膜区。在哺乳动物中还存在Ⅲ类基因,通常位于Ⅰ类基因与Ⅱ类基因之间,编码控制某些补体成分和其受体产生的基因。
草鱼(Ctenopharynodonidellus)隶属于鲤形目鲤科草鱼属,是我国“四大家鱼”之一,然而草鱼的病害较多,是我国淡水鱼类养殖中死亡率最高的鱼种,年存活率仅为15% ~30%。常见病有草鱼烂鳃病(即柱形病,其病原菌为柱状黄杆菌(Flavobacteriumcloumnare)、肠炎病、赤皮病,出血病等10多种。为了阐明草鱼MHC 等位基因的多态性及其与疾病间的关系,首先筛选出抗病个体和易染个体各40个,并根据Genbank(EF584535.1)中MHC classⅠα1区的序列设计1对引物MHC6-S和MHC6-A,对其基因组DNA进行扩增,结果显示MHC I 等位基因呈现高度多态性,变异幅度大,这种变异具有种属分子特征,并可能与草鱼对疾病的特异抵抗力或易感性有关联。
1 材料与方法
1.1 材料
本研究通过自然选择和人工选择的方法,选用3个草鱼群体(分别为长江野生群体、野生亲本人工繁育一代群体、养殖群体)各200条,利用柱状黄杆菌(Flavobacteriumcloumnare)进行攻毒试验。试验期间还得了小瓜虫病。通过攻毒试验和自然选择,共筛选出抗病个体40尾和易染个体40尾,易染个体为最先得病死亡的个体,抗病个体为不发病也一直不死亡的个体。对于易染个体,根据死亡先后顺序编号,并迅速转移到-20℃冰箱中备用;抗病个体打上标记(T型标记)并记录好编号,剪取少许尾鳍,放-20℃冰箱中备用。
试验所用的PCR引物由上海生工生物工程公司合成;Taq DNA聚合酶、dNTP 、MgCl2、Marker等为大连宝生物工程有限公司生产;PCR仪为德国PEQSTAR 10AT型。
1.2 引物设计
根据Genbank中草鱼MHC classⅠα1区的序列设计一对基因特异性引物MHC6-S(5′ TTACCCTTTGACTGGTTAAA 3′)和MHC6-A(5′ TTTCTTTGTCCACAGGAACACACTC 3′),对其基因组DNA进行扩增,用于草鱼MHC classⅠ基因的多态性分析。
1.3 DNA提取和PCR扩增
对于易染个体,取其背部肌肉提取基因组DNA,对于抗病个体,则剪取少许尾鳍,采用上海生工生物工程公司的Ezup柱式动物基因组DNA抽提试剂盒(SK8252)提取基因组DNA。PCR扩增反应总体积为50μl,其中10×Buffer(Takara)5μl,MgCl2(25mmol/L)4μl,dNTP(Takara,各2.5mmol/L)4μl,Taq聚合酶(Takara,5U.μl-1)0.5μl,上、下游引物(10μmol/L)各1μl,模板DNA3μl,补足灭菌双蒸水至50μl。
反应条件为:94℃预变性5min,之后进行35个循环(94℃ 40s,55℃ 50s,72℃ 50s),最后72℃延伸10min。
1.4 PCR产物测序
PCR产物用1%琼脂糖凝胶电泳(1×TBE 5V/cm恒压)进行检测,溴化乙锭染色,凝胶成像系统观察拍照。PCR产物送上海生工生物工程公司纯化,并进行双向测序,测序反应采用和PCR反应一致的正、反向引物。
1.5 序列多态性分析
用MEGA 5.1软件的Clustal W软件进行多重比对分析,并辅以人工校对,确定变异位点和不同序列。利用MEGA 5.1软件计算多态位点、统计序列的碱基组成和转换/颠换比率(Ts/Tv ratios)、计算相对遗传距离(P-distance),用临位相联法(neighbor-joining,NJ)方法构建进化树。用改良的Nei-Gojobori (p-distance)方法统计非同义碱基替换(dN)和同义碱基替换(dS)。
2 结果与分析
2.1 MHC classⅠ基因的多态性
本试验共对80个个体的PCR产物进行了双向测序,结果表明,在262bp的核苷酸序列中,有50个核苷酸变异位点,其中28个颠换(si),16个转换(sv),6个既有转换又有颠换(si+sv),转换/颠换比值R=si/sv为0.57。这262bp的核苷酸共编码87个氨基酸,是草鱼MHC classⅠα1区的氨基酸序列,80个个体共有17种不同的氨基酸序列,与人类MHC(HLA-A2)基因的比较结果见图1。

b :示人(HLA-A2)与抗原多肽结合的氨基酸; . :示抗原多肽结合的关键性氨基酸;p : 表示人(HLA-A2)与抗原多肽结合的相关性氨基酸;* :示缺失;-:示与等位基因A一致的氨基酸序列
与人类MHC(HLA-A2)基因的氨基酸序列进行比对分析,确定本研究所得草鱼HMC classⅠ基因的氨基酸区段对应位点为1~87。在这17种不同的氨基酸序列中,都保留了人HLA-A2与抗原多肽结合的3个关键性氨基酸,即第7位、第59位和第84位的酪氨酸(Y);与抗原多肽结合的相关性氨基酸(p)则部分保守,15个与抗原多肽结合相关性氨基酸中有4个氨基酸位点存在多态性(26.67%),分别在第61位、65位、69位和79位,具有2种或3种不同的的氨基酸变异;与抗原多肽结合氨基酸(b)位点共有39个,其中10个位点存在多态性,占25.64%;在总的87个氨基酸序列中,共有16个变异位点( 18.39%),在这16个变异位点中,其中有10个是在多肽结合位点(PBR)上。纵观该α1区的氨基酸变异位点,比较集中出现在形成α螺旋的区域(第61~80位氨基酸),该区共有11个多态位点,占该螺旋区的55%,占总多态位点的68.75%。
对核苷酸替换的类型及位点进行分析,发现多肽结合区域非同义碱基替换与同义碱基替换的数值均大于非多肽结合位点的非义碱基替换与同义碱基替换值,表明氨基酸替换较多出现在抗原结合区(PBR)附近(表1)。
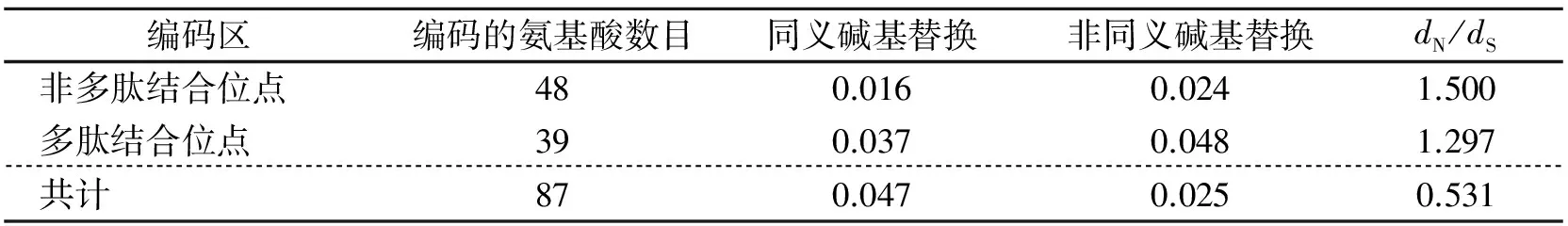
表1 草鱼17个不同的MHC class Ⅰ α1 区序列每个核苷酸位点的同义碱基替换(dS)和 非同义碱基替换(dN)分析结果
利用MEGA 5.1中的P-distance软件计算出这17种不同的MHC基因核苷酸序列的遗传距离,平均遗传距离为0.043(表2)。采用临位相联法(neighbor-joining,NJ)构建系统进化树(图2)。分析表明,这17个等位基因和Genbank(ABU86893)中的草鱼聚成一个分支,与鲢鱼(Hypophthalmichthysmolitrix)的同源关系最近,与斑马鱼(Daniorerio)的同源关系次之,与金鱼(Carassiusauratus)、约氏魮(Barbusintermedius)同源关系较远,与小鼠(Mouse)和人类(Human)的同源关系最远。

表2 17种不同的草鱼MHC class Ⅰ核苷酸序列的遗传距离

图2 草鱼的17个不同的MHC class Ⅰ 基因型与其他生物对应序列的系统进化树
2.2 MHC class Ⅰ等位基因的多态性及与抗病力的关系
草鱼17种不同的等位基因在抗病群体和易染群体中的分布情况见表3,在17种不同的氨基酸序列中,等位基因A、B、C、D是抗病群体和易染群体所共有的,不同等位基因在易染群体分布与抗病群体分布频率见图3,在2个群体共有的5种氨基酸序列中,等位基因A出现的频率最高,在抗病群体中占42.5%,在染病群体中占30%,占总样本数量的36.25%,等位基因B、C、D在抗病群体和染病群体占有相同比例,等位基因E、F、G、H、I、P只出现在抗病个体中,它们出现的频率分别为10%、7.5%、7.5%、7.5%、5%、5%,等位基因J、K、L、M、N、O、Q只出现在染病个体中,其频率分别为15%、12.5%、10%、5%、5%、5%、2.5%。

表3 不同等位基因在染病群体与抗病群体的分布情况

图3 不同MHC class Ⅰ 等位基因在抗病群体和染病群体中的分布频率
3 讨论
主要组织相容性复合体(MHC)是脊椎动物中发现的编码细胞表面免疫球蛋白样受体的异二聚体,具有高度多态的基因群,其表达产物分布于各种细胞的表面,某些基因型与生物体抗病力存在一定的相关关系。MHC基因具有高度多态性,在鱼类中的多态现象也很明显,其中抗原结合位点(peptide binding region,PBR) 是最重要的可变区域,MHC 的等位基因通常在PBR 区域存在高比例的非同义替代[1]。通常认为,MHC 的变异和新等位基因的产生是点突变、重组和现存等位基因之间转换的结果。研究表明,MHC 的高度多态性是自然选择和性别选择的结果[2-4]。在MHC多态性研究方面,Ⅰ 类基因中,夏春等[5]和Aoyagi等[6]先后在虹鳟中发现了a 的多个等位基因; Dijkstra等[7]发现bOnmy2UCA 和Onmy2UDA 分别有7 个和8 个等位基因。夏春等[8]在草鱼发现了a 的11 个等位基因、Cuesta等[9]在金头鲷中分别发现了a 的 2 个等位基因。Stet等[10]发现在大西洋鲑的Ⅱ 类A 的3非翻译区,每一个单倍型都有1 个独特的微卫星标记; 蔡完其等[11]发现红鲤Ⅰ 类分子的α2 链适宜作为不同群体的分子遗传标记;
MHC最重要的功能之一表现在免疫方面,Dijkstra等[12]发现虹鳟的类Onmy2UBA在传染性造血器官坏死病毒(IHNV) 感染后的性腺细胞系中的表达量上升;Landis 等[13]发现虹鳟的Ⅰ类b 在病毒感染后表达量上升。在MHC等位基因与抗病关系的研究方面,Kjglum等[14]发现大西洋鲑的Ⅰ类的UBA*0201 和UBA*0301 是最有抗性的等位基因; UBA*0601 和Ⅱ 类A 的DAA*0301 是最敏感的等位基因; 而Ⅰ和Ⅱ 类的基因型组合UBA*0201/*0301、DAA*0201/*0201 是最具抗性的; 基因型组合UBA*0601/*0801、DAA*0501/*0501 和UBA*0201/*0301、DAA*0301/*0501 是最易感的。张玉喜等[15]通过研究牙鲆MHC class Ⅱ B基因研究,发现有13种不同的氨基酸序列,其中等位基因g和h只出现在抗病个体中,等位基因l只出现在感病个体中,为筛选牙鲆抗病相关基因标记和利用抗病基因型进行抗病选育奠定了基础。Johnson等[16]发现了虹鳟Ⅰ类b在抗细菌冷水病的作用,以及8个和b基因紧密连锁的标记。
在草鱼MHC研究方面,张燕等[17]在长江草鱼群体MHC Class Ⅱ B的多态性和进化分析中,草鱼长江3个群体的主要组织相容性复合体(MHC)Class Ⅱ B基因,分析了草鱼MHC的进化模式和种群遗传结构,推测草鱼至少存在5个MHC Class Ⅱ座位。基于等位基因频率的AMOVA分析,显示长江草鱼群体MHC等位基因分布没有显著差异。杨天耀[18]在克隆Ctid-β_2m分子基础上,分析了Ctid-MHC Ⅰ多样性;并对Ctid-MHC Ⅰ在各组织的表达进行了定量,表达、鉴定了Ctid-MHC Ⅰ重组蛋白,解析了Ctid-MHC Ⅰ和Ctid-β_2m的分子特征。
在本研究中,草鱼MHC class Ⅰ的α1区的262个核苷酸序列中,有50个核苷酸变异位点,多态位点占总序列的19%,在其编码的87个氨基酸中,共有16个变异位点,其中有10个发生在多肽结合位点(PBR)上,并且变异位点比较集中出现在形成α螺旋的区域(第61~80位氨基酸),该螺旋区共有11个变异位点,占该区氨基酸位点的55%。充分证明了草鱼MHC class Ⅰ基因具有高度的多态性,α1区的变异位点集中出现在形成α螺旋区域。
在草鱼MHC class Ⅰ的17种不同氨基酸序列中,等位基因E、F、G、H、I、P只出现在抗病个体中,等位基因J、K、L、M、N、O、Q只出现在染病个体中,为筛选草鱼抗病相关基因标记提供了参考,进一步可以作为分子遗传标记进行抗病相关标记辅助育种。
草鱼是我国淡水渔业重要养殖品种,也是病害严重的鱼类,病害是制约我国草鱼养殖业发展的主要因素,草鱼常见病有烂鳃病(即柱形病)、赤皮病、肠炎病、出血病等10多种,前3种俗称草鱼“三大病”,其中烂鳃病是引起草鱼死亡的主要病害,其病原菌为柱状黄杆菌。随着对草鱼MHC 方面研究的积累,应用MHC 筛选抗病分子标记进行抗病性状的选择育种,用含抗性MHC 等位基因的亲鱼进行抗病育种改良,培育高抗病力新品种,将会有突破性的进展,MHC 系统将在未来草鱼的研究领域中有更为广阔的前景。
[1]Ristow S S,Grabowski L D,Thompson S M,et al.Coding sequences of the MHCB chain of homozygous rainbow trout (Oncorhynchusmykiss) [J].Developmental and Comparative Immunology,1999,23:51-60.
[2]Consuegra S,Megens H J,Schaschl H,et al.Rapid evolution of the MHC classlocus results in different allelic compositions in recently diver ged populations of Atlantic salmon[J].Molecular Biology and Evolution,2005,22:1095-1106.
[3]Consuegra S,Megens H J,Leon K,et al.Patterns of variability at the major histocompatibility classalpha locus in Atlantic salmon contrast with those at the classlocus[J].Immunogenetics,2005,57:16-24.
[4]Shum B P,Guethlein L,Flodin L R,et al.Modes of salmonid MHC classandevolution differ from the primate paradigm[J].The journal of immunology,2001,166:3297-3308.
[5]夏 春,青柳宙,中西照幸.一种MHC类等位基因存在于低等脊椎动物虹鳟鱼[J].科学通报,2001,46 (2) :121-126.
[6]Aoyagi K,Dijkstra J M,Xia C,et al.Classical MHC classgenes composed of highly divergent sequence lineages share a single locus in rainbow trout (Oncorhynchusmykiss) [J].The Journal of Immunology,2002,168:260-273.
[7]Dijkstra J M,Kiryu I,Yoshiura Y,et al.Polymorphism of two very similar MH rainbow trout(Oncorhynchusmykiss) [J].Immunogenetics,2006,58:152-167.
[8]夏 春, 徐广贤,林常有,等.草鱼MHC class I 等位基因克隆及其多态性分析[J].自然科学进展,2004,14(1):51-58.
[9]Cuesta A,Meseguer J,Esteban M A.Cloning and regulation of the major histocompatibility classalpha gene in the teleost fish gilthead seabream[J].Fish & Shellfish Immunology,2007,22:718-726.
[10]Stet R J,Vries B,Mudde K,et al.Unique haplotypes of cosegregating major histocompatibility classA and classB alleles in Atlantic salmon (Salmosalar) give rise to diverse classgenotypes[J].Immunogenetics,2002,54:320-331.
[11]蔡完其,轩兴荣,王成辉,等.红鲤4群体间主要组织相容性复合体的差异[J].水产学报,2003,27(2):113-118.
[12]Dijkstra J M,Katagiri T,Hosomichi K,et al.A third broad lineage of major histocompatibility complex (MHC) classin teleost fish; MHC classlinkage and processed genes[J].Immunogenetics,2007,59:305-321
[13]Landis E D,Purcell M K,Thorgaard G H,et al.Transcriptional profiling of MHC classgenes in rainbow trout infected with infectious hemat opoietic necrosis virus[J].Molecular Immunology,2008,45:1646-1657.
[14]Kjglum S,Larsen S,Bakke H G,et al.How specific MHC classand classcombinations affect disease resistance against infectious salmon anaemia in Atlantic salmon (Salmosalar) [J].Fish & Shellfish Immunology,2006,21:431-441.
[15]张玉喜,陈松林.牙鲆MHC class Ⅱβ 基因多态性及其与鱼体抗病力关系的分析[J].水产学报,2006,30(5):633-639.
[16]Johnson N A,Vallejo R L,Silverstein J T,et al.Suggestive association of major histocompatibility IB genetic markers with resistance to bacterial cold water disease in rainbow trout (Oncorhynchusmykiss) [J].Marine Biotechnology (NY),2008,10:429-437.
[17]张 燕,姚延丹,段辛斌,等.长江草鱼群体MHC Class II B的多态性和进化分析[J].淡水渔业,2010,40(5):14-21.
[18]杨天耀.草鱼β_2m基因的分子克隆与MHC class Ⅰ多态性分析及其重组蛋白的鉴定 [D].北京:中国农业大学.2005.
2013-03-20
山东省农业良种工程项目。
杨 玲(1967-)女,研究员,主要从事鱼类遗传育种研究。
[作者简介]付佩胜,E-mail:jnsfu@126.com。
Q78;Q959.46+8
A
1673-1409(2013)17-0042-06

