吸毒者头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的分析及评价
向 平,孙英英,沈保华,沈 敏
(司法部司法鉴定科学技术研究所 上海市法医学重点实验室,上海200063)
1 引言
滥用药物毛发分析已逐渐应用于法医和临床毒物分析领域[1-2]。与传统的血液、尿液等生物检材相比,毛发分析的突出优点在于其检测时限长,根据头发的长度可反映几周至几个月的用药情况,而尿液分析的检测时限仅为几天。
海洛因吸毒是我国的一个严重社会问题[3-4]。海洛因进入体内后经肝脏迅速去乙酰化形成6-单乙酰吗啡,然后进一步代谢成吗啡[5]。但是,尿液中检出的吗啡成分也可能是由服用某些临床药物或者鸦片类产品引起,因此,尿液中吗啡阳性结果的解释与判定是毒物分析领域的一个难题[1]。
尿液中吗啡阳性的结果解释可通过毛发分析加以解决[1,6],因为毛发中阿片类药物原型及其代谢物的浓度及其比率可用于区分海洛因吸毒者和其它吗啡类生物碱的接触者,也可以区分主动吸食和被动污染。6-单乙酰吗啡是海洛因的主要活性代谢物,是海洛因吸毒的体内标志物。乙酰可待因是海洛因合成过程的杂质成分,有报道建议将其作为海洛因吸毒的特殊标志物[7]。但迄今,还缺少我国吸毒人群头发中阿片类药物成分的分布信息。
国际毛发分析协会 (The Society of Hair Testing,SOHT)[8]建议,区分海洛因吸毒与可待因或吗啡类使用者时,毛发中6-单乙酰吗啡浓度的阈值(cutoff)为0.2 ng/mg,同时,吸毒者毛发中6-单乙酰吗啡与吗啡的浓度比率应大于1.3。但是,毛发分析中一个很重要的问题是如何使包埋于毛发基质中的目标物释放出来。采用通常的毛发前处理过程如酸或碱水解孵化,化学性质不稳定的6-单乙酰吗啡很容易分解成吗啡,乙酰可待因可能分解为可待因,而且需要过夜,费时,由此可能造成不同的毛发样品前处理过程产生不同的阿片类药物分布规律。冷冻研磨是一种新型的样品前处理方法,将样品在液氮温度下粉碎,主要应用于生命科学等领域。采用冷冻研磨处理毛发样品可有效地减少性质不稳定的6-单乙酰吗啡和乙酰可待因的分解。
本研究将采用冷冻研磨处理头发样品,考察50例海洛因吸毒者头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的浓度,与其它非中国吸毒人群的毛发分析结果比较,并进一步考察SOHT建议的6-单乙酰吗啡与吗啡的浓度比率区分方法的可行性。
2 材料与方法
2.1 试剂
海洛因、6-单乙酰吗啡、吗啡、可待因、乙酰可待因、同位素内标6-单乙酰吗啡-d6和吗啡-d3对照品(浓度1.0 mg/mL)均购自美国Cerilliant公司。甲醇、乙腈、氯仿和异丙醇购自美国Fisher Scientific公司,甲酸和乙酸铵购自瑞士Fluka公司,其它试剂均为分析纯。实验用水为超纯水,经Milli-Q系统制备。
2.2 头发样品
50份海洛因吸毒者阳性头发来源于本实验室2010~2012年间受理的涉毒鉴定案例。贴根采取海洛因吸毒者头顶部3cm头发段(黑色),标注后室温保存。
空白头发来自于本实验室工作人员,没有阿片类药物接触史。
2.3 样品前处理过程
按照已建立的方法[9],首先进行去污处理,头发样品置具塞试管中,依次用0.1%洗洁精2mL、去离子水和二氯甲烷各清洗两次,最后一次清洗液留存、分析。取出头发晾干,用剪刀剪成约1~2mm段。将剪碎的头发段和撞子装入冷冻研磨样品瓶,密封后将样品瓶浸入液氮中,撞子在磁场作用下反复冲撞将样品粉碎。称取冷冻研磨后的头发粉末20mg,置于10mL具塞玻璃试管中,加入10μL混合内标6-单乙酰吗啡-d6和吗啡-d3溶液(0.4μg/mL)和 pH9.2硼酸缓冲溶液2mL,超声 30min。然后加入氯仿-异丙醇(9:1)混合液 2mL 涡旋混合,离心(1437×g)3min,转移下层有机相,于空气流下吹干。残余物中加入乙腈-20mM乙酸铵(80∶20, v/v)流动相溶液 100μL 复溶,转移至进样管中,取5μL进样。
2.4 LC-MS/MS分析
液相色谱-串联质谱(LC-MS/MS)系统包括API 4000 QTRAP串联四极杆线性离子阱质谱仪 (美国Applied Biosystems公司)和 AcquityTM Ultra Performance LC超高压液相色谱仪(美国Waters公司),由Analyst 1.5软件进行数据采集和分析。
色谱柱为Resteck Allure PFP丙基柱(100mm×2.1mm,5μm),流动相:A 为 20mmol/L 乙酸铵和 0.1%甲酸缓冲溶液,B为乙腈,流动相梯度洗脱程序见表1;恒流:250μL/min。
质谱检测为电喷雾离子源正离子模式(ESI+),采用多反应监测模式(MRM)检测。离子喷雾电压(IS):5500V;离子源温度(TEM):450℃;碰撞气氮气(CAD):7psi;气帘气(CUR):10psi;雾化气(GS1):20psi;辅助气(GS2):40psi。

表1 UPLC梯度洗脱程序
所建方法经验证,头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的最低检出限 (LOD)在0.005~0.02 ng/mg 范围,最低定量限(LOQ)在 0.01~0.05 ng/mg范围。方法的提取回收率在 47.2%~110%,日内和日间精密度的变异系数小于14%。
3 结果与讨论
海洛因、6-单乙酰吗啡等一些化合物在样品前处理过程中不稳定[10],易分解。已有的研究表明,甲醇提取效果好,是海洛因吸毒头发鉴定的推荐方法,但是,该方法至少需要超声2h以上,费时,难以满足我国公安机关拘留24h内必须做出决定的要求,所以,迫切需要研发冷冻研磨这种快速前处理技术。我们之前的研究中[9],考察了不同样品前处理过程中海洛因和6-单乙酰吗啡的稳定性(见表2)。尽管在缓冲液超声时有部分6-单乙酰吗啡降解为吗啡,但由于超声时间短,应用方法1降解程度较低(29.6%),同时,采用本方法海洛因降解不超过6%[9]。
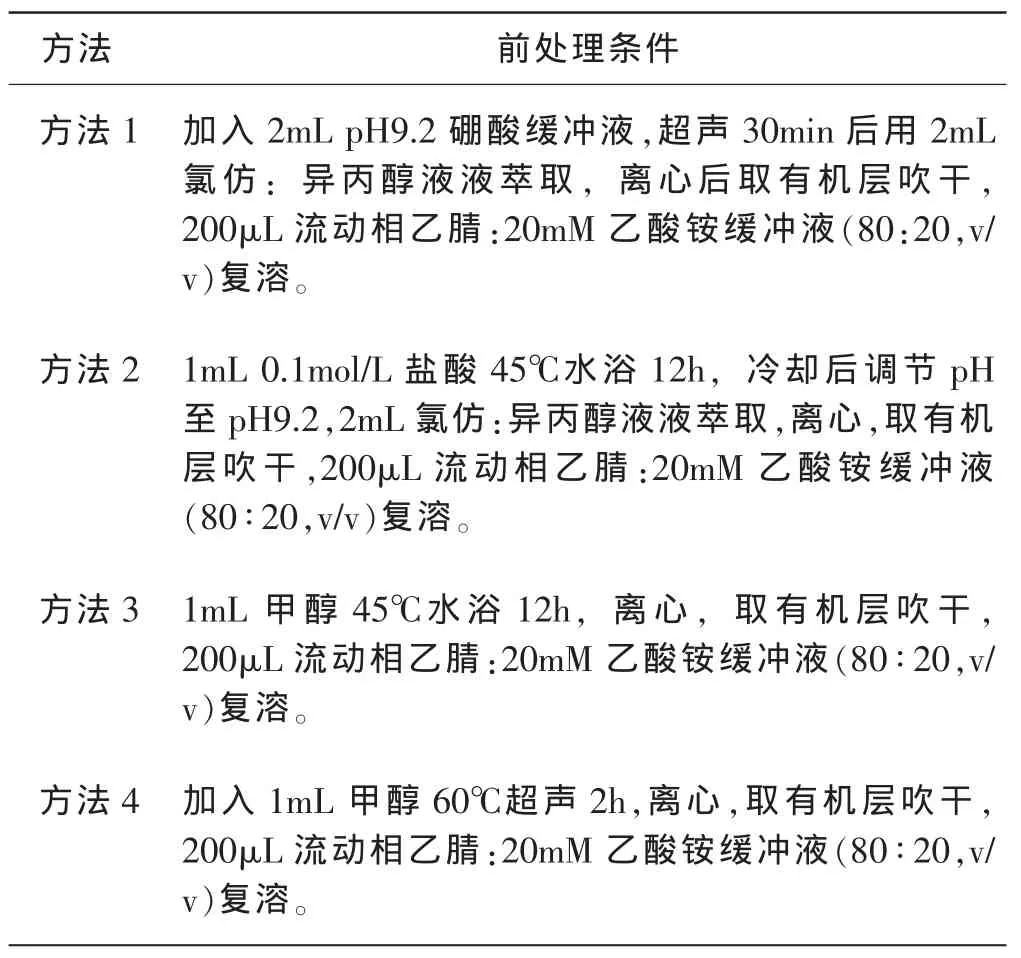
表2 不同样品前处理方法比较
50例吸毒者的头发样品经所建的LC-MS/MS方法分析[9],结果见表3,其中均检出6-单乙酰吗啡、吗啡、可待因和乙酰可待因成分,仅有2个样品中未检出海洛因成分。头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的浓度均值分别为1.83(范围0.02~12.20)、5.36 (范围 0.20~52.90)、2.42(范围 0.11~10.30)、 6.07(范围 0.25~55.60)和 0.58(范围 0.05~3.99)ng/mg。

表3 吸毒者头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的浓度 (ng/mg)
所有样品中仅2个中海洛因的浓度最高,这主要是由于个人卫生习惯,在日常的洗发过程中,海洛因可降解为6-单乙酰吗啡,6-单乙酰吗啡继续降解为吗啡。有2个样品中未检出海洛因,这与Kintz等[10]采用甲醇浸泡的检出率90%相近,但另一些报道中海洛因的检出率较低,如 14%[11]、27%[12]、35%[13]和50%[14]。
毛发分析时排除外污染干扰是确保结果准确性的关键,通常可进行三个步骤。首先,毛发样品处理前需要清洗,再者,分析时同时检测相应的代谢物,最后在结果分析时根据cutoff值[15]。在本研究中,按照Tsanaclis[15]的建议,头发中海洛因、6-单乙酰吗啡和吗啡的浓度远超过最后一次清洗液中浓度10倍以上。海洛因的体内主要代谢物6-单乙酰吗啡和吗啡出现在所有头发样品中,并且,6-单乙酰吗啡浓度高于SOHT 建议的 cutoff值(0.2 ng/mg)。
与其它研究[16-18]相比较,头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的浓度无明显差异。在20例海洛因吸毒者头发中中海洛因、6-单乙酰吗啡、吗啡和可待因的浓度均值分别为0.17、0.90、0.26和 0.18 ng/mg[16];另一报道中,82个头发样品中6-单乙酰吗啡和吗啡的浓度中值分别为3.2(范围 0.1~154.1)和 2.1 (范围 0.1~36.3) ng/mg[17];Tsanaclis[18]调查英国本土上药物滥用状况,吸毒者头发中海洛因、6-单乙酰吗啡、吗啡、可待因和乙酰可待因的最高浓度分别为 146.4、220.8、 291.3、68.4 和 40.3 ng/mg。
海洛因吸毒程度可通过头发中6-单乙酰吗啡的浓度加以划分[1],Pépin[19]建议分为低、中和高三档,按照此建议,本研究中50例吸毒程度的分布情况见图1,吸毒习惯以每周或每天1次为主。当然,这种划分是相对的,因为很多因素可影响药物进入毛发的量,例如毒品纯度、吸毒次数、吸毒者的毛发颜色、药物进入毛发的速率等,个体在药物代谢和头发护理、卫生习惯等都存在差异。

图 1 本研究结果按照Pépin[19]建议的吸毒程度分布情况
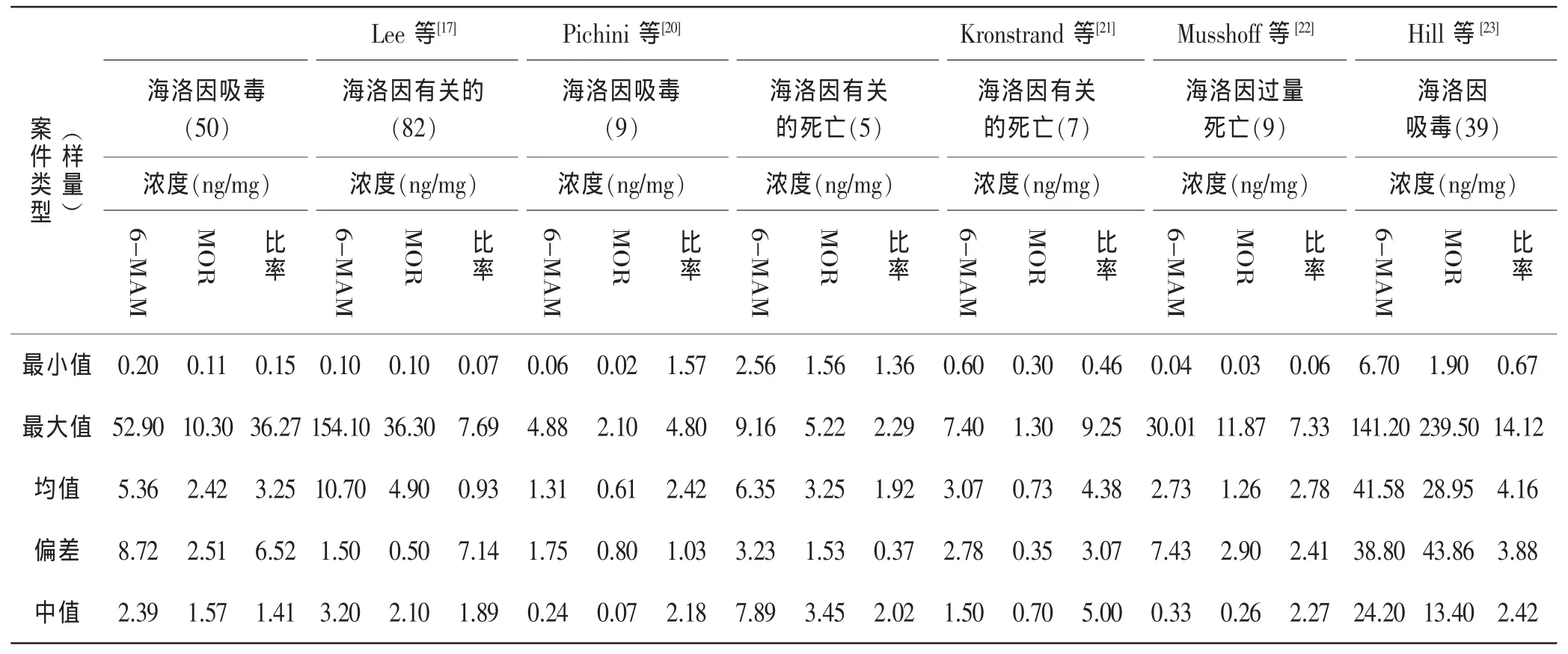
表4 本研究6-单乙酰吗啡与吗啡的浓度比率与其它研究的比较
海洛因吸毒毛发分析时一个很重要的问题是样品前处理时6-单乙酰吗啡在酸、碱条件下可能分解为吗啡,因此,不同的样品前处理方法可能造成不同的定量结果,使分析的结果解释变得复杂化。本研究中,头发样品采用冷冻研磨粉碎、缓冲液(pH 9.2)中超声30min的方法有效地减小了6-单乙酰吗啡的分解。50例头发样品中6-单乙酰吗啡与吗啡的浓度比率在0.15~36.27,大约28%的样品中浓度比率低于1.3,超出了SOHT的建议值。并且,与已有的研究报道[17,20-23]相比,见表4,本研究中比率的最大值相对非常高。造成此差异的原因可能基于样品前处理方法、个体在毒品成分、剂量、代谢、头发颜色、吸毒习惯等方面的差异。有报道[20-23]认为该比率不能作为唯一决定性的判断指标,对比率落在SOHT建议值之外的样品要慎重判断,也有认为该比率应根据分析方法进行修订。基于本研究结果,作者认为头发样品中6-单乙酰吗啡与吗啡的浓度比率存在如此大的差异,难以作为判断海洛因吸毒的指标。
乙酰可待因为海洛因合成过程中的杂质成分,其浓度随合成路线不同存在很大差异。本研究中,所有样品中均可检出乙酰可待因,平均浓度为0.58ng/mg(范围: 0.05~3.99ng/mg)。 但是,我们同意 Kintz 的建议[7],与6-单乙酰吗啡相比,由于其浓度低、差异大,乙酰可待因难以替代6-单乙酰吗啡作为海洛因吸毒的判断指标。
[1]Kintz P.Analytical and practical aspects of drug testing in hair[D].Taylor&Francis Group, LLC, 2007:1-19.
[2]沈敏,向平.毛发分析基础及应用[M].北京:科学出版社,2010:3-34.
[3]向平,沈敏,沈保华,等.生物检材中吗啡类生物碱的LCMS/MS 分析[J].法医学杂志,2006,22(1):52-54.
[4]UNODC,World Drug Report 2012 (United Nations publication, Sales No.E.12.XI.1)[EB/OL].http://www.unodc.org/unodc/en/data-and-analysis/WDR-2012.html
[5]沈敏.体内滥用药物分析[M].北京:法律出版社,2003:105-125.
[6]Moeller MR,Fey P,Sachs H.Hair analysis as evidence in forensic cases[J].Forensic Sci Int, 1993,(63):43-53.
[7]Kintz P,Jamey C,Cirimele V,etal.Evaluation of acetylcodeine as a specific marker of illicit heroin in human hair[J].JAnal Toxicol, 1998,(22):425-429.
[8]Society of Hair Testing.Statement of the Society of Hair Testing concerning the examination of drugs in human hair[J].Forensic Sci Int, 1997,(84):3-6.
[9]孙英英,向平,沈敏.液相色谱-串联质谱法测定头发中11种阿片类生物碱[J].药学学报,2011,46(12):1501-1506.
[10]Kintz P,Bundeli P,Brenneisen R,Ludes B.Dose-concentration relationships in hair from subjects in a controlled heroin-maintenance program[J].JAnal Toxicol,1998,22(3):231-236.
[11]Cone EJ, Darwin WD, Wang WL.The occurrence of cocaine,heroin and metabolites in hair of drug abusers[J].Forensic Sci Int, 1993,(63):55-68.
[12]Kauert G ROhrich J.Concentrations of delta9-tetrahydrocannabinol,cocaine and 6-monoacetylmorphine in hair of drug abusers[J].Int JLeg Med, 1996,(108):294-299.
[13]Goldberger BA,Caplan YH,Maguire T,etal.Testing human hair for drugs of abuse.III.Identification of heroin and 6-acetylmorphine as indicators of heroin use[J].JAnal Toxicol, 1991,(15):226-231.
[14]Rothe M,Pragst F.Solvent optimization for the direct extractionof opiatesfromhair samples[J].JAnaLToxicol, 1995,(19):236-240.
[15]Tsanaclis L,Wicks JF.Differentiation between drug use and environmental contamination when testing for drugs in hair[J].Forensic Sci Int, 2008,176(1):19-22.
[16]Goldberger BA, Cone EJ, Grant TM,etal.Disposition of heroin and its metabolites in heroin-related deaths[J].JAnal Toxicol, 1994,18(1):22-28.
[17]Lee S,Cordero R,Paterson S.Distribution of 6-monoacetylmorphine and morphine in head and pubic hair from heroinrelated deaths[J].Forensic Sci Int, 2009,183(1-3):74-77.
[18]Tsanaclis L,Wicks JF.Patterns in drug use in the United Kingdom as revealed through analysis of hair in a large populationsample[J].Forensic Sci Int, 2007,170(2-3):121-128.
[19]Pépin G, Gaillard Y.Concordance between self-reported drug use and findings in hair about cocaine and heroin[J].Forensic Sci Int, 1997, 84(1-3):37-41.
[20]Pichini S, Pacifici R, Altieri I, etal.Determination of opiates and cocaine in hair as trimethylsilyl derivatives using gaschromatography-tandemmassspectrometry[J].JAnal Toxicol, 1999,(23):343-348.
[21]Kronstrand R, Grundin R, Jonsson J.Incidence of opiates,amphetamines,and cocaine in hair and blood in fatal cases of heroin overdose[J].Forensic Sci Int, 1998,(92):29-38.
[22]Musshoff F,Lachenmeier K,Wollersen H,etal.Opiate concentrations in hair from subjects in a controlled heroinmaintenance program and from opiate-associated fatalities[J].JAnal Toxicol, 2005,(29):345-352.
[23]Hill V,Cairns T,Cheng CC,etal.Multiple aspects of hair analysis for opiates:methodology, clinical and workplace populations, codeine, and poppy seed ingestion[J].J Anal Toxicol, 2005,(29):696-703.

